海沃德猕猴桃组织培养快速繁育技术研究*
2011-07-07张海平周建峰任目瑾
张海平,周建峰,任目瑾
(陕西省苗木繁育中心,陕西眉县 722305)
海沃德猕猴桃,为新西兰优选品种,落叶藤本,生长势强,果实长圆柱形,果皮绿褐色,密被灰白色长绒毛。果肉翠绿色,髓射线明显。平均单果重90 g,最大单果重135 g,果实软熟时可溶性固形物含量为14.7%,果酸1.41%。维生素C含量93.59mg/100 g。在室温下可以贮放30 d左右,在冷藏条件下可贮藏6个月左右,为优良的晚熟耐贮品种。
海沃德猕猴桃常规育苗方法为先播种后嫁接,育苗周期长达2年以上,而扦插繁殖成活率低,均不能满足生产上的需要,致使其良种推广受到很大的限制。随着植物组织培养技术的不断进步,猕猴桃组织培养快速繁育技术也得到了快速发展和普遍应用。采用猕猴桃茎段、叶片作为外植体材料进行组织培养,可以快速繁殖但无菌系建立过程中污染率较高且植株易携带病菌。我们利用猕猴桃茎尖分生组织生长快,不易受病菌侵染的特点进行组织培养试验研究,探索出一整套海沃德猕猴桃组织培养快速繁育技术,已应用于规模化生产。
1 菌系的建立
1.1 外植体的选择
外植体材料选取环球园艺(西安)有限公司引进的新西兰海沃德猕猴桃种苗,剪取海沃德猕猴桃母本穗条早春温室催芽后长出的新芽或引种苗定植后抽生的幼嫩新梢。
1.2 清洗消毒
材料采回后,流水下冲洗干净,将清洗后的外植体在无菌操作台上先用75%酒精处理30 s,无菌水冲洗3次,然后用不同种类和浓度的消毒液进行灭菌试验,再用无菌水分别冲洗5次。不同灭菌剂效果见表1。
表1中的试验结果表明,不同灭菌剂的灭菌效果有差异,其中以有效氯浓度1%的次氯酸钠消毒10 min效果最好,对切口无伤害,接种后感染率低。
1.3 诱导愈伤组织
在超净工作台上,于体视显微镜下,剥取猕猴桃茎尖分生组织,放入不同培养基中进行愈伤组织的诱导培养。茎尖分生组织的诱导培养基以MS培养基作为基本培养基,设定6-BA(1.0、1.5、2.0)和 NAA(0.01、0.02、0.03)3 种不同激素浓度进行组合对照试验,蔗糖、琼脂以经验数据添加。茎尖分生组织的诱导培养结果见表2。
由表2可以看出,不同激素组合对愈伤组织诱导的效果不同,且差异明显。以培养基组合MS+6-BA 2.0 mg/L+NAA 0.01m g/L+30 g/L糖+5.0 g/L琼脂(pH=5.8)为最适宜海沃德猕猴桃愈伤组织诱导培养基,诱导率最高可达84.37%。
1.4 诱导不定芽
无菌环境下,将愈伤组织转接入不同的培养基中进行不定芽的诱导培养。不定芽的诱导培养基以MS作为基本培养基,设定6-BA(0.8、1.0)和NAA(0.1、0.2、0.3)的不同激素浓度组合试验,蔗糖、琼脂以常规经验数据添加。不定芽的诱导培养结果见表3。

表1 外植体表面消毒灭菌效果
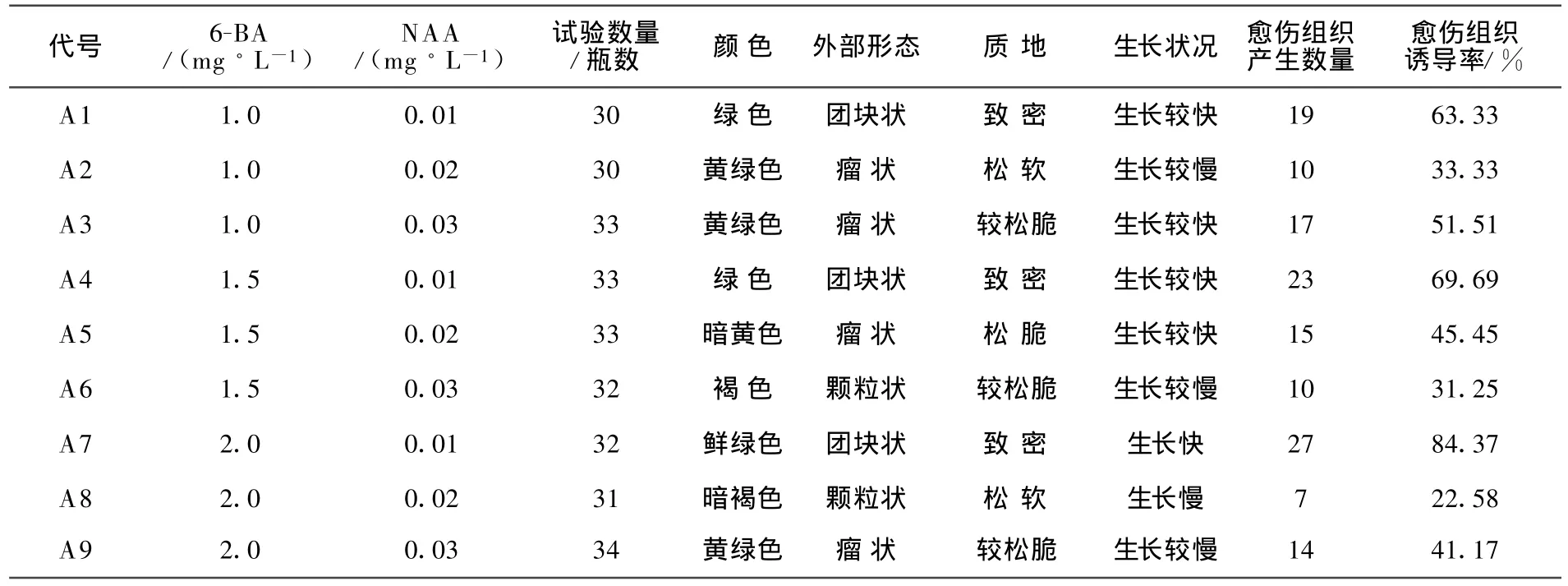
表2 不同激素组合下海沃德猕猴桃愈伤组织生长量
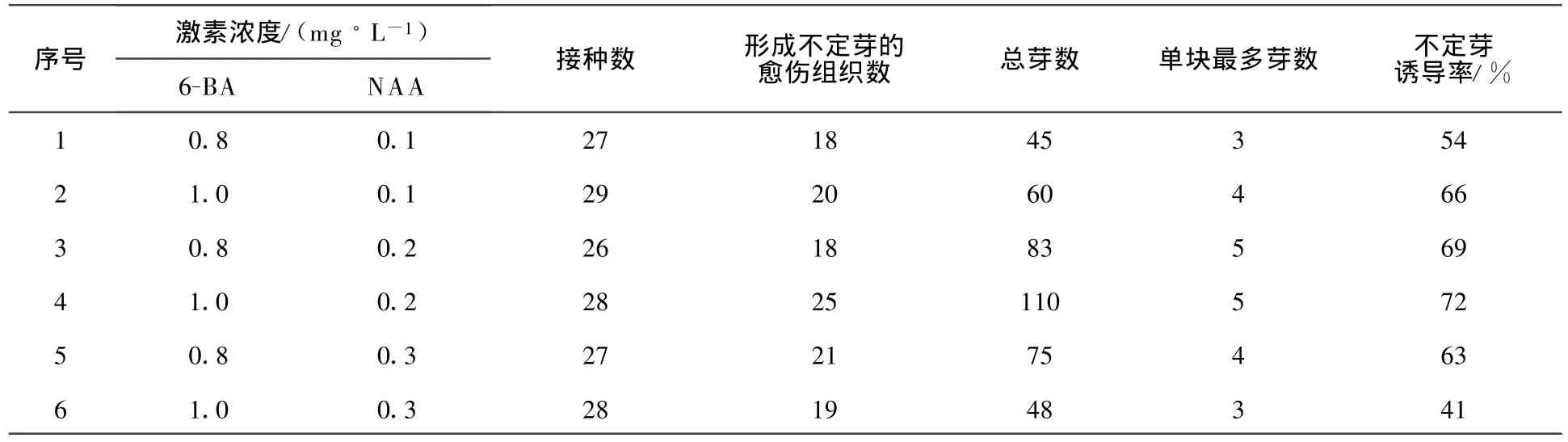
表3 不同处理下海沃德猕猴桃不定芽诱导率
由表3可以看出,不同激素组合对不定芽诱导的效果不同。以培养基组合MS+6-BA 1.0 mg/L+NAA 0.2m g/L+30 g/L糖+5.0 g/L琼脂(pH=5.8)为最适宜海沃德猕猴桃不定芽诱导培养基,诱导率最高可达72%。
2 增殖分化培养
通过猕猴桃分生组织的分离和培养,已得到猕猴桃再生芽,但是数量非常有限,还需要进行增殖分化培养。通过调节外源激素的绝对浓度及不同种类激素的相对配比,可提高增殖分化系数。培养基选用MS、1/2MS、1/3MS,分别附加不同激素浓度的 6-BA(1.0、1.5、2.0)和 NAA(0、0.05、0.1),组成9种组合的增殖分化培养基。培养条件为:光照 1 500~2 000 Lx,温度 25 ℃,光照时数12~15 h/d。猕猴桃增殖分化培养试验的结果见表4。
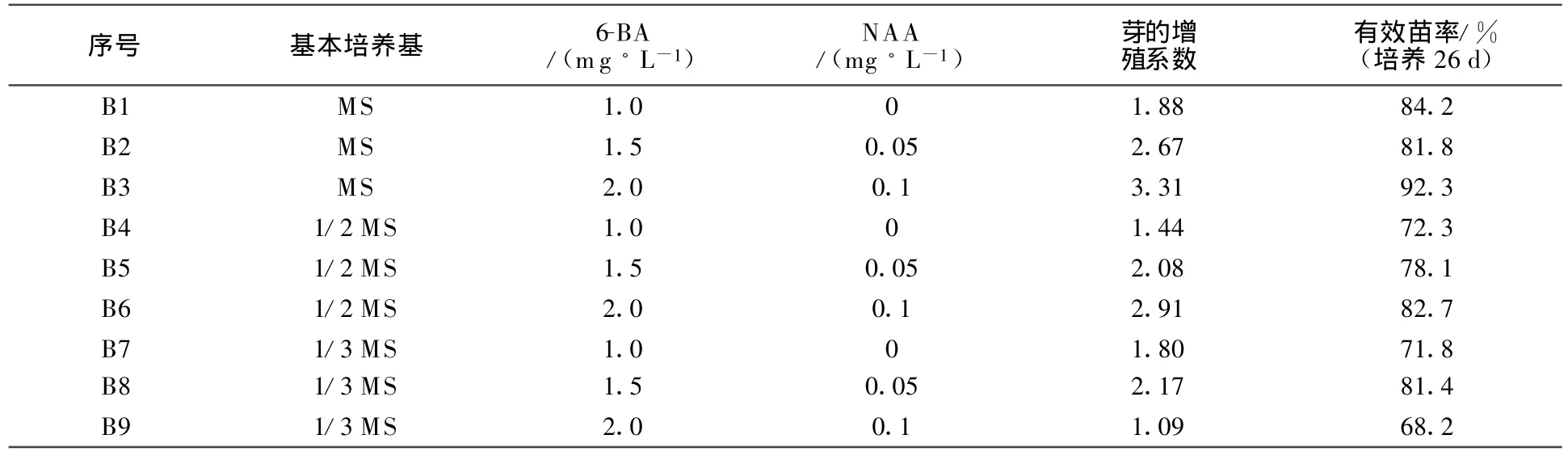
表4 增殖分化培养基对猕猴桃增殖率的影响
由表4可以看出,就培养基来说,基本培养基以MS最好,平均增值系数达到2.62,有效苗率达到 86.1%;从激素浓度来看,6-BA在1.0~2.0,NAA浓度在0~0.1时增殖分化系数有随着激素浓度增大而增大的趋势。结果表明:MS+6-BA 2.0 mg/L+NAA 0.1m g/L+4 g/L琼脂+25 g/L糖为猕猴桃增殖分化培养最理想培养基组合。
3 复壮培养
在继代培养过程中,细胞分裂素浓度的增加有助于不定芽增殖分化系数的提高。但伴随着不定芽增殖分化系数的提高,增殖分化的不定芽往往出现生长势的减弱。不定芽短小、细弱,无法进行生根培养,即使能够生根,移栽成活率也不高,同时,也导致继代培养过程中增殖分化系数的降低。对猕猴桃来说,经过4~5次转接继代以后,总量增加,但分化系数已由最初3.31降为2.18,且瓶苗长势较弱,需进行复壮培养。
复壮培养基为MS+25 g/L糖+4 g/L琼脂。
培养条件为:光照 1 500~2 000 Lx,温度25℃,光照时数12~15 h/d。
4 生根培养
猕猴桃无菌芽经复壮培养后,选择健壮的无菌芽转入生根培养,其余的无菌芽可进入再增殖循环。生根培养基为MS和1/2MS附加不同浓度的NAA(0.3)和IBA(0.1)见表5。

表5 不同培养基对猕猴桃生根的影响
不同的盐浓度和不同的激素浓度组合的培养基生根试验结果表明,雌株(KR)生根以1/2MS+IBA 0.1 m g/L+25 g/L糖+5.0 g/L琼脂的培养基效果较好,生根率最高可达90.0%。
5 炼苗移栽
在培养室常规光照1 000~2 500 Lx,培养15~20 d后,已有2/3苗株新根生长出来,可移至温室驯化炼苗。
在育苗温室搭设塑料拱棚,选用6种不同种类基质(见表6),过筛后加20%的甲基托布津悬浮剂1 000倍,72%的农用链霉素可湿性粉剂1 500倍、2%阿维菌素乳油1 500倍溶液均匀喷洒基质,拌混均匀后,密封放置1星期备用。
逐步增加备炼瓶苗的光照强度,在炼苗前3 d先半开瓶塞,移栽前一天全开瓶塞,让瓶苗逐渐适应温室环境。
出瓶移栽至50孔或72孔的育苗穴盘,然后移入简易拱棚。第一周内光照由1 500~2 000 Lx逐步增加至 3 000~4 000 Lx,日温 25~30℃,夜温20~25℃,湿度75%~90%。第二周逐渐降低湿度,增加光照,穴盘苗生长约20~25 d后,待根系从穴盘下孔透出时可移至15 cm×13 cm的塑料容器,经过半月缓苗即可移入大田培育建园。
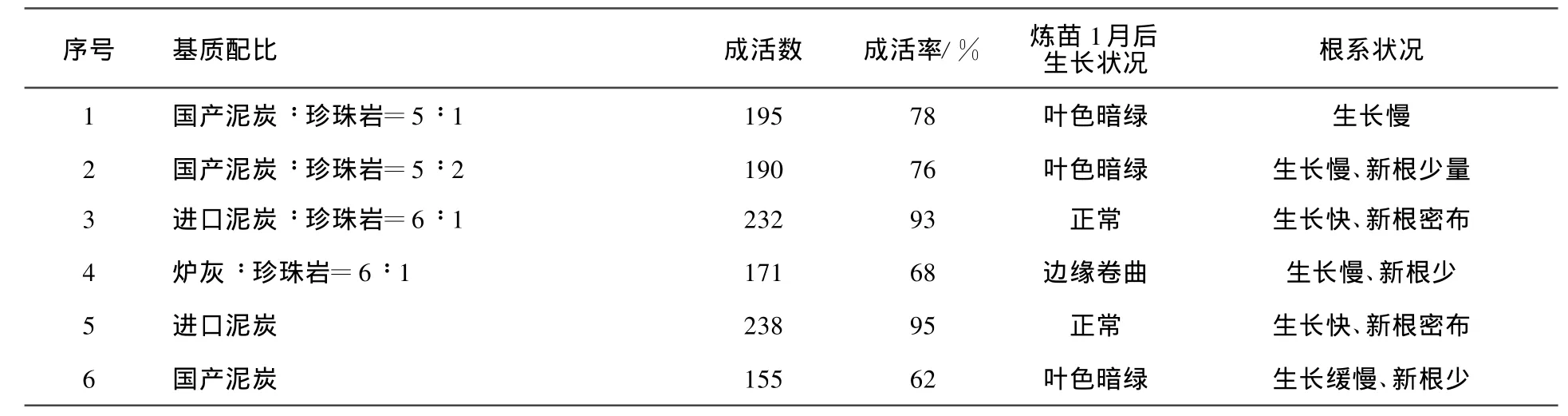
表6 不同基质配比对猕猴桃炼苗成活率的影响
猕猴桃组培苗不同基质移栽试验表明,不同基质对组培苗移栽成活和生长均有显著的影响作用。以进口泥炭和进口泥炭加珍珠岩为基质,移栽成活率最高,可达95%,根系发育良好,植株生长旺盛。
6 结论
(1)猕猴桃(海沃德)分生组织的选取材料为新梢茎尖,MS+6-BA 2.0 mg/L+NAA 0.01mg/L+30 g/L糖+5.0 g/L琼脂(pH=5.8)为最适宜的海沃德猕猴桃愈伤组织诱导培养基,其诱导率最高可达84.37%。
(2)猕猴桃(海沃德)在增殖阶段 MS+6-BA 2.0m g/L+NAA 0.1 mg/L+25 g/L糖+4 g/L琼脂为比较理想的培养基组合,有效苗率达
86.1 %,增值系数为3.31。
(3)猕猴桃生根雌株(KR)以培养基1/2MS+IBA 0.1 mg/L+25 g/L糖+5.0 g/L琼脂效果较好,生根率为90.0%,雄株(CH)以培养基MS+NAA 0.3mg/L+25g/L糖+5.0 g/L琼脂效果理想,生根率为68.3%。
(4)猕猴桃生根炼苗基质选用进口泥炭成活率较高,炼苗成活率可达95%左右。
猕猴桃分生组织培养微繁技术,其关键技术在分生组织无菌系的建立和组培苗生根驯化上,只要技术措施得当,通过精心管理,既可降低成本,又可快速繁殖出一定规模的无毒猕猴桃苗。
[1] 葛新玲,朱立武.猕猴桃高效离体再生体系的研究[J].中国农学通报,2008,24(10):373-376.
[2] 王大平.不同浓度的激素组合对猕猴桃愈伤组织诱导及芽分化的影响[J].安徽农业科学,2007,36(35):11761,11821.
[3] 杨柯金,于向丽,郝薇薇.猕猴桃组织培养研究进展[J].安徽农业科学,2006,34(13):3015-3017.
[4] 谢志兵,鲁旭东.猕猴桃试管苗形态发生的激素效应[J].农业与技术,2003,23(3):101-102.
[5] 谢志兵.猕猴桃组织培养中适宜激素组合的筛选[J].北方果树,2003(3):7-8.
[6] 许淑琼,葛双桃,刘惠芳.猕猴桃的组织培养和快速繁殖[J].西南园艺,2002,30(2):3-4
[7] 陈洪国,熊月明.不同外植体和生长调节剂对猕猴桃愈伤组织形成与再分化的影响[J].福建果树,2001(4):3-4
[8] 汪建亚,蒋祥娥,河村嘉一郎.猕猴桃试管苗愈伤组织诱导及叶片和茎段的再生[J].湖北林业科技,2000(SI):55-56.
[9] 刘旭峰,姚春潮,樊秀芳,等.猕猴桃品种引种试验[J].西北农林科技大学学报(自然科学版),2005,33(4):35-38.
[10] 王建春,李娜,杨长群.海沃德猕猴桃的引种表现及栽培技术[J].落叶果树,2007(2):31-32.
