超细球磨技术用于制备LiNi1/3Co1/3Mn1/3O2
2011-07-05赵军峰胡国荣彭忠东
杜 柯,赵军峰,胡国荣,彭忠东
(中南大学冶金科学与工程学院,湖南长沙 410083)
普通固相法[1]制备 LiNi1/3Co1/3Mn1/3O2的过程简单、成本低,易于产业化,但原料只能微米级混合,难以保证混合均匀,导致产物形貌不规则、颗粒分布不均匀[2]。郭瑞等[1]以高温固相法制备的样品,首次放电比容量为170 mAh/g(2.8~4.4 V、20 mA/g),第 40次循环的容量保持率为 85.3%。共沉淀法[3]、水热法[4]等液相法,可在原子级别混合原料,产物的微观分布均匀,但需要精确控制pH值、反应温度、搅拌速度以及加料速度等条件,洗涤与干燥复杂,成本较高,且无法除去杂质离子,产品的批次稳定性不够高。F.Wu等[4]以水热法制备的样品,首次放电比容量为187.7 mAh/g(2.5~4.8 V、20 mA/g);C.F.Zhang等[3]以草酸盐共沉淀法制备的样品,0.1 C和2.0 C放电比容量分别为159.7 mAh/g和120 mAh/g(2.75~4.0 V)。
超细研磨技术通过循环高速球磨,可实现材料的均匀混合[5],已在光电、医药及纳米材料等行业得到应用。本文作者借鉴该技术,在普通球磨的基础上进行超细球磨,使原料粒度分散得更细、更窄;并用喷雾干燥法处理球磨后的浆料,在短时间内迅速干燥前驱体,以实现原料的球形化;最后高温烧结,制备 LiNi1/3Co1/3Mn1/3O2。
1 实验
1.1 LiNi1/3Co1/3Mn1/3O2的制备
将化学计量比的球形Ni(OH)2(长沙产,电池级)、Co3O4(长沙产,工业级)和Mn3O4(长沙产,工业级)配成10%的溶液,在QM 型行星球磨机(南京产)上球磨(250 r/min,球料比8∶1)2 h后,在SM实验室微珠研磨机(无锡产)上超细球磨(1 500 r/min,球料比10∶1)1 h。将混合物浆料进行喷雾干燥,得到前驱体,进、出口温度分别为 300℃和 100±10℃,喷雾盘转速为15 000 r/min,压缩空气压力为0.5 MPa,塔内压力为-200 Pa。按物质的量比1.00∶1.05混合前驱体和LiOH(四川产,电池级),在马弗炉中,分别在 800℃、900℃或1 000℃下焙烧12 h,随炉冷却,得到LiNi1/3Co1/3Mn1/3O2。
1.2 结构及形貌分析
用Minflex型X射线自动衍射仪(日本产)进行物相和晶体结构分析,CuKα,管压40 kV、管流100 mA,步宽为0.02°,扫描速度为10(°)/min;用 JSM-6360 LV型扫描电子显微镜(日本产)观察样品的形貌。
1.3 扣式电池的组装
将所得LiNi1/3Co1/3Mn1/3O2、乙炔黑(湖南产,电池级)及粘结剂聚偏氟乙烯(湖南产,电池级)按质量比8∶1∶1混合,加入N-甲基吡咯烷酮(天津产,电池级)混匀,制成浆料,涂覆到0.05 mm厚的铝箔(浙江产,99.7%)上,在120℃下真空(-0.08 MPa)干燥 10 h,冲压成Φ=11mm的圆形正极片(约含2 mg活性物质)。
以金属锂片(北京产,99.9%)为负极,Celgard 2400膜(美国产)为隔膜,l mol/L LiPF6+EC/DMC(体积比 1∶1,张家港产)为电解液(0.1 ml),在充满氩气的手套箱(上海产)内组装CR2032型扣式电池。
1.4 电化学性能测试
用电池测试系统(武汉产)对扣式电池进行电化学性能测试,1.0 C=160 mAh。用 Potentiostat/Galvanostat Model 273A电化学工作站(美国产)进行循环伏安测试,电压为2.5~4.8 V,扫描速度为0.2 mV/s。
测试温度均为室温(25℃)。
2 结果与讨论
2.1 前驱体的结构及形貌
图1为LiNi1/3Co1/3Mn1/3O2前驱体的XRD图。

图1 LiNi1/3Co1/3Mn1/3O2前驱体的XRD图Fig.1 XRD pattern of the precursor of LiNi1/3Co1/3Mn1/3O2
从图1可知,前驱体中存在Co3O4、Mn3O4的特征峰,Ni(OH)2的特征主峰位置出现偏移,且强度较弱,说明在制备前驱体时,Co3O4、Mn3O4没有变化,有部分Ni(OH)2分解。
图2为LiNi1/3Co1/3Mn1/3O2前驱体的SEM图。

图2 LiNi1/3Co1/3Mn1/3O2前驱体的SEM图Fig.2 SEM photograph of the precursor of LiNi1/3Co1/3Mn1/3O2
从图2可知,前驱体具有较好的球形形貌,颗粒分布在1~10 μ m,部分大颗粒破碎为小颗粒。
2.2 LiNi1/3Co1/3Mn1/3O2的结构及形貌
制备的LiNi1/3Co1/3Mn1/3O2的XRD图见图3,晶胞参数及 I003/I104见表1。
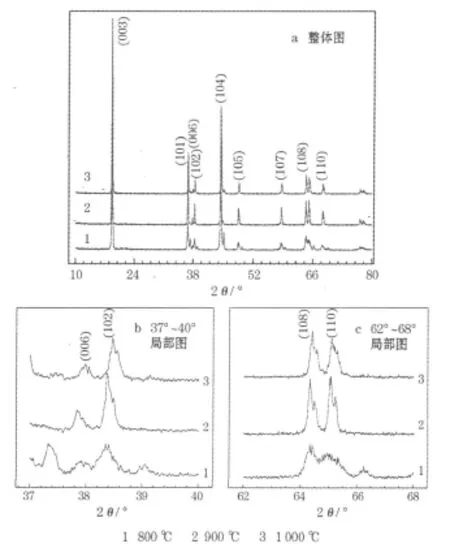
图3 制备的 LiNi1/3Co1/3M n1/3O2的XRD图Fig.1 XRD patterns of synthesized LiNi1/3Co1/3Mn1/3O2

表1 制备的LiNi1/3Co1/3Mn1/3O2的晶胞参数及I003/I104Table 1 Lattice parameters and I003/I104of synthesized LiNi1/3Co1/3Mn1/3O2
从图3可知,制备的LiNi1/3Co1/3Mn1/3O2都有典型的LiNi1/3Co1/3Mn1/3O2衍射峰,说明均为α-NaFeO2结构,属于六方晶系,为 R3m空间群。(006)/(102)和(108)/(110)两组峰的分裂明显说明材料具有良好的层状结构[6],在900℃下制备的材料分裂最明显,在800℃下制备的材料分裂最不明显,说明在900℃下制备的材料层状结构最完整,有利于Li+的嵌脱。c/a大于4.9说明材料具有良好的层状结构,且该值越大,层状结构越完整[7]。从表1可知,在900℃下制备的材料c/a最大,说明该材料的层状结构最好。
在LiNi1/3Co1/3Mn1/3O2中,Ni2+的半径(0.069 nm)与Li+(0.076 nm)的相近[8],容易发生锂镍混排。可根据(003)与(104)峰强度的比值 I003/I104来衡量阳离子混排程度[9]。从表1可知,在 900℃下制备的材料 I003/I104最大,说明在900℃下制备的材料的阳离子混排程度最轻。
图4为制备的LiNi1/3Co1/3Mn1/3O2的SEM图。

图4 制备的LiNi1/3Co1/3Mn1/3O2的SEM图Fig.4 SEM photographs of synthesized LiNi1/3Co1/3Mn1/3O2
从图4可知,制备的 LiNi1/3Co1/3Mn1/3O2颗粒分布差别不大,均在1~3 μ m,且在 1 000℃下制备的材料团聚明显。
2.3 LiNi1/3Co1/3Mn1/3O2的电化学性能
制备的LiNi1/3Co1/3Mn1/3O2在电流为0.1 C、电压为2.8~4.3 V时的电化学性能见图 5。

图5 制备的LiNi1/3Co1/3Mn1/3O2在电流为0.1 C时的电化学性能Fig.5 Electrochemical performance of synthesized LiNi1/3Co1/3 M n1/3O2with the current of 0.1 C
从图5可知,在电流为0.1 C时,在900℃下制备的Li-Ni1/3Co1/3Mn1/3O2的首次放电比容量和放电平台电压最高,循环稳定性最好。循环30次,容量保持率为98.8%。
在900℃下制备的LiNi1/3Co1/3Mn1/3O2在不同电流下、电压为2.8~4.3 V时的电化学性能见图6。

图6 在900℃下制备的LiNi1/3Co1/3Mn1/3O2在不同电流下的电化学性能Fig.6 Electrochemical performance of LiNi1/3Co1/3Mn1/3O2 synthesized at 900℃with different currents
从图 6可知,在900℃下制备的 LiNi1/3Co1/3Mn1/3O2的0.1 C、0.2 C、0.5 C、1.0 C及 2.0 C首次放电比容量分别为162.5 mAh/g、158.9 mAh/g、151.3 mAh/g、146.8 mAh/g和138.6 mAh/g,倍率性能良好。文献[10]中,液相法所得材料的1.0 C放电比容量仅145 mAh/g;文献[1]中,固相法所得材料因混合不均匀、材料颗粒粗大等原因,1.0 C放电比容量多低于140 mAh/g。在900℃下制备的材料经2.0 C循环再以0.2 C循环,放电比容量从约136 mAh/g恢复到约159 mAh/g,说明在较高倍率放电下的结构稳定。
在900℃下制备的LiNi1/3Co1/3Mn1/3O2在不同充电截止电压(放电终止电压为2.8 V)的首次充放电曲线见图7。

图7 在900℃下制备的LiNi1/3Co1/3Mn1/3O2在不同充电截止电压时的充放电曲线Fig.7 Charge-discharge curves of LiNi1/3Co1/3Mn1/3O2synthesized at 900℃with different charge cut-off voltages
从图7可知,在900℃下制备的 LiNi1/3Co1/3Mn1/3O2的放电比容量随着充电截止电压的提高而提高。充电截止电压为4.3 V、4.4 V、4.5 V及4.6 V时,首次放电比容量分别为162.5 mAh/g、173.1 mAh/g、184.6 mAh/g 和 200.1 mAh/g。
在900℃下制备的LiNi1/3Co1/3Mn1/3O2的循环伏安曲线见图8。
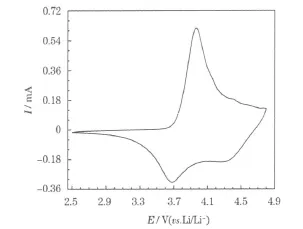
图8 在900℃下制备的 LiNi1/3Co1/3Mn1/3O2的循环伏安曲线Fig.8 CV curve of LiNi1/3Co1/3Mn1/3O2synthesized at 900℃
从图8可知,在900℃下制备的 LiNi1/3Co1/3Mn1/3O2在3.9 V左右有一个氧化峰,对应着Ni2+参与反应,相应的还原峰在3.65 V左右;同时在4.4 V左右有一个小的氧化峰,对应Co3+参与反应,相应在4.3 V左右有一个宽化的还原峰。随着充电截止电压的提高,参加反应的电子数越来越多,充放电比容量不断提高。
在900℃下制备的LiNi1/3Co1/3Mn1/3O2在不同充电截止电压下的循环性能见图9。

图9 在900℃下制备的LiNi1/3Co1/3Mn1/3O2在不同充电截止电压下的循环性能Fig.9 Cycle performance of LiNi1/3Co1/3Mn1/3O2synthesized under 900℃with different charge cut-off voltages
从图9可知,在900℃下制备的 LiNi1/3Co1/3Mn1/3O2在2.8~4.6 V具有近200 mAh/g的放电比容量,而且在不同截止电压下的循环性能相对稳定。文献[3,8]中,同类材料在2.8~4.6 V循环,具有190~200 mAh/g的放电比容量,因此制备的材料与同类材料相比,具有较好的高压放电性能。经过了4.6 V的高压充放电后再回到2.8~4.3 V充放电,放电比容量从158.9 mAh/g降低到约 152 mAh/g,容量保持了95.7%,且循环稳定,具有较好的容量恢复特性,说明制备的材料在2.8~4.6 V充放电,只是参与反应的电子数增加,结构并未受到不可逆的破坏。
3 结论
本文作者用超细球磨-喷雾干燥法制备前驱体,再用高温固相法制备正极材料LiNi1/3Mn1/3Co1/3O2。该方法克服了纯固相法不能实现原料均匀混合的缺点,与液相法相比,制备过程简单、易于控制,效率高,产品的颗粒大小及粒径分布易于控制。
在900℃下焙烧12 h制备的材料在2.8~4.3 V循环,0.1 C、2.0 C首次放电比容量分别为162.5 mAh/g、138.6 mAh/g;在2.8~4.6 V循环,倍率性能及高截止电压充放电性能良好。
循环伏安曲线及不同截止电压下的充放电曲线,证实了制备的LiNi1/3Co1/3M n1/3O2中,镍、钴在不同的电压区间内参与电化学反应。
[1]GUO Rui(郭瑞),SHI Peng-fei(史鹏飞),CHENG Xin-qun(程新群),et al.高温固相法合成 LiNi1/3Mn1/3Co1/3O2及其性能研究[J].Chinese Journal of Inorganic Chemistry(无机化学学报),2007,23(8):1 387-1 392.
[2]WU Yu-ping(吴宇平),DAI Xiao-bing(戴小兵),MA Jun-qi(马军旗),et al.锂离子电池——应用与实践[M].Beijing(北京):Chemical Industry Press(化学工业出版社),2004.147-157.
[3]Zhang C F,Yang P,Dai X,et al.Synthesis of LiNi1/3Co1/3Mn1/3O2cathode material via oxalate precursor[J].Transactions of Nonferrous Metals Society of China,2009,19(3):635-641.
[4]Wu F,Wang M,Su Y F,et al.A novel method for synthesis of layered LiNi1/3Mn1/3Co1/3O2as cathode material for lithium-ion battery[J].J Power Sources,2010,195(8):2 362-2 367.
[5]Balaz P,Dutkova E.Fine milling in applied mechanochemistry[J].Miner Eng,2009,22(7-8):681-694.
[6]Sclar H,Kovacheva D,Zhecheva E,et al.On the performance of LiNi1/3Mn1/3Co1/3O2nanoparticles as a cathode material for lithiumion batteries[J].J Electrochem Soc,2009,156(11):938-948.
[7]Yabuuchi N,Makimura Y,Ohzuku T.Solid-state chemistry and electrochemistry of LiCo1/3Ni1/3Mn1/3O2for advanced lithium-ion batteries[J].J Electrochem Soc,2007,154(4):314-321.
[8]Zhang X Y,Jiang W J,Maugerc A,et al.Minimization of the cation mixing in Li1+x(NMC)1-xO2as cathode material[J].J Power Sources,2010,195(5):1 292-1 301.
[9]YU Xiao-yuan(禹筱元),YU Shi-xi(余仕禧),HU Guo-rong(胡国荣),et al.合成方法对 LiNi1/3Co1/3Mn1/3O2性能的影响[J].Battery Bimonthly(电池),2008,38(3):133-135.
[10]Ren H B,Wang Y R,Li D C,et al.Synthesis of LiNi1/3Co1/3Mn1/3O2as a cathode material for lithium battery by the rheological phase method[J].J Power Sources,2008,178(1):439-444.
