低温燃烧法制备纳米ZnO及其性能表征
2011-07-05米晓云吴锡惠吴文花孙海鹰
米晓云,吴锡惠,吴文花,孙海鹰
(长春理工大学 材料科学与工程学院,长春 130022)
ZnO是一种宽禁带、直接带隙的半导体材料,室温下禁带宽度3.37eV,激子束缚能60meV。由于其宽的带隙、高的激子束缚能、低的毒性和高的光学稳定性;其粒子的尺寸小,比表面积大,因而具有明显的表面效应、量子尺寸效应以及宏观量子隧道效应等特点,并且使得纳米氧化锌作为一种新型功能材料,在磁、光、电、催化、抗菌消毒、紫外线屏蔽等方面具有普通氧化锌产品不可比拟的特殊性能和用途。因此,纳米氧化锌及其改性成为国内外研究的热点[1-3]。
制备纳米ZnO材料的方法很多,物理方法有机械粉碎法、气相沉积法、溅射法;化学方法如溶胶-凝胶法、水热法、低温燃烧法以及各种热分解法等。不同的方法得到的样品颗粒大小、表面性质以及表面附着物都可能不同,这些都将影响样品的发光性能。低温燃烧法具有合成工艺简单,不需复杂设备,易合成多组分化合物,纳米级产物具有优良性能等优点。
本文以尿素为燃料,硝酸锌为氧化剂,采用低温燃烧法技术快速合成了粒径在10-50nm分散性好的六方相纤锌矿结构纳米ZnO粉体,并利用XRD衍射谱、荧光光谱以及扫描电镜对样品进行了测试与表征。
1 实验
1.1 样品制备
采用 Zn(NO3)2·6H2O(A.R),CO(NH2)2(A.R),无水乙醇(A.R),NH3·H2O(A.R)作为原料,按照一定的化学计量比称取各试样,充分研磨成浆状物,调节pH,并在不同的温度进行燃烧获得样品。
1.2 性能表征
采用日本理学D/max-IIB型X射线衍射(X-ray diffraction,XRD)仪测试样品的物相组成,辐射源Cu Kα,X射线管压为40kV,管流为20mA,扫描速度为4/min,步长为0.02°。用日本日立F-4500型荧光光谱仪测量样品的激发和发射光谱激发源为150 W 氙灯。采用型号为JSM-6701F的场发射扫描电镜(scanning electron microscope,SEM)测试分析样品的形貌。
2 结果与讨论
2.1 原料配比、点火温度、pH值对样品XRD的影响
图1是配比不同时产物所对应的XRD衍射图谱,三个样品的XRD衍射峰位置与六方相ZnO的标准卡(PDF No.5-664)数据完全一致,未见杂峰,说明制备的是纯六方相ZnO粉末。
由图1可知,Zn(NO3)2·6H2O(A.R)与CO(NH2)2的配比为1:3.4(摩尔比)所得的反应产物的衍射峰的强度最大,此后随着尿素的含量的增加,衍射峰强越来越弱,这是因为尿素越多燃烧时放出的气体量也越多,带走的热量也越多,使火焰温度有所降低,这使得产物中的ZnO的结晶性能降低。另外,当尿素含量很少时,燃烧时产生的气体量少,热量释放不足,火焰温度很低,甚至不产生火焰,导致原料混合物燃烧不完全,同样使衍射峰强度降低。
分析结果表明1:3.4是硝酸锌与尿素反应的最佳配比。根据谢乐公式计算硝酸锌与尿素配比为1:3.4时颗粒的粒径。
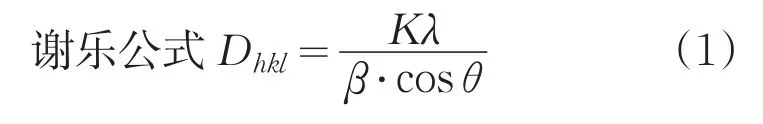
Dhkl是垂直于(hkl)晶面方向的晶粒尺寸,λ为所用X射线波长,θ为布拉格角,β是由于晶粒细化引起的衍射峰(hkl)的宽化(单位为rad);而K为一常数,β取衍射峰的半高宽β1/2,K=0.89。实验所用X射线波长λ=0.15406nm。经计算,粒径尺寸为42 nm。
图2硝酸锌与尿素配比为1:3.4时点火温度分别为500℃,600℃,700℃时的XRD衍射图谱,从图中可以看出衍射峰的位置与标准卡(PDF No.5-664)吻合,说明得到的是纯的六方纤锌矿结构的ZnO。600℃时的峰强度最大,500℃时的衍射峰强度最低。这是因为500℃燃烧不充分,所以反应温度低,没有足够的能量使产物完全晶化。这可能是因为参加燃烧的可燃气体少,从而燃烧温度低,达不到ZnO的相转变温度。另一个原因可能是由于点火温度低,原料的加热速率小,不易于在燃烧前使物料中的水分完全蒸发,燃烧中由于残余水分的蒸发,也会使火焰温度降低[4]。700℃时,点火温度高,使得燃烧反应过为剧烈,气体瞬间放出,将热量部分带走,使得样品结晶性能降低。所以在本实验条件下要使产物生成ZnO,点火温度只需控制在600℃即可。
根据谢乐公式计算600℃时颗粒的粒径为42 nm。
图3为pH值不同时样品的XRD衍射谱。由图可知,pH值为弱碱性时的XRD衍射谱强度最大。这是因为硝酸锌本身呈酸性,随着氨水的加入,产生的大量氨气比不加氨水时更多,可参与气相反应,形成火焰,从而保证反应的进行,并使产物更蓬松。此时颗粒的粒径为40 nm[5,6]。
2.2 原料配比、点火温度、pH值对发光性能的影响
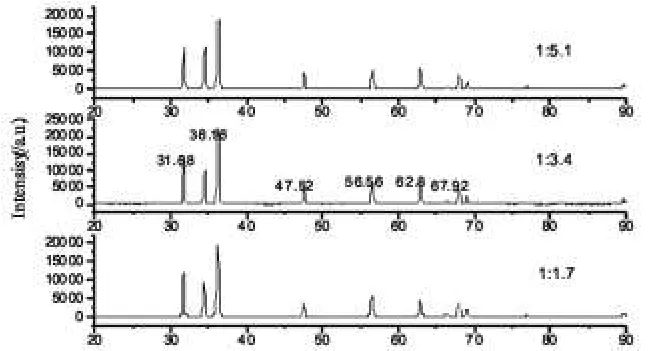
图1 不同原料配比样品的XRD谱Fig.1 X-ray diffraction of different composition ratio
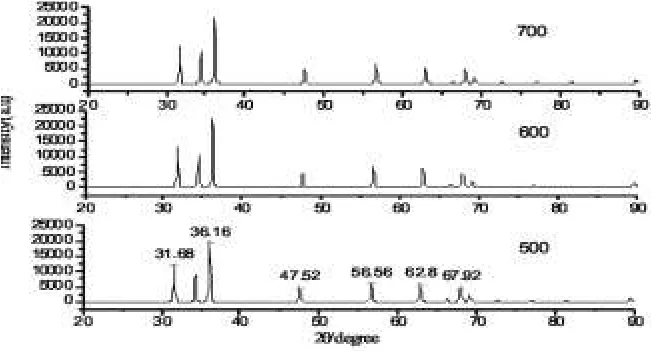
图2 不同点火温度样品的XRD谱Fig.2 X-ray diffraction of different ignition temperature
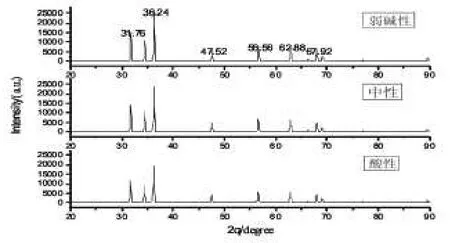
图3 不同pH值样品的XRD谱Fig.3 X-ray diffraction of different pH value
图4为配比不同时得到的产物ZnO的发射光谱。由图可知配比为1:3.4时的产物,其发射光谱强度最佳。这是因为,燃料不足时,热量释放相对低,环境温度较低,减缓了反应速率;燃料过量时,先驱物燃烧会产生大量的气体,被释放的气体越多,系统内被带走的热量也越多,同时燃料过量时需要另外提供氧,由于动力学因素,氧是以扩散的方式进入反应区,这就限制了反应速率;燃料与氧化剂的比例在一个适当的范围内,先驱物含有的氧正是燃烧反应的氧源,一旦NO3-中产生了大量的氧,便立即与尿素反应,消耗大量的燃料,因此燃料适量时,反应速率大,燃烧温度高,ZnO纳米粉体结晶好,发光强度高[4]。
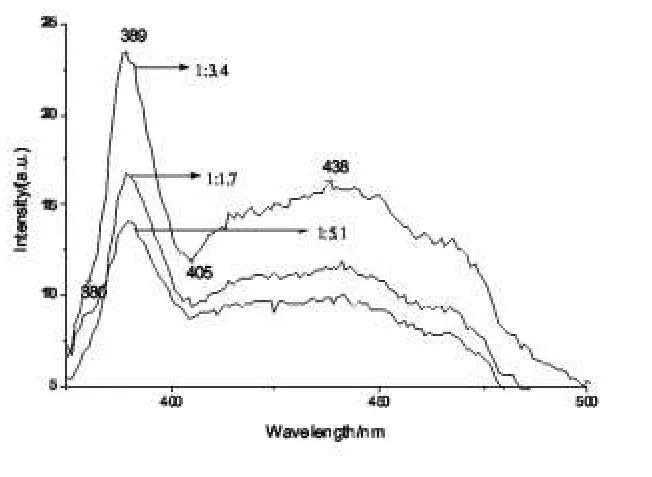
图4 不同原料配比样品的发射光谱Fig.4 Emmision spectra of different ratio of raw material
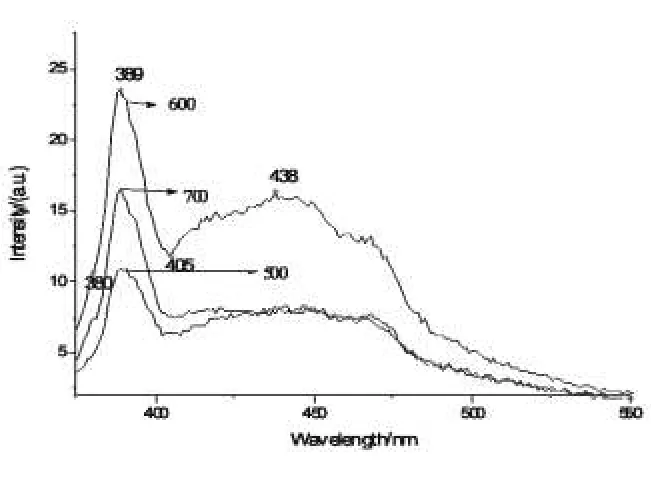
图5 不同点火温度样品的发射光谱Fig.5 Emission spectra of different ignition temperature
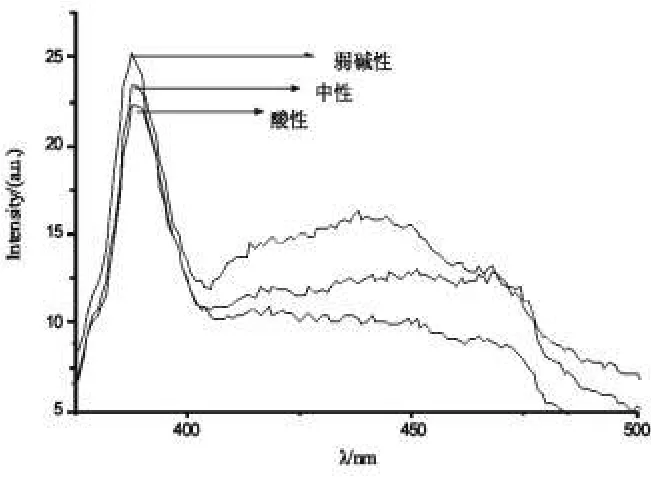
图6 不同pH值样品的发射光谱Fig.6 Emission spectra of different pH value
图5是点火温度不同时产物的发射光谱。由图可以看出,600℃时的发光峰强度最大,500℃时的发光峰强度最低。这是因为点火温度过低时,反应放出的可供燃烧的气体少,燃烧温度降低,使得得到的ZnO相对含量降低,其发光强度就会有所降低。700℃时,点火温度高,使得燃烧反应过为剧烈,气体瞬间放出,将热量部分带走,使得样品结晶性能降低,导致发光性能降低。
图6是pH值不同时反应产物的发射光谱。从图中可以看出,弱碱性时得到的产物发光性能最佳。这与XRD图谱分析的结果相对应。
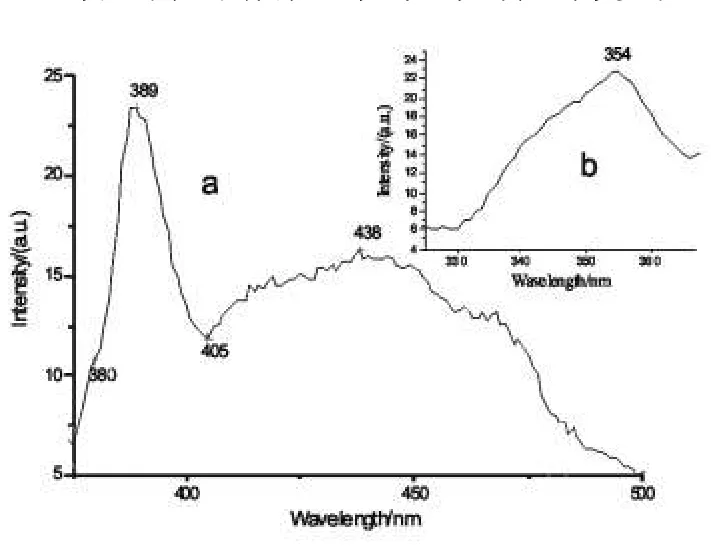
图7 原料配比为1∶3.4、点火温度为600℃、反应条件为弱碱性时样品的发射(a)与激发(b)光谱Fig.7 Emission spectra(a)and excitation spectra(b)of the samples when the ratio of reactants was 1∶3.4 and ignition temperature was 600℃in the weak alkaline entertainment
2.3 ZnO的光谱
图7是硝酸锌与尿素配比为1:3.4、点火温度是600℃、反应条件为弱碱性时的激发与发射光谱,激发波长为354nm。ZnO发射光谱(a)中有389nm 438nm两个发光峰。389nm是电子空穴复合发光,而438nm是ZnO本征缺陷辐射发光引起的。
2.4 纳米ZnO的SEM分析
图8是硝酸锌与尿素配比为1:3.4、点火温度是600℃、弱碱性条件下得到的ZnO的SEM图。
由图可知,得到的粉体颗粒在10~50nm之间,主要集中在40nm左右,而根据谢乐公式算出的颗粒粒径均在40nm左右,与扫描电镜的结果符合,说明用此法可以得到分散好的纳米ZnO粉体。

图8 纳米ZnO的SEMFig.8 SEM of nano-ZnO powders
3 结论
采用低温燃烧法快速合成了纳米ZnO。样品具有优异的光学性质,且点火温度、配比、pH值对样品性能有很大影响。样品的发光峰位于389nm、438nm处,389nm是由于电子-空穴复合发光,而438nm是ZnO本征缺陷辐射发光引起的。样品粒度均匀,粒径范围在10~50nm之间。
[1]Mondia J P,Sharma R,Schäfer J,et al. An electrodynamically confined single ZnO tetrapod laser[J].Appl Phys Lett,2008,93(12):121102.
[2]Wu Y L,Lim C S,Fu S.Surface modifications of ZnO quantum dots for bio-imagine [J].Nanotechnology,2007(9):215604.
[3]Kim Kyoung-Kook,Lee Sam-dong,Kim Hyunsoo,et al.Enhanced light extraction efficiency of GaN-based light emitting diodes with ZnO nanorod arraysgrown using aqueoussolution[J].ApplPhys Lett,2009,94(3):071118.
[4]李汶霞,殷声.低温燃烧合成陶瓷微粉[J].硅酸盐学报,1999,27(1):71-76.
[5]Pavindranathan P,Komarneni S,Roy R.Synthesis of lithium aluminates,mullite and colored zirconia by a combustion process[J].J Mater Sci Lett,1993,12:289-371.
[6]Segades A M,Morelli M R,Kiminami R G A.Combustion synthesis of aluminum titanate[J].J Eu Ceram Soc,1998,18(7):771-781.
