甲型H1N1流感病毒血凝素HA1蛋白的真核表达与纯化
2011-06-28李燕迟莹卞倩温恬张文帅焦永军
李燕 迟莹 卞倩 温恬 张文帅 焦永军
流行性感冒(流感)是一种最常见的病毒性急性呼吸道传染病,至今无法完全加以控制[1-2],流感给个人和社会带来的经济损失始终列于各传染病之首。流感传染性强,尤其在老年人中有很高的发病率,并易导致肺炎等严重并发症,甚至死亡[3-4]。其病原为流行性感冒病毒(流感病毒),属于正粘病毒科,分甲、乙、丙3个型别,其中甲型流感病毒的致病力最强[5-6]。近年来,由于甲型流感多次引起大规模的世界性流行,已引起了研究者们的高度关注[7-9]。2009年3月起美国、墨西哥出现A/H1NI流感(我国称甲型H1N1流感)病例并形成疫情,以后迅速蔓延,疫情扩大到100多个国家或地区,呈全球蔓延态势[10-11]。
流感病毒表面血凝素(hemagglutinin,HA)是流感病毒合成的重要蛋白[12]。HA在流感病毒的致病过程中有重要作用,同时 HA和神经氨酸酶(neuraminidase,NA)抗原性的差异是甲型流感病毒(influenza virus A)亚型划分的主要依据[13]。在动物体内由于免疫力的作用,流感病毒HA基因非常容易发生抗原漂移,导致待测病毒与标准检测抗体的交叉反应性差,给检测及防治工作带来许多困难。因此,人工表达HA蛋白,对流感的快速准确检测以及制备基因工程疫苗具有重要的应用价值。而HA1是HA基因的高度保守区域[14-15],HA 蛋白具有6 个糖基化位点,其中5个N糖基化位点位于HA1上,HA1上的一些区域表现出很强的抗原特性,HA1蛋白的表达与纯化对流感的快速准确检测以及制备基因工程疫苗具有重要意义,因此,本研究旨在为进一步制备快速诊断试剂及开发基因工程疫苗,构建了甲型SWH1N1流感病毒血凝素HA1蛋白的杆状病毒真核表达载体,转染sf 9细胞表达并纯化其编码蛋白。
1 材料和方法
1.1 病毒毒株、质粒及细胞 江苏甲型SWH1N1流感病毒毒株[A/Jiangsu/1/2009(H1N1)]、DH10Bac、大肠杆菌E.coli TOP10感受态细胞及sf 9细胞为江苏省疾病预防控制中心病原生物所保存。
1.2 试剂 PCR试剂盒(Qiagen公司)、胶回收试剂盒(Omega公司);Taq DNA聚合酶、限制性内切酶Xhol 1 及 Bgl 2、DNA 连接酶试剂盒、pMD18-T Simple Vector试剂盒、质粒纯化试剂盒、RNA提取试剂盒(TaKaRa 公司);Lipofectamine2000、Opti-MEM(Invitrogen 公司);DMEM-1000(Gibco 公司);anti-His antibody(abcam公司);其他试剂均为国产分析纯。
1.3 流感病毒总RNA的提取 参照试剂盒使用说明提取流感病毒总RNA。
1.4 引物设计 根据甲型SWH1N1流感病毒HA1基因序列[A/Jiangsu/1/2009(H1N1)],设计上下游引物,由上海生工生物工程技术服务有限公司合成,序列如 下:上 游 引 物 5'-GG GAATTCCTATGAAGGCAATACTAGTA-3';下 游 引 物 5'-AG CTCGAGGC TAGGCCTCTAGATTGAAT-3'。引物序列下划线为酶切位点,分别是 EcoR1(GGATCC)和 Xhol 1(CTCGAG)。预期扩增产物为HA1基因,片段长度约为1038 bp。
1.5 RT-PCR扩增甲型SWH1N1流感病毒HA1基因以提取的流感病毒总RNA为模板,一步法扩增HA1全长基因,RT-PCR体系参照试剂盒使用说明。RTPCR反应条件为:50℃ 30 min,95℃变性15 min,然后94 ℃30 s,55 ℃ 30 s,72 ℃ 2 min,35个循环,最后72℃延伸10 min。1%琼脂糖凝胶电泳检测。
1.6 真核表达体系 HA1-p-fast质粒的构建 EcoR1和Xhol1分别双酶切阳性HA1 PCR产物与p-fast质粒,酶切产物1.0%琼脂糖凝胶电泳,胶回收后连接酶切产物,连接产物转化TOP10F'感受态细胞,涂板后挑取单个菌落培养扩增,提取质粒进行 PCR及酶切鉴定,鉴定为阳性的重组载体进行基因测序分析,测序正确的质粒命名为 HA1-p-fast。
1.7 转座构建杆状病毒HA1-Bacmid 取测序正确的HA1-p-fast质粒转化 DH10Bac 细胞,涂板(平板含:50 μg/ml kana、7 μg/ml的 genta、10 μg/ml tet、100 μg/ml Bluo-gal、40 μg/ml IPTG),倒置培养 48 h,挑取白斑培养扩增(含:50 μg/ml kana、7 μg/ml的 genta、10 μg/ml tet),菌液经M13和HA1双重PCR鉴定,提取阳性质粒,命名为 HA1-Bacmid。
1.8 重组表达HA1蛋白 sf9细胞常规接种于6孔板中,使用含10%胎牛血清的Grace's完全昆虫培养基,27℃,无CO2条件下培养,待细胞密度达70%~80%后进行转染。Bacmid DNA用的Grace's昆虫培养基(无添加剂、无血清)稀释混匀后置室温作用5 min,在另一管中将脂质体LipofectamineTM2000与Grace's培养基稀释混匀室温作用5 min,将稀释的质粒DNA和脂质体培养液混匀,室温孵育30 min。将混合物加入到培养板中。培养4~6 h,换成Grace's完全昆虫培养基,继续培养5 d左右,观察细胞病变情况,待细胞70%以上出现病变后检测HA1蛋白的表达。收取HA1蛋白表达阳性的P1代细胞上清,依次感染P2、P3代细胞,以获得大量的HA1蛋白。
1.9 重组HA1蛋白的纯化 收集细胞,4℃ 7000~8000 g离心10 min,收集细胞沉淀,冰水中超声破碎细胞,破碎液4℃ 12 000 g离心10 min,加20 mmol/L咪唑溶液,过0.45 μm的滤膜,取1ml镍琼脂糖凝胶FF预装柱,用10 ml平衡缓冲液(pH 7.4的50 mmol/L磷酸缓冲液,含 0.5 mol/L NaCl,8 mol/L 脲素,20 mmol/L咪唑)平衡,上样,洗涤,用5 ml洗脱缓冲液洗(pH 7.4的50 mmol/L磷酸缓冲液含0.5 mol/L NaCl,8 mol/L脲素,含500 mmol/L咪唑)洗脱吸附的样品,流速1~2 ml/min,2 ml/管收集。
1.10 免疫印迹鉴定表达 纯化蛋白SDS-PAGE蛋白电泳后,用湿转法将蛋白从凝胶转移到PVDF膜上,用5%的脱脂奶粉封闭。一抗为1∶500过氧化物酶标记的抗HIS多克隆抗体,4℃孵育过夜。用增强化学发光蛋白免疫印迹法(ECL)进行Western blot显色分析。
2 结果
2.1 HA1基因的鉴定 HA1基因PCR扩增产物经1.0%琼脂糖凝胶电泳分析,在约1000 bp处可见单一特异性条带,大小与HA1基因理论值一致,见图1。

图1 HA1基因PCR产物的琼脂糖电泳分析
2.2 HA1-p-fast质粒的鉴定 通过T4连接酶将EcoR1和Xhol1双酶切的阳性HA1 PCR产物与p-fast载体进行连接,转化大肠杆菌TOP10感受态细胞,挑5个单克隆进行特异性HA1引物PCR鉴定,结果均为阳性(图2)。取其中1个阳性克隆摇菌提取质粒,EcoR1和Xhol1双酶切,同时用HA1引物PCR鉴定,电泳鉴定双酶切及PCR均有约1000 bp左右的目的带(图3),结果表明HA1基因片段正确克隆到载体p-fast上。
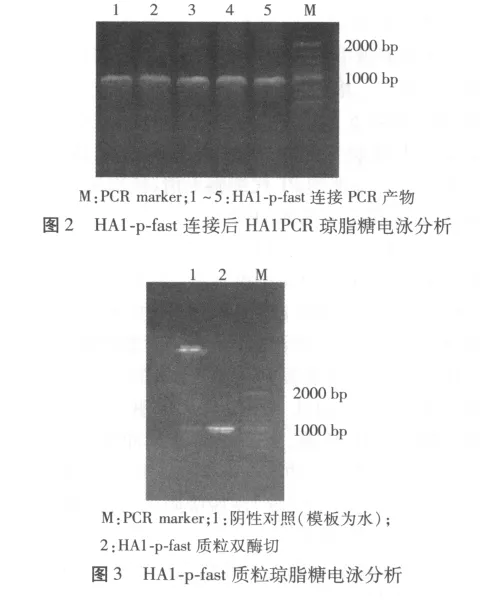
2.3 HA1-Bacmid的鉴定 取测序正确的 HA1-p-fast质粒转化DH10Bac细胞,涂板,培养后挑取5个阳性克隆,摇菌,菌液经HA1的特异性引物和M13的通用引物PCR鉴定,电泳鉴定双酶切及PCR均有约1000 bp左右的目的条带(图4)。结果表明已获得正确的HA1-Bacmid。
图4 HA1-Bacmid琼脂糖电泳分析
2.4 Western blot鉴定转染结果 转染HA1-Bacmid的P1代sf9细胞表达的重组蛋白可以被抗His抗体所特异性识别,其大小与预期相同,同时空载体组与空白对照组无条带,表明HA1在sf 9细胞中得到表达(图5)。

图5 Western印迹法检测HA1-Bacmid在sf9细胞的表达
2.5 重组蛋白的纯化鉴定 采用亲和层析方法,特异性结合分离HA1蛋白,收集纯化后的蛋白,SDS凝胶电泳,考染后扫描分析目的蛋白的纯度为90%左右(图6)。
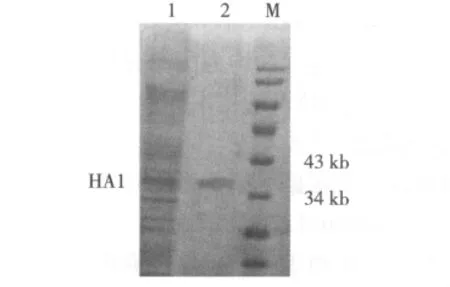
图6 SDS凝胶电泳法检测HA1蛋白的纯化
3 讨论
流感病毒的危害性极大,全世界平均每年有50万~100万人死于流感[16]。流感传染性强,尤其在≥60岁的老年人中有很高的发病率,并易导致肺炎等严重并发症,甚至死亡。流感病毒是致流感的主要病原体。流感病毒属正粘病毒科,基因组为分节段负链RNA。甲型流感病毒根据HA和NA抗原性的不同,HA可以分为16个亚型,NA分为9个亚型[17]。H1N1亚型流感病毒和其他甲型流感病毒一样,其HA基因中的HA1基因变异决定了其抗原性特点,其变异与流感的流行及流行规模的大小密切相关[18]。同时,HA1是各亚型流感之间HA差异的主要区域,具有型特异性。用HA1蛋白作为检测抗原,从理论上讲应该能够区别其他亚型的特点,同时降低鉴别诊断的假阳性率。
杆状病毒昆虫细胞表达系统是真核表达系统中应用广泛的一类表达系统,有很多优点,具有与大多数高等真核生物相似的翻译后修饰、加工以及转译外源蛋白的能力,表达的蛋白具有良好的生物学活性,表达水平高;同时,作为表达载体的杆状病毒,其自身的蛋白在哺乳动物体内也没有相应的抗体,因此与哺乳动物的交叉反应小[19];此外,利用杆状病毒昆虫系统表达的HA1蛋白具有良好的血凝活性,而原核系统表达的HA1蛋白则不具有这一特性。
本研究用RT-PCR法获得甲型H1N1流感病毒血凝素HA1基因序列,然后将其与p-fast质粒连接,通过PCR扩增、酶切和序列测定证实重组质粒构建正确;取测序正确的 HA1-p-fast质粒转化 DH10Bac,再次鉴定,获得正确的HA1-Bacmid;感染杆状病毒sf9昆虫细胞,表达大量HA1蛋白;并进一步纯化。
[1]张勇,高燕,方立群,等.中国大陆甲型H1N1流感扩散模式及预防控制效果定量评价[J].中华流行病学杂志,2009,30(11):1106-1110.
[2]Wagner BG,Coburn BJ,Blower S.Calculating the potential for within-flight transmission of influenza A(H1N1)[J].BMC Med,2009,7:81.
[3]张顺祥.甲型H1N1流感流行病学研究进展[J].中华流行病学杂志,2009,30(11):1125-1130.
[4]闫杰,王玉光,肖江,等.甲型H1N1流行性感冒33例确诊病例临床分析[J].中华内科杂志,2009,48(10):830-832.
[5]Suzuki K,Okada H,Itoh T,et al.Association of increased pathogenicity of Asian H5N1 highly pathogenic avian influenza viruses in chickens with highly efficient viral replication accompanied by early destruction of innate immune responses[J].J Virol,2009,83(15):7475-7486.
[6]Ercole A,Taylor BL,Rhodes A,et al.Modelling the impact of an influenza A/H1N1 pandemic on critical care demand from early pathogenicity data:the case for sentinel reporting[J].Anaesthesia,2009,64(9):937-941.
[7]Valdespino-Gomez JL,Garcia-Garcia L,de Leon-Rosales SP.Vaccines against influenza A(H1N1)pandemic[J].Arch Med Res,2009,40(8):693-704.
[8]Kawai N,Ikematsu H,Hirotsu N,et al.Clinical effectiveness of oseltamivir and zanamivir for treatment of influenza A virus subtype H1N1 with the H274Y mutation:a Japanese,multicenter study of the 2007-2008 and 2008-2009 influenza seasons[J].Clin Infect Dis,2009,49(12):1828-1835.
[9]Grijalva-Otero I,Talavera JO,Solorzano-Santos F,et al.Critical analysis of deaths due to atypical pneumonia during the onset of the influenza A(H1N1)virus epidemic[J].Arch Med Res,2009,40(8):662-668.
[10]Sykora R,Janda R.Pandemic H1N1 2009 influenza—the real problem—editorial[J].Vnitr Lek,2009,55(12):1116-1117.
[11]Sam IC,Abu Bakar S.Pandemic influenza A(H1N1)2009 in Malaysia--the next phase[J].Med J Malaysia,2009,64(2):105-107.
[12]Ndifon W,Wingreen NS,Levin SA.Differential neutralization efficiency of hemagglutinin epitopes,antibody interference,and the design of influenza vaccines[J].Proc Natl Acad Sci U S A,2009,106(21):8701-8706.
[13]Yang SG,Wo JE,Li MW,et al.Construction and packaging of Semliki forest virus replicon particles efficiently expressing influenza A virus(H5N1)hemagglutinin[J].Acta Virol,2009,53(2):139-141.
[14]Sawada T,Hashimoto T,Tokiwa H,et al.Ab initio base fragment molecular orbital studies of influenza viral hemagglutinin HA1 full-domains in complex with sialoside receptors[J].J Mol Genet Med,2008,3(1):133-142.
[15]Chiu FF,Venkatesan N,Wu CR,et al.Immunological study of HA1 domain of hemagglutinin of influenza H5N1 virus[J].Biochem Biophys Res Commun,2009,383(1):27-31.
[16]Fajardo-Dolci GE,Hernandez-Torres F,Santacruz-Varela J,et al.Epidemiological profile of mortality due to human influenza A(H1N1)in Mexico[J].Salud Publica Mex,2009,51(5):361-371.
[17]Giannecchini S,Campitelli L,Bandini G,et al.Characterization of human H1N1 influenza virus variants selected in vitro with zanamivir in the presence of sialic acid-containing molecules[J].Virus Res,2007,129(2):241-245.
[18]张家淮,徐红,张烨,等.1981~2005年中国H1N1甲型流感病毒血凝素基因的 HA1演变特征[J].病毒学报,2007,24(5):350-355.
[19]Shrestha B,Smee C,Gileadi O.Baculovirus expression vector system:an emerging host for high-throughput eukaryotic protein expression[J].Methods Mol Biol,2008,439:269-289.
