基于葡萄糖氧化酶-铂纳米粒子修饰的玻碳电极用于葡萄糖的检测
2011-06-26王明星何婧琳陈传奇
王明星,何婧琳,陈传奇,曹 忠
(长沙理工大学化学与生物工程学院,电力与交通材料保护湖南省重点实验室,湖南长沙410004)
0 引言
葡萄糖是动植物体内重要的碳水化合物,是活细胞的能量来源和新陈代谢中间产物,但血糖过高会引起糖尿病,继而诱发心血管、高血压、神经紊乱等多种病症,危害人的生命健康;而且糖尿病在我国的发病率较高,因此人体血液中葡萄糖的快速测定对糖尿病的临床诊断和治疗及相关生命科学领域都具有非常重要的意义[1]。目前,测定葡萄糖的方法主要有分光光度法[2]、高效液相色谱法[3]、毛细管电泳法[4]等,然而这些方法操作复杂、分析速度慢、成本较高,且在检测范围和灵敏度方面很难达到低浓度检出限。因此,发展能够快速、简便、灵敏地检测低浓度葡萄糖的方法,具有十分重要的现实意义。
近年来,葡萄糖传感器由于灵敏度高、稳定性好、操作简单等优点已成为生化分析和临床检验等方面的一个重要研究方向[5]。1967年Updike和Hicks首次研制出以铂电极为基体的葡萄糖氧化酶(GOD)电极[6],用于定量检测血清中的葡萄糖含量,第一代葡萄糖传感器由此诞生。该类型传感器在施加电位的条件下,通过检测溶液中氧气的减少量来检测葡萄糖的含量,但是该传感器的性能容易受溶解氧的变化、pH值、以及温度等条件的影响。由此,Cass等[7]在GOD电极中引入化学介体,以水不溶性二茂铁单羧酸为介体,将GOD固定在石墨电极上制备出第二代GOD电极,提高了检测灵敏度。第三代葡萄糖电极则是在无媒介体存在下,利用酶与电极直接的电子传递作用而制备的[8]。此外,在葡萄糖传感器制备中使用纳米材料,可增加酶的吸附量和稳定性、提高酶的催化活性、增大传感器的电流响应灵敏度,借助贵金属纳米粒子修饰的葡萄糖酶电极已有报道[9~10]。其中由于铂纳米粒子比表面积大、表面反应活性高[11~13],能对很多的电化学检测起到信号增强和放大的作用[14~16],具有优于其他纳米材料的催化性能而得到了广泛关注。目前利用铂纳米粒子修饰电极制备葡萄糖传感器,渐有报道[17~18],但由于其电极的制备过程较复杂、成本较高、重现性欠佳,限制了其实际应用。
该文提出了一种基于葡萄糖氧化酶-铂纳米粒子修饰的、可快速灵敏检测葡萄糖的电化学生物传感器,即在室温条件下,将制备的分散性良好的铂纳米粒子与聚乙烯醇缩丁醛(PVB)的乙醇溶液混合,用溶胶-凝胶法在工作电极上固定GOD。结果表明,所构建的葡萄糖生物传感器制备过程简单、成本低、重现性好,稳定性也得到了较大的提高,呈现出良好的电化学性能,且加入铂纳米粒子能显著增强酶的催化作用,提高传感器的检出限和灵敏度。
1 实验部分
1.1 仪器与试剂
CHI-760B型电化学工作站 (上海辰华仪器有限公司),TU-1901型双光束紫外可见分光光度计(北京普析通用仪器有限责任公司),JEM-1230(HC)型透射电子显微镜 (日本电子株式会社),KQ-100B型超声波清洗器(昆山市超声仪器有限公司),85-2型恒温磁力搅拌器(巩义市英峪予华仪器厂)。
氯铂酸(湖南试剂厂),聚乙烯吡咯烷酮(K-30,国药集团化学试剂研究院),聚乙烯醇缩丁醛(国药集团化学试剂有限公司),亚铁氰化钾(≥99.5%,天津市光复科技发展有限公司),磷酸氢二钠(北京红星化工厂),磷酸二氢钠 (≥99.0%,上海新华化工厂),氯化钾 (湖南汇虹试剂有限公司),柠檬酸三钠 (国药集团化学试剂有限公司),D-葡萄糖(台山台城化工厂),无水乙醇(安徽安特生物化学有限公司),葡萄糖氧化酶(湖南师范大学试剂厂),以上试剂均为AR或BR级,实验用水均为二次蒸馏水。
1.2 铂纳米粒子的制备
先配制 H2PtCl6水溶液(5.87×10-3mol/L),取5.0mL于锥形瓶中,加入52.0 mg聚乙烯吡咯烷酮(PVP),用蒸馏水稀释至50mL,混合均匀;再称取 16.7 mg NaBH4,用 30mL 蒸馏水溶解,保持硼氢化钠与氯铂酸的摩尔比为15∶1,在搅拌下缓慢滴加到锥形瓶中,分别在加热90℃和室温20℃条件下反应 2.5、3.0、3.5、4.0 h 后制备铂纳米粒子,制得的铂纳米溶胶放入冰箱于4℃中保存。
1.3 葡萄糖传感器的制备
将玻碳电极(GCE)先用金相砂纸抛光,再用粒径 1.0、0.3、0.05 μm Al2O3逐级抛光后得到明亮的镜面,用去离子水洗去表面污物,再分别浸在丙酮、硝酸(1∶3)、去离子水中超声振荡清洗1~3 min,置于室温下晾干,备用。
取10 μL 12 mg/L的葡萄糖氧化酶 (GOD)溶液与5mL的铂纳米溶胶混匀,加入到5mL 2%聚乙烯醇缩丁醛(PVB)的无水乙醇凝胶溶液中混合均匀,取10 μL上述混合液滴加到GCE上静置12 h,然后真空干燥,获得GOD-Pt纳米粒子修饰的玻碳电极(GOD-Pt/GCE);作为比较,不添加铂纳米溶胶,按同样方法制备了GOD修饰玻碳电极(GOD/GCE),所有电极均保存在4℃冰箱中备用。
1.4 检测方法
利用循环伏安法可进行电极制备过程的表征和对葡萄糖生物传感器的检测。采用三电极体系,修饰电极为工作电极,甘汞电极为参比电极,铂丝电极为对电极,整个试验在50 mmol/L磷酸氢二钠-磷酸二氢钠缓冲溶液 (PBS,pH=6.8,含KCl 0.1 mol/L)中进行,电位区间为-1.2~1.2 V,扫描速率为100 mV/s。根据葡萄糖浓度与氧化还原峰电流值的线性响应关系进行定量测定。
2 结果与讨论
2.1 铂纳米粒子的制备条件优化
通过紫外-可见吸收光谱考察了不同反应时间(2.5、3.0、3.5、4.0 h)对铂纳米粒子制备反应体系的影响。H2PtCl6水溶液在200 nm和268 nm左右有特征吸收峰,当NaBH4加入后,PtCl62-逐渐还原为Pt0,随着反应时间的增加,268 nm处的吸收峰强度逐渐减弱;当搅拌反应4 h后,268 nm处的特征吸收峰已完全消失,说明形成了稳定的铂纳米粒子溶胶,故铂纳米粒子制备的最佳反应时间为4 h。
实验还考察了不同温度对铂纳米粒子制备反应体系的影响,图1a和1b分别为加热90℃和室温20℃的反应条件下所制备铂纳米粒子的TEM图。由图1可见,加热90℃条件下所制备的铂纳米粒子团聚的比较严重,分散性欠佳(见图1a);而在室温20℃条件下得到的铂纳米颗粒形貌呈球形,颗粒分散性较好,且粒径在5~7 nm(见图1b),说明采用还原法在室温条件下就能快速合成稳定的球形铂纳米颗粒,加热易促使铂纳米颗粒团聚,其原因是:首先,还原剂NaBH4与水极易反应,加热时NaBH4与水反应速率加快,致使NaBH4不能完全还原H2PtCl6;其次是保护剂PVP的问题,在加热搅拌时,溶解后的PVP出现大量泡沫,溶液出现了一定程度的浑浊,致使PVP不能很好地起到防止铂纳米溶胶团聚的目的;而在室温条件下得到的铂纳米颗粒分散均匀,颗粒粒度分布集中。因此实验选用室温20℃条件下制备铂纳米粒子。

图1 在加热90℃(a)和室温20℃(b)的反应条件下所制备铂纳米粒子的TEM图Fig.1 TEM of Pt nanoparticles synthesized under different reaction temperature of 90 ℃(a)and 20 ℃(b)
2.2 电极修饰过程循环伏安特性
实验考察了电极GOD-Pt/GCE在不同浓度介 质 溶 液 如 含 0、10、20、30、40、 50 mmol/L溶液(PBS为缓冲底液)中的循环伏安特性,发现电极在溶液中的电流响应值最大,故考察电极修饰过程时选用20溶液为介质。
针对电极修饰过程,实验考查了裸玻碳电极(GCE)、GOD 修饰玻碳电 极 (GOD/GCE)、GOD-Pt纳米粒子修饰玻碳电极 (GOD-Pt/GCE)在20

图2 裸 GCE(a)、GOD/GCE(b)和 GOD-Pt/GCE(c)在 20 mmol/L Fe(CN)6-3/-4溶液中的循环伏安图Fig.2 Cyclic voltammograms of the bare GCE(a),GOD/GCE(b),and GOD-Pt/GCE(c)were obtained in 20 mmol/L Fe(CN)6-3/-4solution
2.3 铂溶胶浸泡时间的影响
实验考察了酶电极GOD-Pt/GCE在制备过程中受铂溶胶浸泡时间的影响,其在20 mmol/L Fe(CN)6-3/-4溶液中的循环伏安特性如图3所示。由图3可知,当铂溶胶浸泡的时间分别为1、4、8、12 h时,电极的响应电流会随浸泡时间的增加而增大;而当浸泡时间太长,超过12 h时,电极的响应电流反而减小,其中在12 h时达到最大。这是因为随着浸泡时间的增加,铂纳米粒子在GCE上的数量逐渐增加,比表面积逐渐增大,所以电极响应电流不断增大;当浸泡到一定时间(如12 h),铂纳米粒子在GCE上达到饱和,随着时间的延长,铂颗粒发生堆集,导致比表面积减小,使电极材料的活性受到损害,从而使响应电流反而减小。

图3 GOD-Pt/GCE受铂溶胶浸泡时间的影响时间:(a)1 h,(b)4 h,(c)8 h,(d)12 h,(e)16 h,(f)20 h;介质:20 mmol/L Fe(CN)6-3/-4溶液Fig.3 Effects of the soaking time of Pt sol solution on the GOD-Pt/GCE biosensor Time:(a)1 h,(b)4 h,(c)8 h,(d)12 h,(e)16 h,(f)20 h;Media:20 mmol/L Fe(CN)6-3/-4solution
2.4 GOD用量的选择
实验考查了酶电极GOD-Pt/GCE在制备过程中受不同浓度GOD用量的影响。当GOD浓度分别为 4、8、12、16 mg/L 时,所制备的电化学传感器对4.00×10-3mol/L葡萄糖的响应电流情况如图4所示。由图4可以看出,电极的响应电流随着GOD浓度的增加而增大,在12 mg/L时达到饱和不再增大,由此可以确定GOD的最佳浓度为12 mg/L。

图4 GOD-Pt/GCE受不同浓度GOD用量的影响Fig.4 Effect of the GOD concentration on the GOD-Pt/GCE biosensor
2.5 葡萄糖传感器的响应性能
2.5.1 传感器的线性范围及检测限
实验考查了酶电极GOD-Pt/GCE对不同浓度葡萄糖的响应情况。随着葡萄糖浓度的增加,电极响应的峰电流值也逐渐增加,图5为酶电极GOD-Pt/GCE响应葡萄糖的校正曲线。从图中可知, 传感器在 1.60×10-5~2.40×10-3mol/L 范围内的响应电流与葡萄糖浓度成线性关系,其校正曲线方程可拟合为:y=-0.041 93x-69.754 6,(x 为葡萄糖浓度;y 为峰电流响应值,r=0.999 6,n=9)。根据作图法可求出实际可检测的最低浓度 (如图5的内插图 所示),即检测下限为 8.00×10-6mol/L。
2.5.2 传感器的重现性、选择性、稳定性和使用寿命
将按照上述方法制备好的GOD-Pt/GCE在4.50×10-4mol/L 和 10.85×10-4mol/L 的葡萄糖溶液中来回进行6次测试,结果见表1,表明该传感器在两种溶液响应的相对标准偏差分别为0.85%和0.50%。说明传感器的重现性较好。
选择性是传感器能否应用的一个重要考核指标。实验考察了该电极在4.50×10-4mol/L葡萄糖溶液中分别加入10倍浓度的抗坏血酸、尿酸、果糖后的电流响应情况,结果没有发现明显的电流增强响应信号,说明抗坏血酸、尿酸、果糖等对葡萄糖传感器无明显的干扰。

图5 酶电极GOD-Pt/GCE响应葡萄糖的校正曲线Fig.5 Calibration curve of the GOD-Pt/GCE responding to glucose
传感器的稳定性是分析检测应用的一个重要性能指标。实验考察了该电极在4.50×10-4mol/L葡萄糖溶液中连续检测12 d,每间隔1 d记录一次数据,其电流响应过程如图6所示,该电极的响应平均值为-83.99±3.24 μA(n=6),其电流响应的相对标准偏差为3.86%,说明该传感器具有较好的稳定性。且电极经过12 d使用后,响应电流下降至最初值的90%,说明传感器至少可以使用12 d。

表1 GOD-Pt/GCE检测葡萄糖的重现性Tab.1 Reproducibility of GOD-Pt/GCE for glucose determination

图6 传感器检测葡萄糖(4.50×10-4mol/L)的稳定性曲线Fig.6 Stability curve of the sensor for detection of glucose at concentration of 4.50×10-4mol/L
2.5.3 传感器的回收率与分析应用
将按照上述方法制备好的GOD-Pt/GCE,对实验室配制的6个葡萄糖样品溶液的浓度进行了加标回收测试,结果表明其回收率在96.82%~101.29%之间(见表 2),说明 GOD-Pt/GCE 能够较好地应用于葡萄糖的快速检测。
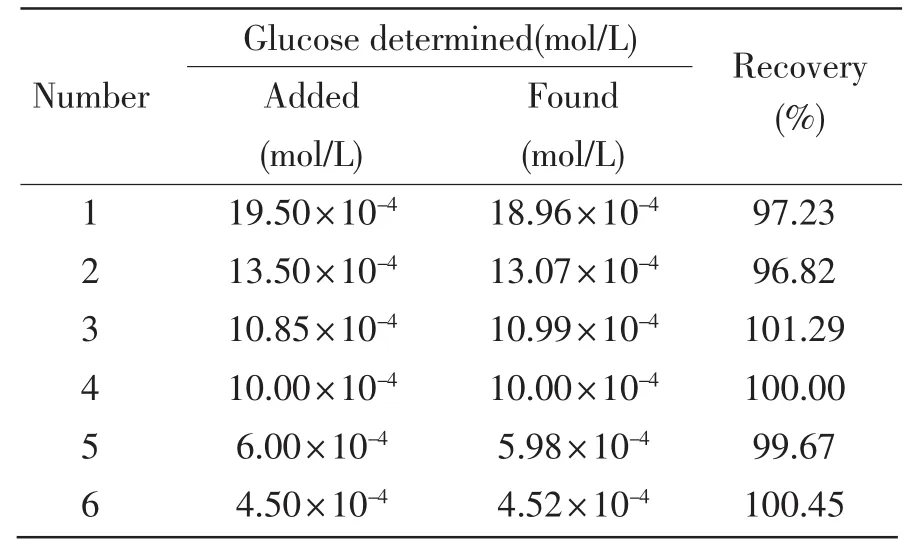
表2 传感器的回收率Tab.2 Recovery of the glucose biosensor
同时,将该酶电极GOD-Pt/GCE分别用于湖南明园蜂业有限公司和北京慈生堂食品有限公司的两种不同品牌蜂蜜中的葡萄糖含量的测试,数据列于表3中,由表3可知酶电极与高效液相色谱(HPLC)方法检测结果较一致,说明GOD-Pt/GCE能够很好地应用于蜂蜜产品中葡萄糖含量的检测。

表3 蜂蜜中葡萄糖含量的测定Tab.3 Determination of glucose in honey products
3 结论
该文探讨了一种基于铂纳米粒子修饰电极用于葡萄糖检测的电化学生物传感器。采用化学还原法在室温下制得的铂纳米粒子,与2%PVB的无水乙醇凝胶构成的复合固酶基质,取10 μL 12 mg/L的GOD溶液,采用溶胶-凝胶法固定GOD于GCE表面,制备了葡萄糖生物传感器。实验发现铂纳米粒子可以大幅度提高传感器的催化响应电流,加速电子传递,从而提高了传感器的灵敏度和检测限。该传感器重现性、选择性、稳定性好、使用寿命较长,回收率在 96.82%~101.29%之间,可应用于实际样品蜂蜜中葡萄糖含量的检测。
[1]张家庆.血糖及其他体液葡萄糖测定进展[J].中华内分泌代谢杂志,2003,8(19):333~335.
[2]闫家伟,黄运瑞,武江旭,等.铁-邻菲罗啉分光光度法测定微量葡萄糖[J].南阳师范学院学报,2004,9(12):256~258.
[3]董晓东,侯宛玲,苏绍哲,等.高效液相色谱法测定葡萄糖和甘露醇[J].分析化学,2000,28(5):656~657.
[4]耿越,崔华高,赵相轩.毛细管电泳技术用于测定蜂蜜中单糖的含量(外标法)[J].山东师范大学学报,2000,15(4):436~438.
[5]杨海朋,陈仕国,李春辉,等.纳米电化学生物传感器[J].化学进展,2009,1(21):213~216.
[6]Updike S J,Hicks G P.The Enzyme Eletrode[J].Nature,1967,214:986~988.
[7]Cass A E G.Application of Tetrathiaful valenes in Bioelectrochemical Processes[J].Anal.Chem.,1984,56:667~669.
[8]Guilbault G G,Lubrano G J.An Enzyme Electrode for the Amperometric Determination of Glucose[J].Anal.Chim.Acta,1972,64:439~455.
[9]Pan M,Guo X S.A novel glucose sensor system with Au nanoparticles based on microdialysis and coenzymes for continuous glucose monitoring[J].Sens.Actuators A,2003,108:258~262.
[10]Qiu H J,Huang X R.Effects of Pt decoration on the electrocatalytic activity of nanoporous gold electrode toward glucose and its potential application for constructing a nonenzymatic glucose sensor[J].J.Electroanal.Chem.,2010,643:39~45.
[11]Rong L Q,Yang C,Qian Q Y,et al.Study of the nonenzymatic glucose sensor based on highly dispersed Pt nanoparticles supported on carbon nanotubes[J].Talanta,2007,72:819~824.
[12]Hindle P H,Nigro S,Asmussen M,et al.Amperometric glucose sensor based on platinum-iridium nanomaterials[J].Electrochem.Commun.,2008,10:1 438~1 441.
[13]Bo X J,Ndamanish J C,Bai J,et al.Nonenzymatic amperometric sensor of hydrogen peroxide and glucose based on Pt nanoparticles/ordered mesoporous carbon nanocomposite[J].Talanta,2010,82:85~91.
[14]Yang H,Peng Z M.Designer platinum nanoparticles:Control of shape composition in alloy,nanostructure and electrocatalytic property[J].Nano Today,2009,4:143~164.
[15]Chen J,Lee E P.Shape-controlled synthesis of platinum nanocrystals for catalytic and electrocatalytic applications[J].Nano Today,2009,4:81~95.
[16]许银玉,吴朝阳,陈利国,等.基于铂纳米颗粒修饰碳纳米管Nafion膜电极的葡萄糖传感器 [J].化学传感器,2006,26(2):48~53.
[17]任湘菱,孟宪伟,唐芳琼.纳米铂颗粒在酶生物传感器中的应用研究[J].功能材料与器件学报,2005,11(2):246~250.
[18]刘梦琴,蒋健晖,冯泳兰,等.基于镀铂碳糊电极电聚酪胺和过氧化聚吡咯的葡萄糖传感器研究 [J].分析化学研究报告,2007,35(10):1 435~1 438.
[19]张琳,袁金锁,唐芳琼.溶胶-凝胶法制备含纳米憎水SiO2颗粒葡萄糖酶电极 [J].中国科学B辑,1995,25(7):701~703.
[20]Hoshi T,Anzai J I,Osa T,et al.Controlled Deposition of Glucose Oxidase on Platinum Electrode Based on an A-vidin Biotin System for the Regulation of Output Current of Glucose Sensors[J].Anal.Chem.,1995,67:770 ~774.
