金纳米棒的合成、修饰及与肿瘤细胞的相互作用
2011-06-26熊瑞瑞
熊瑞瑞,何 彦
(化学生物传感与计量学国家重点实验室,湖南大学化学化工学院,湖南长沙410082)
0 引言
金纳米粒子具有非常有趣的光学性质,这种特殊的性质来源于入射光与金属纳米粒子的自由电子相互作用:当入射光的波长与自由电子的振动频率发生共振耦合时,就会产生表面等离子体共振(Surface Plasmon Resonance,SPR),在紫外可见光谱上显示强的吸收峰。SPR光谱主要取决于纳米粒子的大小、形状、表面电荷、周边介质条件等。粒子的形状不同可导致迥异的SPR,球形金纳米粒子仅表现出处于500~600 nm左右的单峰,而棒状金纳米粒子则出现两个谱峰,即纵向和横向表面等离子共振吸收峰,并且纵向等离子共振吸收峰取决于棒状粒子的径横比(从可见区到近红外区),而横向等离子共振吸收峰基本保持不变 (500 nm~600 nm)。 由介质环境决定的SPR光谱可为金纳米棒在光学生物传感领域提供了基础[1~2];金纳米棒双光子发光、高散射、近红外强吸收的性质使它在生物医学领域有着广泛的应用前景,金纳米棒能够通过“双光子荧光”对血液造影成像[3],可以利用近红外发光的性质进行肿瘤探测和肿瘤治疗[4]。
目前合成金纳米棒的方法有许多种,最常用的有:模板法、光化学方法、电化学方法及晶体生长法。模板法是将金沉积到多孔的氧化铝或聚碳酸酯模板的孔道中,Martin等[5~7]最早使用模板法来制备金纳米棒,但这种方法产率较低。随后Wang等使用电化学方法合成了金纳米棒[8~9]。而杨培东等用光化学方法来制备金纳米棒[10]。晶种生长法是金纳米棒合成中应用最广的一种方法,它是由Murphy小组[11]提出并和El-Sayed共同改进[12~13]。这种方法可以高效制得长短轴比在 1.5~20范围内的金纳米棒。这种方法对设备要求不高,制备过程较为简单,是目前合成金纳米棒的主要方法。采用晶种生长法制备得到的金纳米棒表面被大量的CTAB覆盖,而CTAB的生物毒性限制了金纳米棒在生物医学领域的应用。因此,在许多关于金纳米棒的生物应用中,人们首先考虑如何除去金纳米棒表面多余的CTAB以降低它的生物毒性。方法包括:通过降温使CTAB析出后过滤去除;高速离心后使金纳米棒重新分散在其它溶液中或者是在金纳米棒表面进行聚合物的包覆等等[13~17],但是这些方法容易引起团聚或者引入一些不易控制的因素。因此,找到一种较好的对金纳米棒表面化学修饰的方法将为金纳米棒在生物医学领域的应用开辟更好的发展。
1 实验部分
1.1 试剂和仪器
表面生长因子抗体 (Anti-epidermal growth factor receptor,anti-EGFR),11-巯基十一酸 (11-mercaptoundecanoic acid,MUDA)均购自 Sigma公司;抗坏血酸(Ascorbic acid,AA),氯金酸(Tetrachloroauric(Ⅲ)acid trihydrate,HAuCl4·4H2O),十六烷基三甲基溴化胺(Hexadecyl trimethyl ammonium chloride,CTAB),2-(氮吗啡啉) 乙磺酸 (2-(4-Morpholino)ethanesulfonic acid,MES), 硝酸银均购自国药集团化学试剂有限公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐 (1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC·HCl),N-羟基琥珀酰亚胺 (NHydroxysuccinimide,NHS),pH7.20 的 PBS 缓冲溶液 ,DMEM (GIBCO), 胎 牛 血 清 (Fetal bovine serum,FBS),胰酶细胞消化液(Typsin-EDTA solution),抗生素(Penicillin-streptomycin)均购自北京鼎国生物科技有限公司;HELA贴壁细胞购自湘雅附一医院细胞培养室。所有的溶液都是用Millipore二次水配制。
Olympus SZX16型体视显微镜(带暗场模块),Olympus DP72 CCD,U-2300紫外可见分光光度计,Zeta电位仪,JEM-200CX透射电子显微镜,CO2培养箱,超净工作台,高压灭菌锅,干热灭菌箱,培养皿,磁力搅拌器,微型振荡混合器,摇床,离心机,电子天平。
1.2 金纳米棒的合成
该文采用的是诱导晶种生长法,晶种生长法是目前金纳米棒制备研究中应用最广的一种方法。其基本原理是在反应溶液中加入一定量的金纳米颗粒品种(约3 nm),在表面活性剂分子的作用下,晶种颗粒定向生长为一定轴比的金纳米棒,通过改变溶液中晶种的量、反应物的浓度可以调节金纳米棒的长短轴比值,到目前为止已成功制备出长短轴比在1.5~20范围内的金纳米棒。
金种是通过加入强的还原剂 (如NaBH4)进行还原反应合成的,然后将合成的晶种,弱的还原剂(如抗坏血酸)和表面活性剂(如十六烷基三甲基溴化铵)加入到生长液中。据文献报道[17],表面活性剂十六烷基三甲基溴化铵的浓度、AgNO3的浓度、金种的大小和浓度对合成金纳米棒的长度和形状有很大的影响。实验在参考文献的基础上[17]优化合成条件,如改变AgNO3的量、抗坏血酸的量、晶种的量来获得不同长短比的金纳米棒。在紫外可见吸收光谱仪上测金纳米棒的紫外可见吸收光谱,根据所得数据和图形来确定各反应物最佳用量。所合成的金纳米棒通过紫外可见吸收光谱和透射电子显微镜等进行表征。
金纳米棒的具体合成方法如下:
(1)金种的合成
将 2mL 5.0×104mol/dm3HAuCl4溶液加入到2mL 0.2 mol/dm3CTAB 溶液中,以 1 000 r/min 的搅拌速度搅拌均匀后, 加入 18 μL 1.32×104mol/dm3NaBH4溶液 (溶解后冰水浴中放置),溶液颜色逐渐由亮黄色变为淡黄色,继续搅拌2 min,然后停止搅拌,放置2 h后待用。
(2)金纳米棒的生长
将 2mL 1.0×103mol/dm3HAuCl4溶液加入到2mL 0.2 mol/dm3CTAB溶液中,在微型漩涡混合仪上振荡均匀,加入 125 μL 4.0×103mol/dm3AgNO3溶液,振荡均匀,再加入27 μL 7.88×102mol/dm3抗坏血酸溶液,振荡后溶液颜色逐渐由棕黄色变为无色,最后再加入12 μL所合成的金种溶液,振荡均匀,溶液颜色由无色逐渐变为黄色或者深红色,放入30℃恒温水浴锅中静置3 h,测其紫外可见吸收光谱。
1.2.1 反应物所用量的条件优化
在金纳米棒的合成过程中,各种反应物所用量的多少对于合成所得金纳米棒的形状、近红外吸收峰位置及大小有重大影响。以下将就反应中所用到的硝酸银、抗坏血酸以及金种的浓度进行优化。
1.2.2 硝酸银浓度的优化
加入2mL 0.2 mol/dm3CTAB溶液,2mL 1.0×103mol/dm3HAuCl4溶液于五个反应瓶中,混合均匀,然后分别加入 50 μL、75 μL、100 μL、125 μL、150 μL 4.0×103mol/dm3的 AgNO3溶液,再加入 27 μL 7.88×102mol/dm3AA,混合均匀,最后加入12 μL合成的金种,放入30℃恒温水浴锅中静置3 h,测其紫外可见光谱。
1.2.3 抗坏血酸(AA)浓度的优化
加入2mL 0.2 mol/dm3CTAB溶液,2mL 1.0×103mol/dm3HAuCL4溶液,125 μL 4.0×103mol/dm3的AgNO3溶液于五个反应瓶中,混合均匀,然后分别加入 23 μL、25 μL、27 μL、29 μL、31 μL的7.88×102mol/dm3AA,混合均匀,最后加入12 μL已合成的金种,放入30℃恒温水浴锅中静置3 h,在紫外可见光谱仪上测其紫外可见光谱。
1.2.4 金种的优化
加入2mL 0.2 mol/dm3CTAB溶液,2mL 1.0×103mol/dm3HAuCl4溶 液,125 μL 4.0×103mol/dm3的AgNO3溶液,混合均匀,再加入 27 μL 7.88×102mol/dm3AA,混合均匀,然后分别加入8 μL、10 μL、12 μL、14 μL、16 μL 已合成的金种,混合均匀,放入30℃恒温水浴锅中静置3 h,测其紫外可见光谱。
1.3 金纳米棒的表面化学修饰
将合成所需范围的金纳米棒13 000 r/min,15 min离心两次,去除上清液,重新分散于超纯水中。
第一次组装:离心后所得的金纳米棒按25%的体积比加入20 mmol/dm3MUDA氨水溶液(pH≈8)中,50℃超声 3 h,在 10 000 r/min下离心10 min,去除上清液,重新分散于超纯水中。在紫外可见光谱仪上测其紫外可见光谱,在Zeta电位分析仪上测其表面电荷。
第二次组装:将第一次组装后的金纳米棒溶液按25%的体积比加入20 mmol/dm3MUDA氨水溶液(pH≈8)中,50℃超声 3 h,在 10 000 r/min下离心10 min,去除上清液,重新分散于超纯水中。在紫外可见光谱仪上测其紫外可见光谱,在Zeta电位分析仪上测其表面电荷。
1.4 金纳米棒表面的蛋白修饰
经过表面化学修饰的金纳米棒带有亲水性的羧基,它可以与生物分子相结合,在实验中将经过化学修饰的金纳米棒通过交联剂与人体表面生长因子抗体(anti-EGFR)交联。具体过程如下:
将第二次组装后的金纳米棒溶液10 000 r/min,10 min离心后分散在 2mL pH5.5的MES缓冲溶液中, 将 200 μL 0.4 mol/dm3的 EDC·HCl和200 μL 0.1 mol/dm3的NHS混合后立即加入,4℃超声30 min,在13 200 r/min下离心10 min,然后再分散在2.4mL pH7.2的PBS溶液中,最后加入 200 μL 182.5 μmol/dm3anti-EGFR 4 ℃超声48 min。
1.5 肿瘤细胞的培养
细胞培养是用酶消化法将组织碎块分离成单个细胞,用培养基制成细胞悬液,在体外适宜条件下,使细胞生长繁殖,并保留其一定的结构和功能特性。实验中主要使用了贴壁肿瘤细胞HELA细胞。采用基本的细胞培养技术。所用培养基为完全培养基,完全培养基由基础培养基、血清和抗生素配制而成,其体积比89∶10∶1,使用pH7.2的PBS缓冲溶液洗涤细胞,在37℃、CO2浓度为5%的无菌环境下培养细胞。
1.6 在显微镜下观察金纳米棒与细胞的结合
首先将细胞按一定浓度分别传代培养于六个培养皿中,待细胞完全贴壁之后,加入四组不同浓度的经过蛋白修饰的金纳米棒溶液,加入一组没有经过蛋白修饰的表面只连接了羧基的金纳米棒溶液,然后继续孵育40 h,40 h后取出,吸弃培养基,用pH7.20的PBS缓冲溶液冲洗,然后在Olympus SZX16型体视显微镜下观察,用彩色CCD拍照。
1.7 表征手段
1.7.1 紫外-可见吸收光谱测试
将合成的金纳米棒溶液加入到测紫外可见光谱仪(U-2300,HITACHI)的专用 1 cm 比色皿中,以超纯水作参考测基线,测试时每次用超纯水作参比,每次测量均采用统一的参数,取统一体积的溶液,由低浓度到高浓度依次进行测量。
耕翻、浅旋、免耕秸秆还田条件下,小麦苗期杂草发生种类几乎没有差异,但耕翻秸秆还田在拔节前期杂草种类增加明显,杂草种类由7种增加到13种,增加接近1倍,分析认为这种变化可能由于耕翻扰动了土壤杂草种子库,将本来分布在土壤较深层的杂草种子移动在土壤浅层,有利于种子萌发。而浅旋、免耕表现一致,变化不大,这与樊翠芹等研究[9]一致。耕翻、浅旋无秸秆还田条件下, 虽然小麦苗期杂草发生种类较多,但是拔节前期杂草发生种类仍然显著增加,超过20种。
1.7.2 Zeta电位测试
在Zetasizer Nano ZS英国马尔文公司纳米粒度、Zeta电位和绝对分子量分析仪上进行Zeta电位测试。
1.7.3 透射电镜表征
透射电镜在JEM-200CX透射电子显微镜(JEOL,Japan)上进行。样品制备如下:将所合成的金纳米棒以13 000 r/min离心15 min后,去除上清液,重新分散于二次水中,再次离心分散,保证表面过量的CTAB大部分去除后,用移液枪移取50 μL滴到铜网中心,移至烘干箱中干燥,待测。
1.7.4 光学显微镜下的观察
在Olympus SZX16体视显微镜下(放大倍数为115)观察加入金纳米棒前后肿瘤细胞的状态,在同一模式下采用统一的参数,实验使用Olympus DP72 CCD拍照。
2 结果与讨论
2.1 硝酸银的量对金纳米棒结构的影响
如图1所示,金纳米棒的紫外吸收光谱出现两个特征吸收峰,520 nm左右的吸收峰属于横向等离子共振吸收峰,700 nm左右的吸收峰属于纵向等离子共振吸收峰。加入4.0×103mol/dm3硝酸银溶液的体积分别为 50 μL、75 μL、100 μL、125 μL、150 μL。 由图1 可以看出,随着 Ag+浓度的增加,纵向等离子共振吸收峰的最大吸收波长先增加后减小,表明了金纳米棒的长度也先增加后减小,在金纳米棒的直径基本不变的情况下,金纳米棒的长宽比也是先增加后减小。从图1中可知,纵向吸收峰的最大值出现在加入125 μL 4.0×103mol/dm3AgNO3的时候,因而在实验中基本确定金纳米棒合成中4.0×103mol/dm3AgNO3的最佳用量为125 μL。已有的报道显示[21],如果生长溶液中不存在Ag+,则不能得到棒状的金纳米颗粒。对于AgNO3在金纳米棒合成过程中具体的作用还存在争议,El-Sayed认为:AgNO3在CTAB存在条件下会有AgBr形成,而AgBr的存在降低了表面活性剂CTAB相互之间的排斥力,这有利于作为金纳米棒合成的软模板的CTAB胶束的形成,因此Ag+在金纳米棒的合成过程中起到决定性的作用;而另外的研究则认为,由于Au难以形成晶体结构,而Ag非常容易形成晶体结构,利用抗坏血酸还原生成的Ag晶体的各向异性辅助Au进行单向性生长,最后得到金纳米棒。
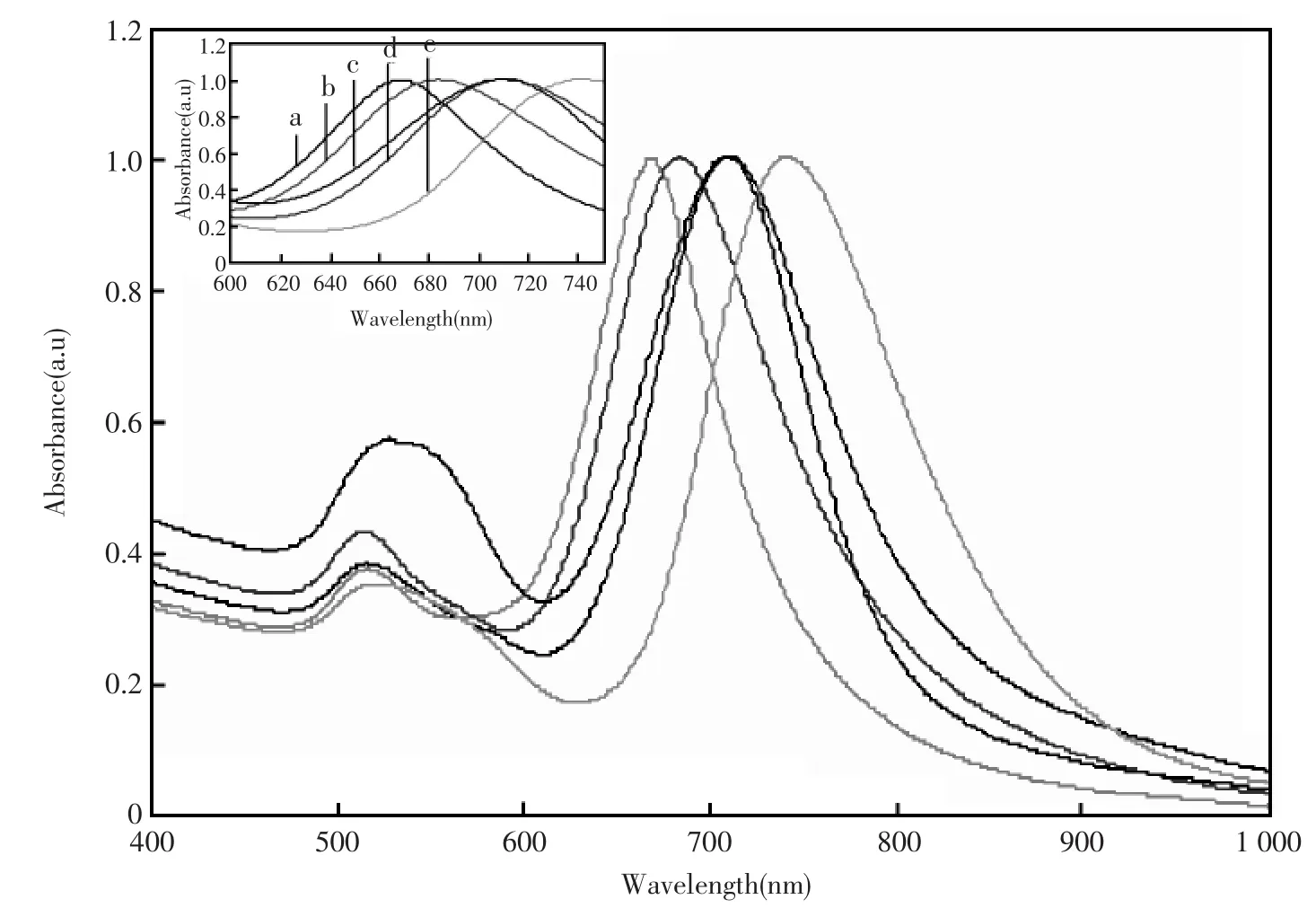
图1 硝酸银的浓度对金纳米棒形状的影响内置图中(a~e)分别表示加入 50 μL、75 μL、150 μL、100 μL、125 μL 4.0×103mol/dm3硝酸银溶液Fig.1 Effect of silver nitrate concentration on the morphology of gold nanorods(a)50 μL,(b)75 μL,(c)150 μL,(d)100 μL,(e)125 μL 4.0×103mol/L AgNO3
2.2 金种的量对金纳米棒结构的影响
如图2所示,金纳米棒的紫外吸收光谱出现两个特征吸收峰,520 nm左右的吸收峰属于横向等离子共振吸收峰,700 nm左右的吸收峰属于纵向等离子共振吸收峰。加入的金种溶液的体积分别为 8 μL、10 μL、12 μL、14 μL、16 μL。 由图2 可以看出,随着金种浓度的增加,纵向等离子共振吸收峰的波长总体趋势是缓慢增加,但增加幅度并不明显。根据文献报道[17],在其它条件不变(Au3+,AA)的情况下,金种的量的增多会产生球状的金颗粒,也会使得金纳米棒的长度减小,这是由于金元素的总量是不变的,而提供给每个金种生成金纳米棒的量减少了。尽管如此,一定浓度范围内金种的量不如其它因素对金纳米棒的纵向等离子共振吸收峰的位置改变影响明显。在实验中所测试的金种的浓度处于该浓度范围内,对于合成金纳米棒的长径比影响不大,综合考虑选择金种的体积为12 μL。

图2 金种的浓度对金纳米棒形状的影响内置图中(a~e)分别表示加入 1 4 μL、8 μL、12 μL、10 μL、16 μL 金种Fig.2 Effect of Au seeds concentration on the morphology of gold nanorods(a)14 μL,(b)8 μL,(c)12 μL,(d)10 μL,(e)16 μL Au seeds
2.3 抗坏血酸的量对金纳米棒结构的影响
如图3所示,金纳米棒的紫外吸收光谱出现两个特征吸收峰,520 nm左右的吸收峰属于横向等离子共振吸收峰,700 nm左右的吸收峰属于纵向等离子共振吸收峰。加入的7.88×102mol/dm3抗坏血酸溶液的体积分别为 23 μL、25 μL、27 μL、29 μL、31 μL。由图3 可以看出,随着抗坏血酸浓度的增加,纵向吸收峰的波长随之减少,这表明金纳米棒的长度也随之减少,即金纳米棒的长径比降低。这与已经报道的实验结果相一致,即还原剂AA大量存在的情况下,能够很快还原Au3+成为Au0,吸附于金种的各个表面,而不仅仅在于金纳米棒的纵轴端,这样所得到的金纳米棒的宽度整体较大,而在金元素整体量不变的情况下,所得的金纳米棒的长径比明显降低。实验选择 27 μL 7.88×102mol/dm3的抗坏血酸进行所需波长金纳米棒的合成。

图3 抗坏血酸的浓度对金纳米棒形状的影响内置图中(a~e)分别表示加入 31 μL、29 μL、27 μL、25 μL、23 μL 7.88×102mol/dm3抗坏血酸溶液Fig.3 Effect of ascorbic acid concentration on the morphology of gold nanorods(a)31 μL,(b)29 μL,(c)27 μL,(d)25 μL,(e)23 μL 7.88 × 102mol/L ascorbic acid
金纳米棒在近红外有强吸收,可用于肿瘤治疗、肿瘤探测,因此大量合成纵向等离子吸收峰最大吸收波长在800 nm的金纳米棒。通过几次的稳定性证明,该参数下合成的金纳米棒呈现较好的稳定性,详细结果见图4。
2.4 经过表面化学修饰以及生物交联之后的金纳米棒
从金纳米棒的合成机理讨论部分可以得知,诱导晶种生长法合成得到的金纳米棒表面被大量的CTAB所覆盖。而金纳米棒表面CTAB所具有的生物毒性对于金纳米棒在生物体系中的应用有很大的限制性,因此在众多关于金纳米棒在生物体系应用的文献报道中[13~17],都会尽力去除多余的CTAB,方法主要有通过降温使CTAB析出后过滤去除,或者高速离心后使金纳米棒重新分散于其它溶液中,或者在金纳米棒的表面进行聚合物的包覆等等。这些方法都存在着容易引起团聚或者引入一些不易控制的因素。因此实验通过对金纳米棒初步离心去除一部分CTAB之后,在其表面多次超声组装MUDA,使其在保证稳定性的情况下能够组装上一层易于共价交联生物分子的羧基,便于其在生物体系中的应用。

图4 金纳米棒的表征图左图是金纳米棒的透射电镜图,其长宽比约为3,右图是金纳米棒的紫外吸收图,其在近红外的吸收为803 nmFig.4 Characterization of gold nanorods.Left,TEM images of gold nanorods,whose aspect ratio is about 3;right,UV-Vis spectra of gold nanorods,whose NIR absorption maximum is at 803 nm
由图5可知,一次、二次、三次、四次组装后的金纳米棒与离心两次后的金纳米棒相比,其纵向吸收波长基本没发生改变,说明所合成的金纳米棒具有较好的稳定性,而其吸收值的降低在一定程度上则是由于金纳米棒在多次组装离心的过程中有一定量的损失。羧基组装后的金纳米棒通过EDC、NHS和anti-EGFR交联后,其纵向吸收波长发生了一定程度的红移,anti-EGFR已经组装到了金纳米棒表面,但也导致了金纳米棒一定程度发生了团聚,在蛋白对于金纳米棒进行修饰的工作上,还需要改进。

图5 经过修饰之后的金纳米棒归一化的紫外吸收图内置图中(a-e)分别经过两次离心,1次组装,2次组装,3次组装,4次组装,EGFR修饰Fig.5 Normalized UV-Vis spectra of gold nanorods after modification(a)centrifuged twice,(b)1th assemble,(c)2th assemble,(d)3th assemble,(e)4th assemble,(f)EGFR@GNRs
图6的zeta电位值显示出作两次离心处理后的金纳米棒表面带正电荷,原因是未作处理的金纳米棒溶液中含有大量的CTAB,离心两次后,仍有部分CTAB残留在溶液中,故离心两次后金纳米棒的Zeta电位电压值仍显正值。加入了MUDA在金纳米棒的表面进行多次组装,每次组装之后的金纳米棒表面都带负电。从电位数值上看,经过四次组装后的金纳米棒表面性质稳定,但为了避免多次组装过程中金纳米棒的量损失,实验过程中选择第二次组装后的金纳米棒进行蛋白质的交联。与anti-EGRF交联后的金纳米棒其表面也带负电荷,但是与第三次组装后的结果相比其电位已经明显的偏正,说明anti-EGFR已经组装到金纳米棒的表面,结果与UV-vis结果相一致。
2.5 金纳米棒与细胞的相互作用
在实验中建立了金纳米棒-人表面生长因子抗体-HELA细胞这样一个观察体系,利用体视显微镜(放大倍数为115)观察HELA肿瘤细胞与经过anti-EGFR修饰的金纳米棒结合前后的显微镜图。图7中a是不加任何纳米粒子的HELA细胞的图像,图7中b是加入表面修饰了MUDA后的金纳米棒于细胞溶液中,图7中c、d、e、f图分别是加入了 10 μL、20 μL、30 μL、40 μL 的连接了anti-EGFR的金纳米棒。由图7可以看到,当加入连接了anti-EGFR的金纳米棒加入到细胞后,细胞在显微镜下的光强增大,并且随着加入体积的增加,细胞核附近的光强度逐渐增大。大多数肿瘤细胞的表面都有表皮生长因子受体,因此连接了anti-EGFR的金纳米棒可以与细胞表面发生特异性吸附,而在显微镜下肿瘤细胞的细胞核附近发光说明经过MUDA层层组装后的金纳米棒已经连接上anti-EGFR并且进入到细胞体内。

图6 金纳米棒表面的zeta电位测试Sample 1表示离心两次之后的金纳米棒,Sample 2、3、4、5分别表示巯基十一酸四次组装后的金纳米棒,Sample 6表示表面连接了anti-EGFR的金纳米棒Fig.6 Zeta potential measurement of gold nanorods.Sample 1th refers to gold nanorods after twice centrifugation Sample 2,3,4,5 refers to gold nanorods after the 1th,2th,3th,4th modification by MUDA,respectively.Sample 6 refers to gold nanorods modified by anti-EGFR antibody

图7 暗场体视显微镜下细胞成像图(a)没有加任何粒子,(b)加入 40 μL 表面连接了巯基十一酸的金纳米棒,(c~f)分别加入了 10、20、30、40 μL 的连接了anti-EGFR的金纳米棒Fig.7 Darkfield images of cells.(a)blank,(b)40 μL gold nanorods modified by MUDA.(c)10,(d)20,(e)30,(f)40 μL gold nanorods modified by anti-EGFR antibody
3 结论
实验可以控制金纳米棒的合成条件来合成出有不同长短比的金纳米棒,并且用MUDA层层组装法较好的完成金纳米棒表面的化学修饰以及与生物分子的交联并用Zeta电位仪来证明每步操作的实现。在放大倍数为115的体视显微镜下,可以看到与金纳米棒结合前后的细胞图像,根据图像可以判断经过修饰并且连接了anti-EGFR的金纳米棒可以进入细胞体内并在细胞核附近聚集。这为研究金纳米棒对肿瘤细胞的影响奠定了很好的基础,对在单分子层面上研究金纳米棒对细胞结构以及形态的影响有着重要的意义,对于金纳米棒的医学应用前景有着重要的铺垫作用。
[1]Raschke G,Kowarik S,Franzl T,et al.Biomolecular recognition based on single gold nanoparticle light scattering[J].Nano Letters,2003,3(7):935~938.
[2]Parak W J,Gerion D,Pellegrino T,et al.Biological applications of colloidal nanocrystals[J].Nanotechnology,2003,14(7):15~27.
[3]Jain P K,El-Sayed I H,El-Sayed M A.Au nanoparticles target cancer[J].Nanotoday,2007,2(1):18~29.
[4]Wang H F,Huff T B,Zweifel D A,et al.In vitro and In vivo two-photon luminescence imaging of single gold nanorods[J].Proceedings of the National Acedemy of Sciences of the United States of America,2005,102(44):15 752~15 756.
[5]Martin C R.Membrane based synthesis of nanomaterials[J].Chemistry Of Materials,1996,8(8):1 739~1 746.
[6]Yu Y Y,Chang S S,Lee C L,et al.Gold Nanorods:Electrochemical synthesis and optical properties[J].The Journal of Physical Chemistry B,1997,101(34):6 661~6 664.
[7]Chang S S,Shih C W,Chen C D,et al.The Shape transition of gold nanorods[J].Langmuir,1999,15 (3):701~709.
[8]Kim F,Song J H,Yang P D.Photochemical synthesis of gold nanorods[J].Journal of the American Chemical Society,2002,124(48):14 316~14 317.
[9]Jana N R,Gearheart L,Murphy C J.Wet chemical synthesis of high aspect ratio cylindrical gold nanorods[J].The Journal of PhysicalChemistry B,2001,105(19):4 065~4 067.
[10]Jana N R,Gearheart L,Murphy C J.Seed-Mediated growth approach for shape-controlled synthesis of spheroidal and rod-like gold nanoparticles using a surfactant template[J].Advanced Materials,2001,13(18):1 389~1 393.
[11]Nikoobakht B,El-Sayed M A.Preparation and growth mechanism of gold nanorods(NRs)using seed-Mediated growth method[J].Chemistry Of Materials,2003,15(10):1 957~1 962.
[12]Takahashi H,Niidome Y,Niidome T,et al.Modification of gold nanorods using phosphatidylcholine to reduce[J].Langmuir,2006,22(1):2~5.
[13]Niidome T,Yamagata M,Okamoto Y,et al.PEG-modified gold nanorods with a stealth character for in vivo applications[J].Journal of Controlled Release,2006,114(3):343~347.
[14]Chen C C,Lin Y P,Wang C W,et al.DNA-gold nanorod conjugates for remote control of localized gene expression by near infrared irradiation[J].Journal of the American Chemical Society,2006,128(11):3 709~3 715.
[15]Huang X H,El-Sayed I H,Qian W,et al.Cancer cell imaging and photothermal therapy in the near-Infrared region by using gold nanorods[J].Journal of the American Chemical Society,2006,128(6):2 115~2 120.
[16]Takahashi H,Niidome Y,Yamada S.Controlled release of plasmid DNA from gold nanorods induced by pulsed near-infrared light[J].Chemical Communications,2005,17:2 247~2 249.
[17]Sau T K,Murphy C J.Seeded high yield synthesis of short Au nanorods in aqueous solution[J].Langmuir,2004,20(15):6 414~6 420.
