MM P-7和 HGF在白血病中的表达及其相关性研究
2011-06-22田黎明徐王月王月苏雪莹
李 慧 ,田黎明 ,徐王月王月 ,苏雪莹
(佳木斯大学附属第一医院,黑龙江 佳木斯 154003)
白血病是造血干细胞的恶性克隆性疾病,与多发性骨髓瘤和淋巴瘤共同组成血液系统三大恶性肿瘤,发病率为2.76/10万,与亚洲国家相近,稍低于欧洲国家水平。在恶性肿瘤死亡率中 ,白血病居第6位 (男性 )和第8位(女性),在儿童及35岁以下成人中则居第1位。其重要生物学特征是白血病细胞的侵袭和转移。所以近几年寻找能反映白血病细胞侵袭和转移的标记物成为研究的热点。肝细胞生长因子(HGF)来源于间质细胞,其受体是原癌基因 C-met的产物。HGF是组织细胞分泌的含728个氨基酸的无活性的单链前体蛋白经胰蛋白酶样水解酶作用裂解成有活性的二聚体即肝素结合糖蛋白[1]。研究证明 HGF/C-met不仅参与调节正常细胞粘附、分化和迁移,也参与其恶性转化。基质金属蛋白酶(MM Ps)家族在正常骨髓中通过调整骨髓细胞外基质的结构调节多种细胞的生长增殖分化粘附和迁移等[2],是目前已知的唯一能够降解胶原纤维的酶类。由于他们对细胞外基质的降解,从而更利于肿瘤细胞的侵袭和转移。其家族成员MM P-7更是在肿瘤细胞的凋亡中起了重要的作用。本实验中,我们用酶联免疫法检测 HGF和 MM P-7在白血病中的表达及研究它们的相关性。从而探讨它们与白血病发生发展的关系。
1 资料与方法
1.1 一般资料
50例白血病患者外周血均取自 2010— 05~ 2011— 09佳木斯大学附属第一医院血液科,其中男 21例,女29例,年龄18~ 79岁,中位年龄48.5岁。白血病患者中初治 31例,复发19例。50例白血病患者均经疗程的化疗治疗后依据其骨髓细胞学分析分为 CR28例和 PR22例。白血病患者诊断标准参照张之南主编 《血液病诊断及疗效标准(第 3版)》,40例对照组标本取自同期佳木斯大学第一附属医院生化实验室。
1.2 实验方法
所有标本均经室温下放置 2h后于 1000g离心20min,取上清液,将标本放置于-20℃保存。用酶联免疫方法检测MM P-7和 HGF在白血病患者外周血中的表达用纯化的抗体包被微板孔,制成固相载体,依次加入标本或标准品、生物素化的抗 MM P-7(或 HGF)抗体、HRP标记的亲和素、经彻底洗涤后用底物 TM B显色。试剂盒购自天津索罗门生物科技有限公司。
1.3 结果判定标准
TM B在经过氧化物酶的催化下转成蓝色,并在酸的作用下转化成黄色。颜色深浅与标本中 (HGF或 MM P-7)的量成正相关。
1.4 统计学处理
采用 SPSS17.0软件包进行统计学分析,数据资料进行 t检验及 Spearman相关分析,α=0.05作为检验水准。
2 结果
2.1 MM P-7在白血病外周血清中的表达
白血病患者外周血中 HGF与 MM P-7的表达明显高于对照组 (P<0.05)。白血病组中,AM L与 ALL中的表达无显著差异性 (P> 0.05);AM L与 CM L中的表达无显著差异性 (P> 0.05);ALL与 CM L中的表达无显著差异性(P > 0.05)。见表1。
表1 HGF及 MMP-7在各型白血病组及对照组中的表达 ±s)
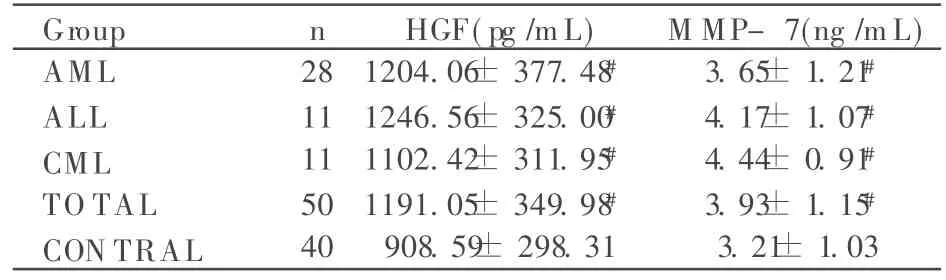
表1 HGF及 MMP-7在各型白血病组及对照组中的表达 ±s)
#P<0.05,compared with the control group
2.2 MMP-7与 HGF在白血病患者外周血中的表达相关性分析
HGF与 MM P-7在白血病患者外周血清中的表达呈正相关 (r= 0.303,P<0.05),且二者关系程度较密切。
2.3 HGF与 MM P-7在初治组与复发组中的表达
白血病患者初治组与复发组患者外周血中 HGF与MM P-7的表达差异不显著,无统计学意义 (P> 0.05)。见表2。
表2 HGF及 MMP-7初治组及复发组中的表达 ±s)

表2 HGF及 MMP-7初治组及复发组中的表达 ±s)
2.4 CR组与 PR组的比较
MM P-7与 HGF在白血病 CR组中的表达水平高于 PR组,差异具有统计学意义 (P <0.05)。(见表3)
表3 HGF及 MMP-7在 CR组及 PR组中的表达 ±s)

表3 HGF及 MMP-7在 CR组及 PR组中的表达 ±s)
3 讨论
本研究测定了白血病患者外周血清中 MMP-7和 HGF的水平。实验结果表明,白血病患者血清中 HGF和 MM P-7的水平均明显高于对照组且 CR组 MM P-7和 HGF的表达水平明显低于 PR组,差异具有显著性。根据 Liotta曾提出肿瘤转移的“三步骤”假说[3],恶性肿瘤细胞要想发生、发展、侵袭与转移所必须要攻克的屏障即是基底膜与细胞外基质。MM Ps是骨髓微环境的重要组成部分,在正常的生理条件下以酶原的形式直接分泌到细胞外基质,通过对除多糖外的大多数细胞外基质的降解而促进肿瘤细胞对周围组织的浸润[4]。另外,MM P-7通过作用于多种刺激信号而启动凋亡程序发挥抗凋亡作用,其如 Fas程序。肿瘤细胞或正常细胞表面的跨膜 Fas配体(mFasl)通过与 MM P-7作用而产生可溶性 Fas配体(sFasl)保护肿瘤细胞逃避由 fas介导的细胞凋亡过程[5]。在许多实体瘤中,MMP-7蛋白的高表达与恶性肿瘤化疗疗效相关[6]。其机制可能与 MMp-7的抗凋亡作用有关。同时 MMP-7缺少基质金属蛋白酶组织抑制剂(TIM P)在 MM Ps家族的作用靶点 C末端区域,所以目前对MM P-7的抑制剂正有待研究。所以认为 MM P-7在白血病中的作用机制、发生、发展、转移乃至白血病患者的治疗上都有较广阔的研究空间。HGF通过分解 IV型胶原、破坏基底膜,然后穿过内皮细胞进入血管内,从而增强癌细胞的运动能力,加速癌细胞的血管内游走和恶性肿瘤的远处转移[7]。Pepper[8]认为 HGF主要是上调尿激酶及受体的基因表达水平,导致细胞产生过多的尿激酶,引起细胞外基质的(ECM)局灶性降解,有利于细胞的浸润和转移。另外 HGF在促进肿瘤血管的发生中起到了积极地作用:HGF与内皮细胞表面受体 c-Met结合可激活受体酪氨酸激酶,使β亚基磷酸化,直接诱导血管内皮的增殖及迁移,同时参与血管内皮细胞的修复。除此之外,HGF增强内皮细胞在模拟血管生成的胞外微环境(如三维胶原)中管状结构形成的能力。
MM P-7和 HGF分别通过各自的方式直接或间接参与了肿瘤细胞的浸润和转移。且共同降解细胞外基质。HGF和其特异性受体 c-met通过特有的信号传导途径促进 MMP的表达。Morishita[9]等研究发现,HGF在体外诱导人皮肤微血管内皮细胞和冠状动脉内皮细胞 M T1-MM P的生成,同时可以激活 MMP-2的活性。MM P-7由于其能够抑制肿瘤细胞凋亡,激活其他 MM P成员(MM P-2,MMp-9等 )和灭活 serpins(丝氨酸蛋白酶抑制剂),而被认为与肿瘤细胞转移直接相关。本实验研究表明 MM P-7与 HGF在白血病患者外周血中的表达呈正相关,所以我们推测白血病患者外周血中 HGF与 mmp-7之间存在一种必然联系共同作用于白血病细胞而促进其增殖及浸润,二者之间具体的作用机制需要更进一步的研究。HGF及 MM P-7在白血病患者中的测定有望成为白血病的早期诊断及治疗提供新的理论依据及治疗新靶点。
[1] 马骊,王小宁,郭亚军,等.HGF的基础和临床研究进展 [J].中国生物制品学杂志,1996,9(3):1392-1421
[2] Liotta LA,Steeg PA,Stetler SWG.Cancer metastasis and angio genesis:an imbalanee of Positive and negative regulation[J].Cell,1991,64:327-331
[3] Hiroy Uki,ramamoto,Fumio Itoh,et al.Expression of matrix metallo Pro-teinases and tissue in hibitors of metallo Priteinase in human Panereatie adeno-eareinomaelini Pathologie and Pragnostic signifieanee of matrilysin expression[J].Clinoncol,2001,19:1118-1127
[4] 肖秀英,周晓燕,孙孟红,等.MM P-2和 C-erbB-2在散发性结直肠癌原发及转移灶中表达及意义 [J].中国癌症杂志,2006,16(1):1
[5] Bueso-Ramos CE,Rocha FC,Shishodia S,et al.Expression of consti-tutively active nuclear-kappa B Rel A transcription factor in blasts of acute myeloid leukemia[J].Hum Pathol,2004,35:246-253
[6] Wilson CL,HeppnerKJ,Labosky PA,etal. Hitestinal tumorigenesis is suppressed in mice lacking the metalloproteinase matrilysin[J].Proc Natl Acad Sci USA,1997,94:1402-1407
[7] Nakopoulou L,Katsarou S,Giannopou,et al.Correlation of tissue in hibitor of metalloprotein ase with proliferative activity and patients survival in breast cancer[J].Mod Pathol,2002,15:26-34
[8] Pepper M S,Matsumoto K. Hepatocyte growth factor increase urohinase- type plasmiongen activator and U- PA receptor expression in Madin- Darly canine kidney epithelial cell[J].Biolchem,1992,267(28):20493-20499
[9] Morishita R,Aoki M,Hashiya N.Hepatocy tegrowth factor(HGF)angiogenicgene therapy:promise for cardiovascular disease[J].Gene Therapy,2002,1(4):343-349
