CXCR4在胃癌中的表达及其意义
2011-06-22王少清王佳伟
王少清,叶 凯,王佳伟
(1.泉州医学高等专科学校,福建 泉州 362000;2.福建医科大学第二临床医学院 ,福建 泉州 362000)
胃癌是消化系统最常见的恶性肿瘤之一。尽管在胃癌以手术为主的综合治疗方面取得了许多进展,但是5年生存率仍然徘徊在30%~40%左右。淋巴结转移及血行转移是肿瘤复发转移的主要原因。近年研究发现趋化因子受体(CXCR4)在某些肿瘤细胞中表达,并在肿瘤器官特异性转移中发挥重要作用。本研究应用免疫组化方法检测 CXCR4蛋白在胃癌组织、淋巴结转移组织及肝转移组织中 CXCR4蛋白的表达,同时应用 RT-PCR检测其 CXCR4mRNA在 4株胃癌细胞株中的表达,探讨其与临床病理特征的关系,以及对预后的指导意义。
1 材料与方法
1.1 标本来源
胃癌标本来自我院 2007— 01~ 2008— 12收治的胃癌患者,64例均经手术治疗术后病理确诊为胃癌,临床资料完整。患者在手术前未接受化疗或者放疗并且签署知情同意书。其中男 35例 ,女 29例 ;年龄 20~ 82岁 ,中 位年龄 56岁。组织 学分级:高分化腺癌 18例,中分化腺癌25例,未分化、低分化腺癌21例 ;浸润深度 T(1997年 UICC)T16例 ,T222例 ,T38例 ,T48例;有淋巴结转移 34例,无淋巴结转移 30例;有肝转移18例。术中采集胃癌组织及正常胃黏膜作为对照(距肿瘤边缘大于5cm),以及淋巴结转移癌、肝转移组织(均经病理证实 )。4株人胃癌细胞分别为 SGC-7901,BGC-823,NCI-N87及SNU-1细胞株,均采用含 10%小牛血清的 RPM I1640培养液培养于5%CO2饱和湿度37℃恒温培养箱内传代培养。
1.2 试剂、仪器
试剂:兔抗人 CXCR4抗体(BA0761)购自武汉博士德,免疫组化 Elivision plus试剂盒(KIT-9901)、柠檬酸组织抗原修复液、PBS、DAB购自福州迈新。 Trizol、DEPC购自Invitrigeon公 司,CXCR4引 物 序 列 (上 游 5'-CTGGAGAACCAGCGGTTACC- 3',下 游 5'-CCATGATGTGCTGAAACTGG-3',产物 639bp)及内参引物 序 列 (β- actin上 游 5'-ATCATGT TTGAGACCTTCAACA- 3',下 游 5'-CATCTCTTGCTCGAAGTCCA-3',产物 318bp)由北京三博远志公司合成。仪器:高速冷冻离心机(TGL-16G),PCR仪 (美国 PE2400),凝胶电泳仪 (DYY-Ⅲ 8B),凝胶成像系统。
1.3 方法和结果判断
①免疫组化染色采用 PowerVisionTM两步法进行染色。4μm切片经 EDTA缓冲液 (pH8.0)微波修复15min,CXCR4兔抗血清,PBS代替一抗作阴性对照,DAB显色 ,苏木素复染,中性树胶封片。染片背景清晰,以细胞膜和(或 )胞浆出现棕黄色颗粒为阳性标志,阳性细胞数大于20%以上的组织切片视为阳性表达。②逆转录聚合酶链反应 人胃癌细胞株、胃癌组织总 RNA的提取按 T RZOL操作说明进行 ,取3μ g总 RN A,加入随机引物 oligo(dT)181 μL,去离子水补充至 12μL于 70℃孵育 5min,依次加入 5× reaction buffer4μL、Rnasin(20U/μL)1μL、10mM dN TPs2μL于 37℃孵育 5min,添加 M-MuLV逆转录酶 (200U/μL)1 μL,42℃反应 60min以合成 cDN A第一链,70℃孵育10min终止反应;以此 cDNA为模板行 PCR,反应体系:10× PCR缓冲液 2.5μL、10mM dNTPs 0.5 μL、 25mM MgCl22.0 μL、10μM的上下游引物各1μ(10μM),Taq DN A聚合酶 (1U/μL)2 μL,去离子水补充总体积至 25μL。反应条件:94℃变性45s,60℃复性 45s,72℃延伸50s,30个循环,72℃再延伸5min。PCR产物于1.5%琼脂糖凝胶中电泳,凝胶成像系统摄像保存分析结果。
1.4 统计学处理
患者随访3年以上,记录的生存时间为自手术时间至末次随访或死亡时间,或随访数据库截至的时间,数据输入SPSS11.5软件包,计数资料采用卡方检验,生存率用 Kap lan-Meier方法分析,生存率比较采用 Log-rank检验。
2 结果
2.1 CXCR4蛋白在正常胃组织、胃癌组织、淋巴结转移组织和肝转移组织中的表达
CXCR4主要表达在胃癌细胞的胞膜及胞浆中,呈均匀的棕黄色颗粒状染色。本研究结果显示,CXCR4在胃癌组织的阳性表达高于癌旁组织,其阳性率分别为51.5%及15%,差异有统计学意义 (P<0.05)。肝转移组织和转移淋巴结CXCR4表达阳性率分别为72.2%及73.5%),转移组织阳性表达率明显高于原发肿瘤。
2.2 CXCR4mRN A在人胃癌细胞株中的表达
CXCR4mRN A在 4株细胞株中的 2株 (SGC-7901和BGC-823细胞株)中高表达,而在正常胃癌组织、NCI-N87及和 SNU-1细胞株中低表达。
2.3 CXCR4蛋白表达与胃癌临床病理特性的关系
胃癌组织 CXCR4阳性表达率与 TNM临床分期、淋巴结转移、肝转移密切相关,差别有统计学意义 (P<0.05)。CXCR4阳性表达率与患者年龄、性别、浸润深度、肿瘤所在部位及病理分化程度等临床病理特性间差异无显著性(P > 0.05)。见表1。
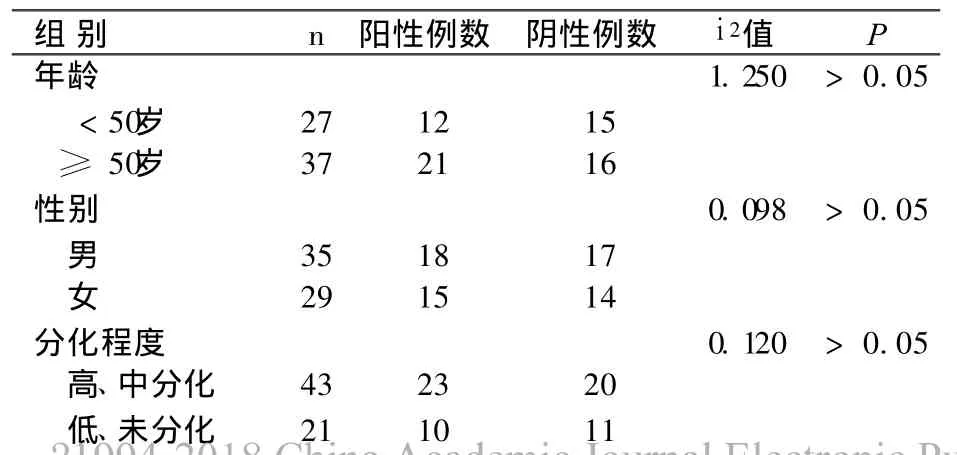
表1 免疫组化法检测胃癌 CXCR4值与临床病理因素之间的关系

?
2.4 胃癌组织 CXCR4表达水平与生存率的关系
CXCR4阳性表达胃癌组3年生存率为45.7%,明显低于CXCR4阴性表达组61.4%,两组生存率间差异有显著性意义(P < 0.05)。
3 讨论
转移是恶性肿瘤晚期的主要症状和致死原因,是一个有序、复杂、非随机的过程,有器官选择性,并与淋巴细胞归巢和白细胞游走可能存在相似机制。研究发现,趋化因子及其受体在恶性肿瘤器官特异性转移中发挥关键作用,趋化因子受体 CXCR4与其特异性配体 CXCL12所构成的 CXCR4/CXCL12生物轴在肿瘤的播散和器官特异性转移中发挥重要作用。趋化因子受体 CXCR4在肿瘤转移中的作用已分别在乳腺癌、非小细胞肺癌、胰腺癌、胃癌等研究中得到证实[1~5]。肿瘤细胞高表达趋化因子受体 CXCR4,从而易于向表达其配体的器官转移。肿瘤细胞从母瘤上脱落后,经迁徙,容易趋向并滞留于表达 CXCR4配体的部位 (淋巴结、肝、肺等),在其内增殖而形成转移瘤。目前关于胃癌中趋化因子CXCR4表达及其在转移中的作用尚不清楚。本研究发现CXCR4/CXCL12在胃癌组织中高表达,正常黏膜 CXCR4/CXCL12呈低表达,CXCR4在肝转移组织、淋巴结转移组织中高于原发肿瘤。提示:CXCR4阳性表达与胃癌的生长、转移有关。胃癌细胞株 CXCR4的表达是不均匀的,部分高表达,部分低表达或不表达,这也可解释胃癌患者生物学行为类似,部分易淋巴及血行转移。进一步研究 CXCR4的阳性表达与胃癌临床病理特性的关系发现:CXCR4的表达与胃癌淋巴结转移、肝转移、临床分期密切相关,而与肿瘤分化程度、浸润深度及部位等无关。提示:趋化因子受体 CXCR4主要在肿瘤转移中的起重要作用(包括淋巴结、血行转移),而肿瘤浸润中的作用并不明显。Mashino[5]对 68例胃癌研究发现:趋化因子与淋巴结转移及淋巴管浸润有关,CXCR阳性胃癌患者预后较差,回归分析显示 CXCR阳性是淋巴结转移的重要因素之一。本研究显示 ,伴区域淋巴结转移的胃癌患者 CXCR4阳性率显著高于无区域转移的胃癌患者 (P<0.05),淋巴结组织 CXCR4阳性率显著高于胃癌组织 (P<0.05),提示CXCR4阳性表达与胃癌的淋巴结转移密切相关。Sumiya[6]在胃癌研究发现,有淋巴结转移癌组织中的 CXCL12和CXCR4阳性表达均高于无淋巴结转移组织。Tamamura等[7]的研究发现 CXCL12的抑制剂 T140类似物在体外实验中能有效的抑制 CXCL12诱导的人乳腺癌细胞 MDA-MB-231的侵袭,体内实验中可以降低 MDA-MB-231SCID小鼠接种后肺转移的发生。
CXCR4阳性组预后差的主要原因可能是由于发生胃癌的远处转移。肝脏是胃癌最常见的转移部位,由于手术中无法准确判断有否微小转移灶存在,因此如何预测肝转移并早期诊断、及时治疗是目前影响胃癌治疗效果的主要环节。本研究显示伴肝转移的胃癌患者 CXCR4阳性表达率72.2%(13/18)显著高于无肝转移的患者 43.5%(20/46),CXCR4阳性表达组 3年生存率为61.7%,明显低于 CXCR4阴性表达组73.9%。提示胃癌组织 CXCR4阳性表达与肝转移密切相关,CXCR4阳性表达患者预后较差。Yasumoto等[8]的研究也显示,CXCR4表达阳性的原发性胃癌与胃癌腹膜转移有高度相关性,应用 CXCR4拮抗剂 AM D3100可有效抑制胃癌细胞的腹膜转移及腹水生成。Liang等[9]通过小分子干扰核糖核酸技术(siRNA)从 mRN A水平阻断 CXCR4的表达后削弱了乳腺癌细胞在重组细胞基底膜侵袭抑制实验中的侵袭能力并且在动物实验中阻止乳腺癌转移的发生。
本研究显示趋化因子家族影响着肿瘤的生长、远处转移。检测胃癌细胞趋化因子受体 CXCR4成员有助于判断患者转移或者复发,这将完善胃癌分子生物学分期系统,并且有助于筛选治疗胃癌的靶基因通过阻断趋化因子 CXCR4/CXCL12通路,有望成为肿瘤治疗的新靶点。
[1] Spano JP,Andre F,Morat L,et al.Chemokine receptor CXCR4 and early-stage non-small cell lung cancer:Pattern of expression and correlation with outcome[J].Ann Oncol 2004,15(4):613-617
[2] Koshiba T,Hosotani R,Miyamoto Y,et al.Expression of stromal cell-derived factor1and CXCR4ligand receptor system in pancreatic cancer:a possible role for tumor progression[J].Clin Cancer Res 2000,6(9):3530-3535
[3] 王正林,胡祥,梁品,等.趋化因子受体 CXCR4在胃癌中的表达及其意义 [J].中华普通外科杂志,2009,18(12):1275-1279
[4] Kato M,Kitayama J,Kazama S,et al.Expression pattern of CXC chemokine receptor-4 is correlated with lymph node metastasis in human invasive ductal carcinoma[J].Breast Cancer Res,2003,5(5):144-150
[5] Mashino K,Sadanaga N,Yamaguchi H,et al.Expression of chemokine receptor CCR7 is associated with lymph node metastasis of gastric carcinoma[J].Cancer Res,2002,62(5):2937-2941
[6] Sumiyai,Shojin,Hiroshio,et al.Clinical implication of CXCL12 expression in gastric cancer[J].Ann Surg Oncol,2007,14(11):3154-3158
[7] Tamamura H,Hori A,Kanzaki N,et al.T140analogs as CXCR4 antagonist s identified as anti2metastatic agents in the treatment of breast cancer[J].FEBS Lett,2003,550(1~3):79-83
[8] Yasumoto K,Koizumi K,Kawashima A,et al.Role of t he CXCL12/CXCR4 axis in peritoneal carcinomatosis of gast ric cancer[J].Cancer Res,2006,66(4):2181-2187
[9] Liang Z,Yoon Y,Votaw J,et al.Silencing of CXCR4 blocks breast cancer metastasis[J].Cancer Res,2005,65(3):967-971
