MMP26在上皮性卵巢癌中的表达及意义
2011-06-22孙盛梅李晶晶孙文娟
孙盛梅,李晶晶,孙文娟
(佳木斯大学附属第一医院妇产科,黑龙江 佳木斯 154003)
恶性卵巢肿瘤是女性三大恶性肿瘤之一,几年来其发病率呈上升趋势,死亡率居于妇科恶性肿瘤的首位。由于卵巢癌早期症状较少,且容易转移,发现时往往已经是晚期,所以早期的诊断及治疗有着重要的临床意义。本文通过研究MM P26在正常卵巢组织、上皮性卵巢癌的表达情况,观察MM P26与上皮性卵巢癌的关系,为卵巢癌的早期诊断、治疗及预后提供了一种新的价值指标。
1 资料和方法
1.1 一般资料
选取佳木斯大学附属第一医院 2010-01~ 2011-04手术切除的卵巢组织共计 40例,正常卵巢组织 10例 ,上皮性卵巢癌组织 30例,其中浆液性癌 20例,黏液性癌 10例,,全部标本均经过手术后病理检查确诊,所有患者均为初发者,术前未接受过任何化疗。
1.2 方法
本实验采用免疫组织化学 SP法。
1.3 统计学分析
应用 SPSS18.0统计软件对实验数据进行分析处理,采用i2检验和 Fisher确切概率法,以 P <0.05为有统计学意义。
2 结果
2.1 MMP26在不同卵巢组织中的表达
上皮性卵巢癌组织中 MM P26的表达水平高于在正常卵巢组织中的表达水平,阳性率分别为 76.67%、30.00%,差异有统计学意义 (i2= 21.85,P<0.05);如表1。
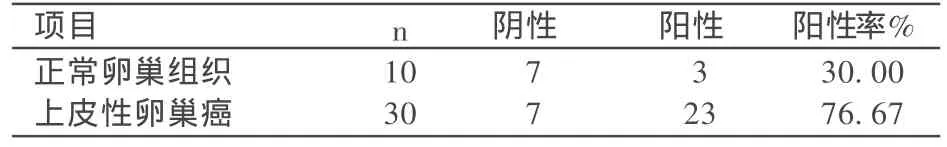
表1 Mmp26在三种不同卵巢组织中表达的比较
2.2 MMP26在上皮性卵巢癌组织中的表达
如表2所示,MM P26在上皮性卵巢癌中的表达与年龄、病理类型无关,与病理分级、手术病理分期有关,病理分级越高表达率越高。
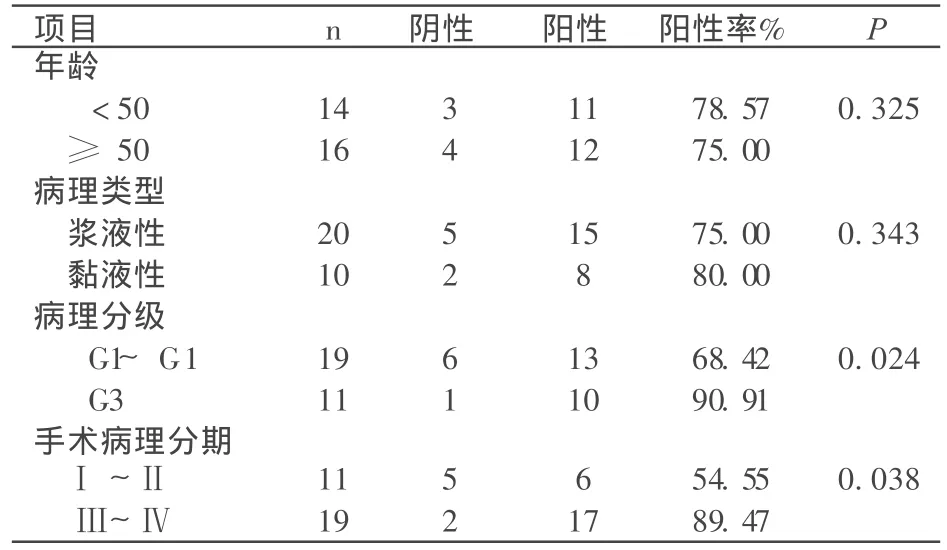
表2 MM P26在上皮性卵巢癌中的表达
3 讨论
卵巢癌是女性三大恶性肿瘤之一,但是其死亡率位于女性恶性肿瘤之首,由于早期症状不典型,并且易于转移 ,早期的诊断方法还不是很完善,所以往往发现时已经是晚期,晚期又缺乏特异的疗效指标,使得卵巢癌的五年生存率仅为30%左右。因此研究卵巢癌的早期诊断方法及治疗预后意义重大。MM Ps作为细胞外基质和基底膜降解的主要介质,在多种生理及病理的过程中都发挥着作用,如月经周期、乳腺发育、伤口愈合、风湿性疾病、骨关节炎以及肿瘤的侵袭和转移等等[1~5],同时 MM Ps在细胞与周围基质环境的相互作用及影响细胞溶化进程如细胞的分化、增殖和凋亡中起到更为重要的作用,进而参与肿瘤的侵袭与转移[6,7]。基质金属蛋白酶 -26(matrix metallo proteinase-26,MMP-26),又称matrilysin-2,是 MM Ps家族的最新成员,于 2000年从人类子宫内膜肿瘤 cDNA文库中克隆发现[8],其基因定位于 11号染色体短臂上 11p15.3,由 261个氨基酸组成,分子量为28Kda[9,10]。病理情况下,多种肿瘤细胞可以表达 MM P-26,MM P-26主要表达于上皮起源的肿瘤,如肺癌、乳腺癌、子宫内膜癌和前列腺癌。但是对于 MM P26在上皮性卵巢癌中报道尚无。本实验对 10例正常卵巢组织及 30例上皮性卵巢癌组织进行免疫组化 SP法染色,研究显示:MMP26在上皮性卵巢癌中的表达明显高于在正常卵巢组织中的表达,其阳性率分别为 76.67%、30.00%,差异有统计学意义(P <0.05),说明 MM P26在卵巢癌的发生中发挥着一定的作用;如表2所示 MM P26在上皮性卵巢癌中的表达与年龄、病理类型不相关 (P> 0.05),与病理分级、手术病理分期有关 (P<0.05),推测 MM P26参与了卵巢癌肿瘤细胞的增殖、浸润及转移,与卵巢癌的预后有关。肿瘤组织分化越差,恶性程度越高,预后也越差。结果显示,MM P26在上皮性卵巢癌中较高表达,癌组织分化越低,MM P26的表达越高,低分化组的阳性率高于高分化组的阳性率,这些为卵巢癌的早期诊断、治疗及预后提供了一种新的指标和一些新的理论依据。
[1] Chang C,Werb Z.The many factors of metalloproteinase:cell growth,invasion,angiogenesis and metastasis[J].Trends Cell Biol,2001,11:37-43
[2] Vihinen P,Kahari VM.Matrix metalloproteinases in cancer:prognostic markers and therapeutic targets[J].Int J Cancer,2002,99:157-166
[3] Stamenkovic I.Matrix metalloproteinases in tumor invasion and metastasis[J].Semin Cancer Biol,2000,10:415-443
[4] Parks WC.Matrix metalloproteinases in repair[J].Wound Repair Regan,1999,7:423-432
[5] John A,Tuszynski G.The role of matrix metalloproteinases in tumor angiogenesis and tumor metastasis[J].Pathol Oncol Res,2001,7:14-23
[6] McQuibban GA,Gong JH,Tam EM,et al. Inflammation dampened by gelatinase A cleavage of monocyte chemoattractant protein-3[J].Science(Washington,D.C),2000,289:1202-1206
[7] McCawley LJ, Matrisian LM. Matrix metalloproteinases:multifunctional contributors to tumor progression[J].Mol Med Today,2000,6:149-156
[8] Nelson AR, Fingleton B, Rothenberg M L, et al. Matrix metalloproteinases:biologic activity and clinical implications[J].J Clin Oncol,2000,18(5):1135-1149
[9] De Coignac AB,Elson G,Delneste Y,et al.Cloning of MMP-26.A novel matrilysin-like proteinase[J].Eur Biochem,2000,267(11):3323-3329
[10] Park HI,Ni J,Gerkema FE,etal.Identification and characterization of human endometase(matrixmatalloproteinase-26)from endometrial tumor[J].Biol Chem,2000,275(27):20540-20544
