低氧环境下转染血管内皮生长因子165对人胃癌细胞体外侵袭转移的影响
2011-06-22袁翠林欧希龙
袁翠林,欧希龙,2
(1.东南大学医学院,江苏南京 210009;2.东南大学附属中大医院 消化科,江苏南京 210009)
低氧环境可以促进胃癌肿瘤血管生成、促进肿瘤的侵袭和转移。通过诱发组织缺氧,激活缺氧诱导因子1a(HIF-1a)可引起许多基因的转录激活,包括血管内皮生长因子(vascular endothelial growth factor,VEGF)[1]。VEGF是血管内皮细胞的特异丝裂原,具有促进血管内皮细胞增殖、游走及血管新生和提高血管通透性等生物活性,其中活性最强的是VEGF165。有研究证实,胰腺癌组织存在HIF-1a过表达和尿激酶型纤溶酶原激活物(uPA)高表达[2]。我们前期实验[3]发现,转染了VEGF165的胃癌细胞uPA、基质金属蛋白质酶2(MMP-2)的表达显著升高。关于低氧环境下VEGF165与uPA及MMP-2在细胞中表达是否存在一定的关系目前暂无确切研究。本实验在前期研究基础上对转染了VEGF165的胃癌细胞株BGC-823进行化学性低氧诱导,研究在低氧环境下转染了VEGF165的胃癌细胞侵袭能力及uPA、MMP-2的表达,以求进一步揭示胃癌细胞侵袭转移的分子机制。
1 材料与方法
1.1 材料
人胃腺癌细胞株BGC-823购自中国科学院;转载VEGF165的复制缺陷型腺病毒重组体(Ad-VEGF165)由南京医科大学第一附属医院构建并赠送;Trizol裂解液、RT-PCR试剂盒购于TaKaRa公司;PCR引物由上海生物工程技术有限公司设计并合成;化学性低氧诱导剂氯化钴购自Sigma公司,以三蒸水配成10 mmol·L-1的储存浓度,-20℃储存。
1.2 方法
1.2.1 细胞培养 BGC-823细胞以含有10%胎牛血清的RPMI-1640培养液于37℃、5%CO2的培养箱中培养,培养基中含 100 U·ml-1青霉素和 100 U·ml-1链霉素。
1.2.2 瞬时转染 取对数生长期的BGC-823细胞,消化后计数调整培养液用量,使细胞悬液终浓度为1.0 ×105个·ml-1,接种至 50 ml培养瓶中。次日,细胞在培养瓶中贴壁生长约60%融合时,按感染复数(MOI)为20分别加入无血清无抗生素培养液稀释的Ad-VEGF165的病毒液2 ml进行病毒感染,8 h后换RPMI-1640完全培养液继续培养。
1.2.3 实验分组及低氧干预 实验分A、B、C、D组。A组:以10%胎牛血清RPMI-1640常规培养BGC-823细胞;B组:将对数生长期的常规BGC-823细胞的培养液,换为含有低氧模拟剂氯化钴100 μmol及10%胎牛血清的RPMI 1640培养基;C组:将对数生长期的细胞瞬时转染Ad-VEGF165;D组:将对数生长期细胞进行转染,然后将细胞培养基换为含有低氧模拟剂氯化钴100 μmol及10%胎牛血清的RPMI 1640培养基。
1.2.4 Transwell小室细胞体外迁移实验 将人工合成的基底膜材料Matrigel胶用同样体积的无血清培养液稀释后,分别取300 μg均匀加于每个小室的膜上,十字摇晃使胶平铺在聚碳酸脂膜上,37℃成胶30 min。小室膜的下层涂布10 mg·L-1的纤黏蛋白基底(FN)50 μl。使用前加无血清培养液于小室内37℃ 放置20 min,使Matrigel重新水化。分别收集4组细胞,用2.5 g·L-1胰酶消化后,用无胎牛血清的RPMI 1640洗涤细胞3次,制成单细胞悬液,细胞浓度为1×108个·L-1。将Transwell小室放入六孔板中,下室中加入1 500 μl含 100 ml·L-1胎牛血清的培养液,上室加入无胎牛血清RPMI1640培养液稀释的单细胞悬液800 μl,每组细胞设3个复孔,置于37℃、5%CO2的细胞培养箱中培养8 h,取出滤膜,95%乙醇固定15~30 min,然后行HE染色,轻轻用棉签擦净小室上室面无侵袭性的细胞,在倒置显微镜下放大200倍计数移至微孔膜下层的细胞数目,每个样本随机选择5个视野计数后取均值,细胞体外侵袭力以侵入滤膜下层的细胞数来判定。
1.2.5 RT-PCR半定量检测uPA、MMP-2的表达 4组细胞继续培养至细胞融合达90%以上时,按Trizol试剂盒说明提取A、B、C、D各组细胞总RNA,琼脂糖凝胶电泳初步评价RNA的质量,分光光度仪测定总RNA纯度。根据RNA纯度将每组的RNA调至每个反应体系中含1 μg。uPA引物上游序列为5'-TCTGT GTGTGGGACTGATGC-3',下游序列为5'-GCCCTGAC CTGAATCACAAT-3',扩增产物为324 bp;MMP-2引物上游序列为5'-CTAGACAAGGGCCACAGACC-3',下游序列为5'-GAGGAAGCAAACCTCGAACA-3',扩增产物为230 bp;β-action上游引物5'-CAAGGTCATCCATGA CAACTTTG-3',下游引物 5'-GTCCACCACCCTGTTGCT GTAG-3',扩增长度496 bp。对RT-PCR产物进行琼脂糖电泳,数字成像系统进行拍照分析。
1.3 统计学处理
2 结 果
2.1 侵袭实验结果
每个小室随机抽取5个视野,计算每个视野的细胞总数。结果发现,D组细胞穿过微孔膜的细胞数明显高于其他3组细胞(P<0.05),提示在低氧环境下转染VEGF165的胃癌细胞体外侵袭迁移能力增强(图 1、表 1)。
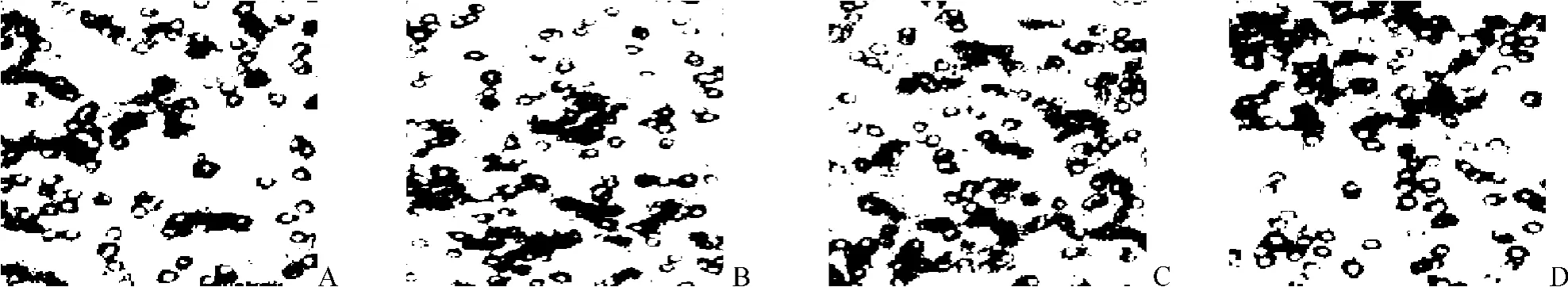
图1 低氧环境和VEGF165因子对人胃癌细胞BGC-823侵袭能力的影响
表1 低氧环境和VEGF-165因子对人胃癌细胞BGC-823侵袭能力的影响±s)

表1 低氧环境和VEGF-165因子对人胃癌细胞BGC-823侵袭能力的影响±s)
与A组比较,a P<0.05;与 B组比较,b P>0.05,c P<0.05;与 C 组比较,d P <0.05
组 别 细胞数量/个A组170±12.1 B组 186.07±13.82a C组 188.21±13.50ab D组 222.41±16.01acd
2.2 uPA mRNA在实验各组中的表达
RT-PCR结果(图 2、表 2)表明,与 A、B、C 组相比,D组中uPA的mRNA表达明显增高,差异有统计学意义(P<0.05);B、C组中的uPA的mRNA表达较A组增高,差异有统计学意义(P<0.05);B组与C组比较差异无统计学意义(P>0.05)。

图2 低氧环境和VEGF-165因子对人胃癌细胞BGC-823表达uPA mRNA的影响

表2 低氧环境和VEGF-165因子对人胃癌细胞BGC-823表达uPA mRNA的影响
2.3 MMP-2 mRNA在实验各组中的表达
RT-PCR结果(图 3、表 3)表明,与 A、B、C 组相比,D组中MMP-2的mRNA表达明显增高,差异有统计学意义(P<0.05);B组、C组中的MMP-2的mRNA表达较A组增高,差异有统计学意义 (P<0.05);B组与C组比较差异无统计学意义 (P>0.05)。
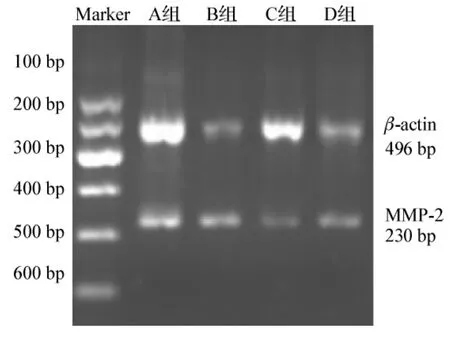
图3 低氧环境和VEGF-165因子对人胃癌细胞BGC-823表达MMP-2 mRNA的影响

表3 低氧环境和VEGF-165因子对人胃癌细胞BGC-823表达MMP-2 mRNA的影响
3 讨 论
胃癌的浸润和转移是造成病人死亡的主要原因。癌转移的基本过程为:(1)癌细胞浸润周围正常组织,穿入小血管或淋巴管;(2)释放癌细胞入血管或淋巴管;(3)癌细胞在循环中运行和存活;(4)停滞在远处器官的毛细血管床;(5)出小血管或淋巴管,形成转移灶。而其浸润转移的分子机制为:(1)癌细胞黏附力降低;(2)蛋白溶解酶降解;(3)癌转移中的相关细胞运动因子。癌侵袭的关键步骤就是穿入管壁和穿出管壁。胃癌的侵袭和转移是影响患者预后的主要因素。肿瘤的浸润转移涉及到肿瘤细胞穿过ECM屏障、血管基底膜及血管壁进入宿主微环境等多个环节。目前研究发现,VEGF在正常人多种组织中不表达或少量表达,而在恶性肿瘤组织中常过量表达,并以自分泌或旁分泌作用于肿瘤细胞,与多种肿瘤的转移、预后及复发相关[4-8]。
Liotta[9]指出肿瘤细胞黏附、分泌蛋白酶降解细胞外基质和移动是肿瘤浸润和转移的三个关键步骤。MMP家族是降解细胞外基质的主要酶类。MMP-2是此家族中的重要成员,具有强大降解细胞外基质的作用,在肿瘤的侵袭和转移中具有重要作用[10]。张岩等[11-12]研究指出,VEGF165及 MMP-2是卵巢癌发生的重要相关因子,对肿瘤的生长、侵袭及转移具有重要作用。我们前期的实验发现[3,13-14],转染了 VEGF165的胃癌细胞,其黏附和转移能力均较正常或者转染空载体的胃癌细胞增强,其表达的侵袭相关分子uPA也显著升高。其机制可能为转染了VEGF165的胃癌细胞上调了uPA的表达,继而通过uPA与u-PA结合,激活MMP2-9,然后 uPA与Ⅰ型胶原结合,从而调节MMP2-9的活性,调节细胞侵袭转移。
肿瘤细胞的生长需要血管提供营养,而血管形成过程是多因子相互调控相互影响的过程,主要为:(1)血管发生阶段:通过合成NO使血管扩张、VEGF及血管内皮生长因子受体-1表达增强来增加血管通透性。(2)进展阶段:通过上调MMP降解细胞外基质、上调VEGF而诱导血管内皮细胞增殖和迁移,同时在血管生成素(angiogenin,Ang)-2的参与下,形成结节状血管芽。(3)形成阶段:在VEGF、Ang-1和整合素的作用下,单个血管芽形成血管腔,并与临近的血管相互吻合成血管网。(4)塑形和改建阶段:通过血小板生长因子(platelet growth factor,PGF)、Ang-1等使血管平滑肌或其他细胞迁移包绕新生血管,产生外基质,从而完成血管壁结构。HIF-1是低氧状态下血管发生的核心调控因子,通过调节其他生长因子的表达而直接参与血管发生的全过程,其作为上游调控基因,比VEGF、Ang-2等单纯基因更有效率,因此HIF-1a在新生血管形成中的作用要比单独VEGF的作用更为重要[15]。有实验证实,HIF-1a在常氧条件下迅速降解,降低了VEGF持续高表达诱发血管瘤的危险性[16-17]。Bottger等[18]对壶腹癌和胰腺癌标本作免疫组织化学分析发现,胰腺癌中uPA表达明显增高,但是与HIF-1a的表达程度无等级相关性。高臻等[2]在对胰腺癌标本进行免疫组化分析时发现,胰腺癌组织存在HIF-1a过表达和uPA高表达。
本实验通过构建腺病毒载体将VEGF165转染入人胃腺癌细胞株BGC-823,低氧诱导干预转染后的细胞,发现转染了VEGF165的胃癌细胞在低氧干预后侵袭能力及uPA、MMP-2的表达增强,D组与A、B、C组比较,uPA、MMP-2表达均增高,差异有统计学意义(P<0.05)。其机制可能为低氧环境下,VEGF165与uPA及MMP-2的表达存在一定的相关性,VEGF165的高表达通过一定的信号通路促进了uPA及MMP-2的表达。在低氧环境下,VEGF165可能通过上调uPA及MMP-2的表达增强了肿瘤细胞的侵袭转移能力。但肿瘤的侵袭转移是一个复杂的过程,目前对VEGF165在肿瘤发生、发展中的机制不是十分清楚,仍需进一步研究低氧环境下VEGF165基因的表达调控机制以及信号传导通路。
[1]HOLZBACH T,NESHKOVA I,VLASKOU D,et al.Searching for the right timing of surgical delay:Angiogenesis,vascular endothelial growth factor and perfusion changes in a skin-apmodel[J].J Plast Reconstr Aesthet Surg,2009,62:1534.
[2]高臻,柴小军,孙洪成,等.缺氧诱导因子和细胞黏附分子在胰腺癌中表达及临床意义[J].肿瘤,2008,28(3):256-259.
[3]乐红琴,欧希龙,杭程,等.血管内皮生长因子165基因对人胃癌细胞体外侵袭转移的影响[J].世界华人消化杂志,2008,16(36):4036-4040.
[4]BOXER G M,TSIOMPANOU E,LEVINE T,et al.Immunohistochemical expression of vascular endothelial growth factor and microvessel counting as prognostic indicators in nodenegative colorectal cancer[J].Tumour Biol,2005,26(1):1-8.
[5]SUN X Y,WU Z D,LIAO X F,et al.Tumor angiogenesis and its clinical significance in pediatric malignant liver tumor[J].World J Gastroenterol,2005,11(5):741-743.
[6]翟怡,黎莉,王新美,等.Survivin、VEGF和p53在乳腺癌组织中的表达及相关性研究[J].中国现代普通外科进展,2009,12(2):102-105.
[7]WU T T,WANG J S,JIANN B P,et al.Expression of vascular endothelial growth factor in Taiwanese benign and malignant prostate tissues[J].J Chin Med Assoc,2007,70(9):380-384.
[8]关云艳,欧希龙.VEGF165和VEGF165b与肿瘤关系的研究进展[J].现代医学,2006,34(6):447-450.
[9]LIOTTA L A.Tumor invasion and metastases—role of the extracellular matrix:Rhoads Memorial Award Lecture[J].Cancer Res,1986,46(1):1-7.
[10]NOMURA H,SATO H,SEIKI M,et al.Expression of membrane-type matrix metalloproteinase in human gastric carcinomas[J].Cancer Res,1995,55(15):3263-3266.
[11]张岩,陈颖,魏力.VEGF165与MMP2在卵巢上皮性癌中的表达及临床意义[J].医学临床研究,2008,25(11):1968-1970.
[12]CHEN Y,ZHAO W,ZHANG Y,et al.Expression of mRNA of MMP-2 and VEGF165 genes in ovarian cancer and the relationship between them[J].Modern Oncology,2009,17(6):1143-1151.
[13]关云艳,欧希龙,孙为豪,等.血管内皮生长因子165基因对人胃癌细胞在体外生长及其受体表达的影响[J].世界华人消化杂志,2007,15(7):700-705.
[14]欧希龙,关云艳,颜芳,等.血管内皮生长因子165基因对人胃癌细胞凋亡的影响及机制[J].世界华人消化杂志,2008,16(3):307-310.
[15]李雯霖,张莉,张越骊,等.氧诱导鼠视网膜病变中低氧诱导因子-1a和血管内皮生长因子的表达[J].国际眼科杂志,2010,10(6):1056-1057.
[16]DAI Y,XU M,WANG Y,et al.HIF-1 alpha induced-VEGF overexpression in bone marrow stem cells protects cardio-myocytes against ischemia[J].J Mol Cell Cardiol,2007,42(6):1036-1044.
[17]邹多宏,黄远亮.低氧诱导因子-1a的研究进展[J].国际口腔医学杂志,2010,37(3):320-323.
[18]BOTTGER T C,MASCHEK H,LOBO M,et al.Prognostic value of immunohistochemical expression of beta-1 integrin in pancre-atic carcinoma[J].Oncology,1999,56(4):308-313.
