兔外周血内皮祖细胞的多功能分子影像探针标记及其在肿瘤模型中的活体示踪
2011-06-22王心怡居胜红李聪彭新桂
王心怡,居胜红,李聪,彭新桂
(1.东南大学附属中大医院放射科,江苏省分子与功能影像重点实验室,江苏 南京 210009;2.复旦大学药学院,上海 201203)
内皮祖细胞(endothelial progenitor cells,EPCs)是血管内皮细胞的前体细胞,它们对出生后新生血管的形成及维持血管稳定性意义重大[1-2]。近年来大量研究表明骨髓源EPCs在肿瘤新生血管形成过程中有重要作用[3-4],虽然机制尚不明确,但是多数研究者认为生长中的肿瘤通过分泌促血管生长因子使骨髓中的EPCs被动员至外周并“归巢”到肿瘤部位[5-6]。因此,利用EPCs的“归巢”特性,它们可以被用作影像学探针的靶向性载体进行肿瘤成像[7]。由于肿瘤血管形成的机制非常复杂,因此相关研究尚处于起步阶段。在所有小动物活体成像方法中,磁共振成像具有无创和高分辨率的特点,相关的临床前的研究成果很容易被转化进入临床应用[8],但是磁共振成像在敏感性方面不具备优势。光学成像的高敏感性足以检测到发射微光的物质,但受到成像组织自身的光吸收性和散射性影响,成像效果有时不尽如人意[9]。而将磁共振和光学成像结合的多模态成像方式可以使两种成像手段优势互补,在临床前研究中潜力巨大。常用的基于氧化铁的磁共振T2对比剂可以使信号降低,但这种低信号可能会与磁场不均匀性混淆。另外,由于该物质在细胞内代谢,信号强度会随时间递减[10],而非生理性的细胞内铁的聚集也具有一定细胞毒性[11]。T1对比剂虽然敏感性略次于前者,却能产生T1正信号,因而不易受到术后组织中伪影的干扰。基于钆(Gd)的对比剂已被成功用于细胞标记和活体细胞示踪研究[12]。
本实验中用细菌胞嘧啶脱氨酶(bacterial cytosine deaminase,bCD)和多聚左旋赖氨酸(poly-L-lysine,PLL)合成探针,将磁共振对比剂Gd、近红外荧光基团Cy5.5及荧光染料罗丹明与bCD-PLL偶联,构建功能性探针共轭化合物-1用于体外标记EPCs。波长650~900 nm的近红外(near infrared,NIR)光穿透力强,在此波长范围内生物自发荧光弱,水和血红蛋白的吸收系数小,因此含有近红外染料的探针非常适合进行分子水平小动物活体成像。同时,共轭化合物-1中结合的罗丹明具有细胞(组织)体外荧光检测性,从而优化了探针的荧光成像能力。体外实验证实共轭化合物-1能够成功标记EPCs并且不影响细胞的增殖和细胞周期。将标记的细胞移植于乳腺癌荷瘤鼠模型后,通过磁共振成像和光学成像可以成功进行小动物体内细胞示踪。
1 材料与方法
1.1 材料
密度梯度离心液(天津灏洋生物制品科技有限公司),肝素钠注射液(常州千红生化制药有限公司),内皮细胞基础培养液(EBM-2)、Single Quots组合添加剂(Lonza,美国),RPMI-1640 培养基(Gibco,美国),人血浆纤维连接蛋白(Chemicon,美国),胰蛋白酶(Sigma,美国),胎牛血清(FBS,杭州四季青生物工程材料研究所),四氮噻唑蓝(MTT,Fluka,瑞士),二甲基亚砜(DMSO,上海生工生物工程有限公司),CO2培养箱(Herabus,德国),倒置相差显微镜(Zeiss,德国),紫外分光光度计(Bedkmen,美国),净化工作台(吴江市生化净化设备厂),7.0-T MR成像设备(Bruker PharmaS-can,德国),Maestro小动物活体光学成像系统(CRi,美国)。
1.2 方法
1.2.1 构建共轭化合物-1 bCD蛋白提取于人工培养的大肠杆菌,分别将罗丹明、生物素、Gd3+-DOTA三种成分与PLL连接,然后将PLL与bCD按1∶1比例合成[13]。共轭化合物-1 中 bCD hexamer/PLL/Rhodamine/Cy5.5/Gd3+-DOTA/生物素摩尔比为 1∶1∶1∶1∶15∶3,相对分子质量为 345 000。
1.2.2 兔外周血EPCs的分离、培养及鉴定 兔外周血EPCs的培养、鉴定工作已由本实验室完成,具体参见文献[14]。
1.2.3 检测共轭化合物-1对细胞增殖和细胞周期的影响 用MTT实验检测共轭化合物-1标记后对细胞增殖力的影响和毒性作用。生长良好的P3代EPCs以104个·孔-1接种于96孔培养板的72个孔中,将共轭化合物-1 按0.25、0.5、1、2、3 μmol·L-1共 5 个浓度梯度分别加入孔中,每个浓度设12个复孔,另有12孔为未标记共轭化合物-1的空白对照组。分别于标记后第1天和第5天检测,各组取6孔。
检测细胞周期,选取生长良好的P3代细胞,与2 μmol·L-1浓度共轭化合物-1孵育24 h,以未标记细胞作为阴性对照。两组各5×105个细胞,以70%酒精于4 ℃冰箱中固定24 h,加入10 μg·ml-1RNA 酶抑制剂 5 μl,37 ℃ 孵育 30 min,加入 50 μg·ml-1碘化吡啶5 μl,4℃孵育5 min后以流式细胞仪分析细胞周期。
1.2.4 细胞内吞能力动态研究及细胞标记率分析 P3代细胞以2 μmol·L-1浓度的共轭化合物-1进行孵育标记,并在荧光显微镜下观察。分别在15 min、30 min、1 h、4 h、24 h、48 h 消化,经漂洗、离心、重悬后用0.5%的多聚甲醛4℃保存,以未标记细胞作为空白阴性对照,1×106个细胞·组-1,24 h后流式细胞仪进行流动细胞计数,用Cell Quest 3.3(BD Bioscience)软件采集数据并分析荧光阳性细胞率。
1.2.5 乳腺癌模型的建立及EPCs移植 人乳腺癌细胞MDA-MB-231采用RPMI-1640培养基培养。将MDA-MB-231细胞约1×106个制成悬液0.1 ml,种于3~5周龄雌性裸鼠右侧腋下乳腺脂肪垫中。1周左右成瘤,瘤体直径约0.5 cm,成瘤后即移植EPCs。共轭化合物-1 按2 μmol·L-1浓度与 EPCs共同孵育 24 h后消化细胞、离心并计数。将荷瘤鼠麻醉后消毒心前区,经心脏穿刺向左心室注射标记或未标记的EPCs约2×106个。
1.2.6 活体磁共振成像 磁共振成像在7.0 T Micro-MR成像设备上完成。荷瘤鼠移植EPCs后第1、5、10天分别采集肿瘤部位T1WI及T1-map序列图像,每组3只。扫描过程中动物使用1%异氟烷气体麻醉并监测呼吸频率。磁共振成像序列采用多层面T1加权自旋回波序列(TR msec/TE msec,600/7.5),层厚 1 mm,256×256矩阵,扫描视野(FOV)为3 cm×3 cm。通过T1-map相测算肿瘤T1弛豫时间,采用RARE序列:TR=200、400、800、1 500、3 000、5 000 msec,TE=11 msec,翻转角180°,层厚1 mm,选择肿瘤最大层面采集,感兴趣区为10 mm2的圆形区域。
1.2.7 近红外光学成像 与磁共振成像时间点相同,小动物活体光学成像使用Maestro活体成像系统,橙色光激发共轭化合物-1中的 Cy5.5,激发光波长675 nm,发射光波长695 nm,曝光时间500 ms。图像分析使用Maestro 2.4 software,测量肿瘤组织平均信号强度随时间的变化。
1.3 统计学处理
2 结 果
2.1 兔外周血EPCs的培养及形态学观察
通过倒置显微镜观察细胞形态,最初分离得到的单个核细胞表现为小圆形,培养48 h发现大部分细胞贴壁。贴壁细胞形态不规则,培养至第5天可见细胞集落。生长旺盛的细胞出现在培养10 d左右,集落中央可见典型内皮细胞的“铺路石样”形态。原代细胞长满后经过反复1∶2传代,P3代细胞呈现为均一的纺锤形(图 1A)。浓度为 2 μmol·L-1的共轭化合物-1 标记EPCs 24 h后,通过荧光显微镜观察,可见被绿光激发的罗丹明分布于胞浆内(图1B),说明共轭化合物-1已被细胞吞噬。

图1 倒置相差显微镜下观察P3代EPCsFig 1 Cellular morphology EPCs observed with an inverted microscope
2.2 共轭化合物 对细胞增殖和细胞周期的影响
不同浓度的共轭化合物-1标记EPCs后第1天和第5天分别进行MTT比色实验。结果显示各浓度标记组光吸收值与空白对照组相比差异无统计学意义(P>0.05),EPCs的活性均未受到明显的影响。标记、未标记EPCs经流式细胞仪检测细胞周期,处于G0/G1期细胞分别为(91.27±0.04)%和(92.01±0.06)%,二者无明显差异(P>0.05),标记共轭化合物-1对细胞周期没有显著影响。
2.3 细胞内吞共轭化合物-1能力
流式细胞仪测得,经标记的细胞于 15 min、30 min、1 h、4 h、24 h、48 h 的平均荧光强度分别为17.98、18.58、20.64、24.27、51.96、60.14,未标记细胞为3.47(小于10为阴性)。说明细胞对共轭化合物-1的吞噬力在孵育1h内快速上升 经过其后一段时间的缓慢递增,在24~48 h间内吞速度平稳。
2.4 乳腺癌荷瘤鼠活体磁共振成像
共轭化合物-1标记或未标记的EPCs经心脏穿刺移植后第1、5、10天分别进行活体磁共振成像。肿瘤部位信号在移植后第1天未见明显改变。与对照组相比,标记的EPCs移植后第5天在肿瘤周边区域可见点片状高信号出现(图2),第10天此区域高信号消失。通过T1-map相定量测算肿瘤T1弛豫时间(图3),标记组在细胞移植第5天平均T1弛豫时间明显下降,此时标记组与对照组肿瘤平均T1弛豫时间分别为(1 618±90)ms和(1 968±28)ms,差异具有统计学意义(P<0.001)。细胞移植后第10天标记组T1弛豫时间回升至对照组水平。

图2 共轭化合物-1标记的EPCs移植后第5天磁共振成像Fig 2 MR images observed at the 5th day after Conjugate-1 labeled EPCs’transplantation
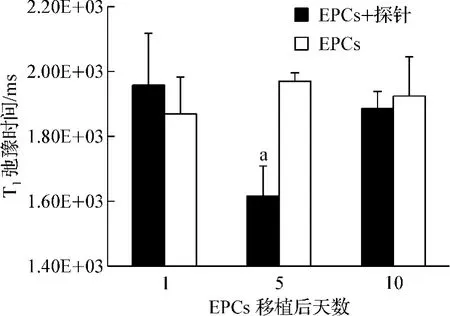
图3 共轭化合物-1标记的EPCs移植后肿瘤T1弛豫时间的改变Fig 3 The variation of intratumoral T1relaxation time after Conjugate-1 labeled EPCs’transplantation
2.5 乳腺癌荷瘤鼠光学成像
标记或未标记的细胞移植后第1、5、10天分别进行活体光学成像。第1天标记组肿瘤部位信号与对照无明显差别(图4A),第5天标记组肿瘤区域出现明显信号增强(图4B),第10天信号减退(图4C)。测量肿瘤部位平均信号强度(图5)显示,移植后第1、5、10天标记组肿瘤平均信号分别为(2.50±0.48)、(9.38±1.83)和(3.41 ±1.65)scaled counts·s-1,第 5 天与对照组相比差异具有统计学意义(P<0.01)。移植后第10天信号虽然明显减弱,但与对照组相比差异有统计学意义(P<0.05)。因此,共轭化合物-1标记的EPCs在乳腺癌荷瘤鼠体内经过一定时间的分布,可以“归巢”至肿瘤部位,从而引起肿瘤信号改变。
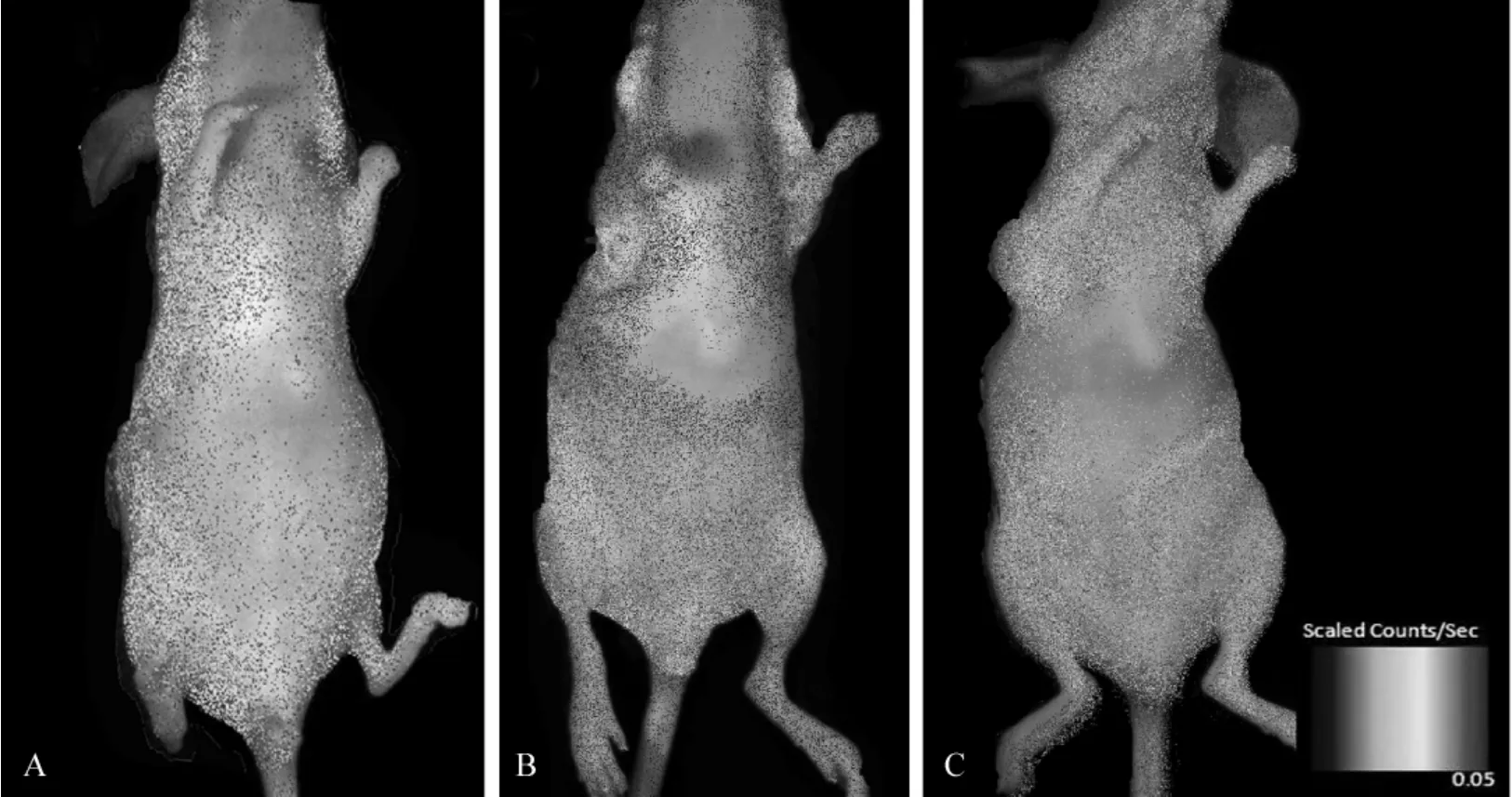
图4 共轭化合物-1标记的EPCs移植后近红外光学成像Fig 4 Near-infrared fluorescent images of tumor bearing mice after Conjugate-1 labeled EPCs’transplantation
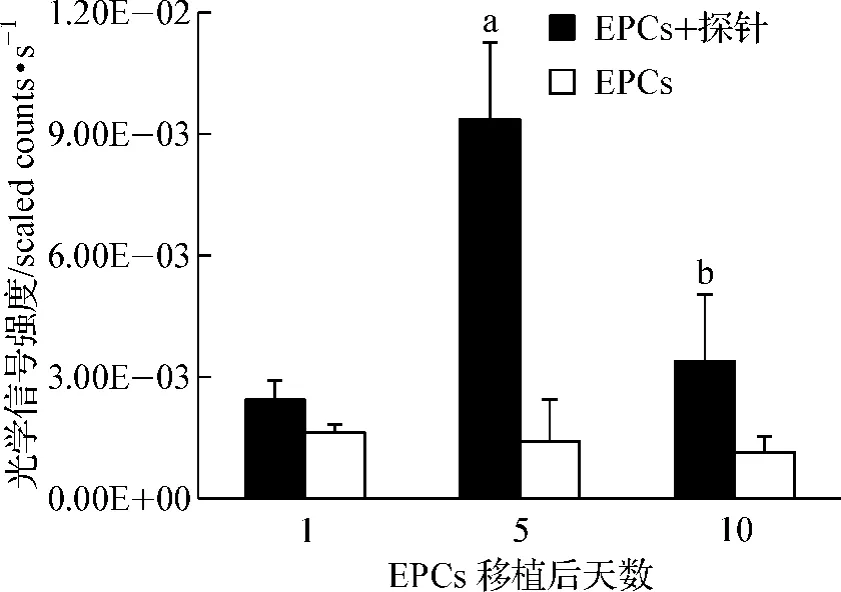
图5 共轭化合物-1标记的EPCs移植后肿瘤平均信号强度的改变Fig 5 The variation of average tumoral intensity after Conjugate-1 labeled EPCs’transplantation
3 讨 论
超顺磁性氧化铁(SPIO)纳米粒子作为磁共振T2/T2*对比剂常被用于移植干细胞的示踪研究[15-17],但是很多的情况下在T2/T2*加权图像上不容易区分标记细胞与其他的低信号区。这些低信号区可以是生理性来源的血红蛋白,也可以是病理来源的血块或手术(外伤后)的气体,所以磁共振成像上的低信号成为提高细胞示踪特异性的主要障碍。此外,这些造影剂在细胞内代谢造成的信号递减[10]和体内非生理性铁聚集引起的细胞毒性[11]也影响了它的使用。因此,取而代之的方法是使用阳性对比剂,如Gd等。Gd类复合物已被成功用于细胞标记和活体成像,并且在T1加权相上能够提供较好的解剖细节[18],但缺点是弛豫率不如氧化铁颗粒。
本实验中采用新方法设计合成的多模态成像探针具有较高T1弛豫率,在T1加权像上表现为正信号。共轭化合物-1在25℃、pH 7.4时通过7.0-T磁共振测量水质子的纵向弛豫率优于临床使用的磁共振对比剂Gd3+-DOTA[13],弥补了Gd类对比剂敏感性较低的缺陷。bCD是一种具有较高稳定性的酶,可以用于肿瘤基因治疗。PLL的生物可降解性和不规则卷曲构象能够促使共轭化合物向间质组织的渗透,因此被用作对比剂的载体。以Gd3+-DOTA、罗丹明及Cy5.5修饰探针可以同时在磁共振和光学成像上动态监测被标记细胞在体内的分布。罗丹明的优势是在细胞或离体组织中进行荧光成像,而Cy5.5更适合活体内成像。本实验设计的多功能探针具有较好生物相容性,因此在医学领域具有更广泛的应用前景。
体外实验中,共轭化合物-1与EPCs共同孵育24 h后,通过MTT与细胞周期检测表明实验组与对照组细胞的活性并没有显著性差异。虽然游离Gd对哺乳动物细胞具有毒性,但是在本实验中使用最高浓度2 μmol·L-1的共轭化合物-1标记细胞时未发现明显毒性作用。细胞对共轭化合物-1吞噬能力的研究也为活体细胞示踪提供了可靠依据。在细胞活体示踪实验中,通过磁共振T1加权像在标记的细胞移植后第5天即可以发现肿瘤边缘高信号的出现,但是由于Gd类复合物弛豫率的限制和磁共振成像敏感性不足,信号改变在图像上并非十分明显。而通过T1-map动态监测肿瘤部位T1弛豫时间随移植时间的改变,发现标记的细胞移植后第5天T1弛豫时间缩短,之后又逐渐恢复,为共轭化合物-1标记的EPCs在肿瘤模型中的“归巢”提供了依据。与此同时,活体近红外光学成像显示标记的细胞移植后第5天肿瘤部位出现明显高信号,信号强度较对照组有显著差异,为EPCs的“归巢”提供了有力证据。随时间推移,由于共轭化合物-1标记的EPCs分裂增殖或对比剂在体内降解导致肿瘤信号在磁共振或光学成像上都呈现下降趋势。
光学成像敏感性强于磁共振,而磁共振成像在显示解剖结构上更具优势。T1加权像中的高信号出现在肿瘤周边表明“归巢”的EPCs主要分布在这一区域,该现象可能与此部位血管新生活跃有关[5]。本实验将EPCs作为多功能成像探针的靶向性载体是因为EPCs可以参与多种血管新生过程,包括肿瘤新生血管形成。标记共轭化合物-1的外源性EPCs进入循环系统后,受到肿瘤组织分泌的诸多促血管生长因子作用,能与自体骨髓源EPCs一同顺浓度梯度到达肿瘤组织,分布在因子高表达区,之后参与血管新生化。虽然这一过程中许多机制尚未明确,但是通过本次的细胞示踪和今后病理水平的深入研究,相信能有更多发现。
本实验设计合成了一种新的多模态成像探针——共轭化合物-1,以EPCs作为靶细胞进行的研究显示其具有低毒性、较高的细胞摄取率并能产生强荧光信号。活体磁共振和光学成像均可证实标记共轭化合物-1的EPCs的“归巢”现象,为此探针用于监测肿瘤生长以及观察抗肿瘤治疗疗效奠定了基础。
[1]HRISTOV M,ERL W,WEBER P C.Endothelial progenitor cells:mobilization,differentiation,and homing[J].Arterioscler Thromb Vasc Biol,2003,23(7):1185-1189.
[2]WERNER N,KOSIOL S,SCHIEGL T,et al.Circulating endothelial progenitor cells and cardiovascular outcomes[J].N Engl J Med,2005,353(10):999-1007.
[3] ASAHARA T,MASUDA H,TAKAHASHI T,et al.Bone marrow origin of endothelial progenitor cells responsible for postnatal vasculogenesis in physiological and pathological neovascularization[J].Circ Res,1999,85(3):221-228.
[4]LYDEN D,HATTORI K,DIAS S,et al.Impaired recruitment of bone-marrow-derived endothelial and hematopoietic precursor cells blocks tumor angiogenesis and growth[J].Nat Med,2001,7(11):1194-1201.
[5]JANIC B,ARBAB A S.The role and therapeutic potential of endothelial progenitor cells in tumor neovascularization[J].Scientific World Journal,2010,10:1088-1099.
[6]GAO D,NOLAN D,MCDONNELL K,et al.Bone marrowderived endothelial progenitor cells contribute to the angiogenic switch in tumor growth and metastatic progression[J].Biochim Biophys Acta,2009,1796(1):33-40.
[7]ARBAB A S,PANDIT S D,ANDERSON S A,et al.Magnetic resonance imaging and confocal microscopy studies of magnetically labeled endothelial progenitor cells trafficking to sites of tumor angiogenesis[J].Stem Cells,2006,24(3):671-678.
[8]KOO V,HAMILTON P W,WILLIAMSON K.Non-invasive in vivo imaging in small animal research[J].Cell Oncol,2006,28(4):127-139.
[9]ACHILEFU S.Lighting up tumors with receptor-specific optical molecular probes[J].Technol Cancer Res Treat,2004,3(4):393-409.
[10]RIVIERE C,BOUDGHENE F P,GAZEAU F,et al.Iron oxide nanoparticle-labeled rat smooth muscle cells:cardiac MR imaging for cell graft monitoring and quantitation[J].Radiology,2005,235(3):959-967.
[11]KOSTURA L,KRAITCHMAN D L,MACKAY A M,et al.Feridex labeling of mesenchymal stem cells inhibits chondrogenesis but not adipogenesis or osteogenesis[J].NMR Biomed,2004,17(7):513-517.
[12]DALDRUP-LINK H E,RUDELIUS M,METZ S,et al.Cell tracking with gadophrin-2:a bifunctional contrast agent for MR imaging,optical imaging,and fluorescence microscopy[J].Eur J Nucl Med Mol Imaging,2004,31(9):1312-1321.
[13]LI C,WINNARD P T Jr,TAKAGI T,et al.Multimodal image-guided enzyme/prodrug cancer therapy[J].J Am Chem Soc,2006,128(47):15072-15073.
[14]MAI X L,MA Z L,SUN J H,et al.Assessments of proliferation capacity and viability of New Zealand rabbit peripheral blood endothelial progenitor cells labeled with superparamagnetic particles[J].Cell Transplant,2009,18(2):171-181.
[15]HILL J M,DICK A J,RAMAN V K,et al.Serial cardiac magnetic resonance imaging of injected mesenchymal stem cells[J].Circulation,2003,108(8):1009-1014.
[16]JU S,TENG G J,LU H,et al.In vivo MR tracking of mesenchymal stem cells in rat liver after intrasplenic transplantation[J].Radiology,2007,245(1):206-215.
[17]SUN J H,TENG G J,JU S H,et al.MR tracking of magnetically labeled mesenchymal stem cells in rat kidneys with acute renal failure[J].Cell Transplant,2008,17(3):279-290.
[18] ANDERSON S A,LEE K K,FRANK J A.Gadoliniumfullerenol as a paramagnetic contrast agent for cellular imaging[J].Invest Radiol,2006,41(3):332-338.
