嗜麦芽窄食单胞菌磺胺类耐药与整合子的相关性研究
2011-06-14杜江东牟肖东闫志勇
杜江东,牟肖东,闫志勇,王 斌*
(1青岛大学,青岛266071;2青岛大学医学院附属烟台毓璜顶医院)
嗜麦芽窄食单胞菌(SMA)广泛存在于自然界,为条件致病菌,由于其致病力低,临床上一直未引起重视。磺胺类药物是治疗SMA有效药物之一,但近年来报道其耐药率不断增加,并与整合子有关。2010年5月~2011年5月,本研究以51株SMA为研究对象,观察了其磺胺耐药基因和整合子的存在情况。现报告如下。
1 材料与方法
1.1 材料 菌株来源:51株SMA分离自烟台毓璜顶住院患者临床标本,其中大于60岁者38例,占74.5%;45例分离自痰标本,占88.2%。标准菌株为大肠埃希菌ATCC25922和铜绿假单胞菌ATCC27853。主要试剂及仪器:VITEK-AMS菌种鉴定系统(法国生物一梅里埃公司)、M-H琼脂(杭州天和生物)、ABl7000 PCR扩增仪(美国ABI)、凝胶成像系统(美国Bio-Rad公司)、琼脂糖(美国Bio-Rad公司)。
1.2 药敏试验 采用M-H琼脂,以K-B法进行抗生素敏感性试验,操作及结果判读严格按照临床实验室标准化协会(CLSI-NCCLS)2010年公布的标准进行判断。
1.3 基因检测 DNA模板的制备:用加热裂解法,将过夜培养的细菌置于60 μl、pH 8.0的TE缓冲液(10 mmol/L Tris.Cl和 1 mmol EDTA)中,配成一定浓度的菌悬液,并振荡混匀。将菌悬液放入97℃水浴中10 min,-20℃放置1 min,12 000 r/min离心5 min后取上清,于-20℃放置备用。
1.4 基因扩增 采用PCR法。根据参考文献[1,2]设计 int1、int2、int3、sulⅠ基因引物。反应体系:反应体积为 50 μl,Premix Taq PCR 反应液 25 μl,基因模板 2 μl,引物各 1 μl,灭菌蒸馏水 21 μl。整合子基因扩增条件:预变性94℃ 5 min;变性94℃ 30 s,退火55℃30 s,延伸72℃ 60 s;再延伸72℃ 2 min。sulⅠ基因扩增条件:预变性94℃ 5 min;变性94℃ 30 s,退火55℃ 30 s,延伸72℃ 60 s;再延伸72℃ 2 min。取扩增产物10 μl与2 μl的6×上样缓冲液混匀,点样于2%琼脂糖凝胶中,以100 V电压电泳30 min,紫外检测仪中观察结果,凝胶成像系统采集图像并保存。以出现与阳性对照分子量相同的目的条带判为阳性。
2 结果
2.1 药敏试验 结果见表1。
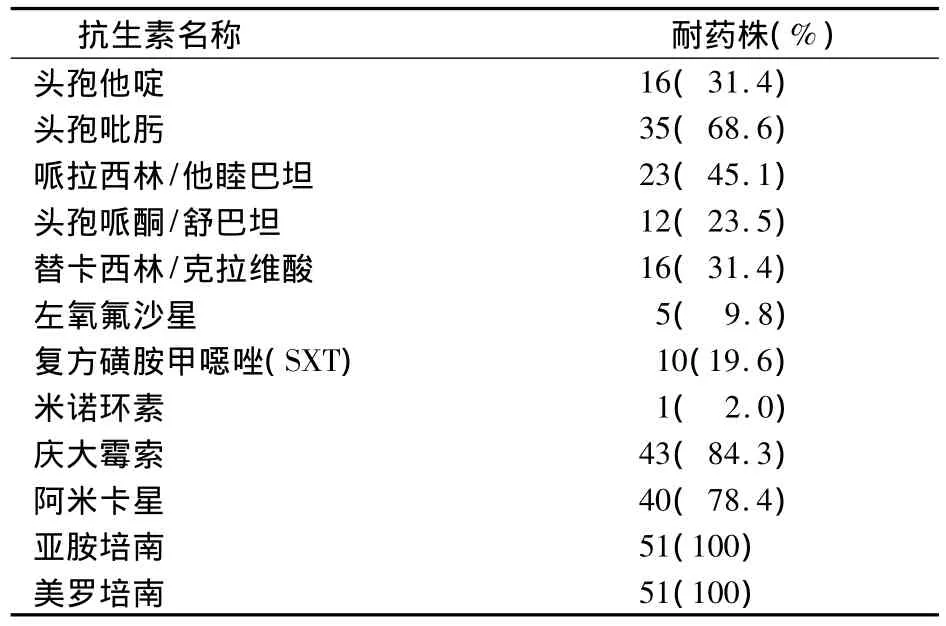
表1 药敏试验结果
2.2 基因检测结果 7株(13.7%)Ⅰ类整合子阳性,没有检测到Ⅱ、Ⅲ类整合子,12株菌(23.5%)sulⅠ阳性。其中有9株耐SXT检测到sulⅠ基因,6株同时检测到intⅠ。3株SXT耐药表型没有检测到sulⅠ基因。
3 讨论
SMA已经成为非发酵菌中占第3位的细菌,由于它的天然多重耐药,使得临床治疗相当困难,治疗其感染首选药物为复方磺胺,但是近几年其对磺胺耐药呈上升趋势,耐药机制的研究也成为热点。
sulⅠ基因为二氢叶酸合成酶的编码基因,阳性提示细菌对磺胺类药物耐受,Barbolla等[3]研究31株SMA,3株表现为对SXT最低抑菌浓度高,经特异引物扩增出sulⅠ基因,同时还检测到intⅠ基因。Toleman等[4]收集103株临床分离的SMA,25%的菌株经琼脂稀释法检测到是耐SXT的,26株耐SXT SMA中21株含有 sulⅠ基因,81%存在Ⅰ类整合子上。Correia等[5]对55株SMA研究发现,25株耐SXT的菌株中,17株携带sulⅠ基因,而SXT敏感的菌株中没有sulⅠ基因。以上研究表明sulⅠ基因是SMA对SXT耐药的主要基因,sulⅠ与Ⅰ类整合子关系密切。
整合子—基因盒系统属于可移动基因元件,可位于细菌的染色体上,也可借助于移动的质粒、转座子在同种或不同种细菌之间水平传播,对细菌耐药性的传播产生作用。整合子根据整合酶基因的不同分类,迄今已发现10类整合子,在临床菌株中常见的为Ⅰ、Ⅱ、Ⅲ类整合子,其中尤以Ⅰ类整合子最常见。虽然目前Ⅰ类整合子在SMA中的携带率不高,但是整合子机制参与了多重耐药的水平传播,因其高效性,应引起足够的重视,可采取积极有效的措施控制耐药基因的水平转移。
本实验中,sulⅠ基因阳性12株,其中9株表现为SMZ耐药表型符合率75%,1株SXT耐药sulⅠ基因阴性可能与其他耐药机制如泵蛋白、膜通透性等有关。6株SXT耐药同时检测到sulⅠ基因与intⅠ基因,表明SXT耐药与Ⅰ类整合子存在相关,Ⅰ类整合子作为细菌耐药传播的重要机制可能将使磺胺类药物的应用受到一定限制。
[1]周月清,陆开来.鲍氏不动杆菌耐消毒剂——磺胺基因、Ⅰ类整合酶基因及氨基糖苷类修饰酶基因研究[J].中华医院感染学杂志,2005,15(7):728-73l.
[2]黄支密,糜祖煌,石晓霞,等.医院感染革兰阴性杆菌耐消毒剂基因研究[J].中华医院感染学杂志,2005,15(7):721-724.
[3]Barbolla R,Catalano M,Orman BE,et al.ClassⅠ integron increase trimethoprim-sulfamethoxazole MIC,againstepidemiologically unrelated stenotrophomonas maltophiliaisolates[J].Antimicrob A-gent Chemother,2004,48(2):666.
[4]Toleman MA,Bennett PM,Bennett DM,et al.Global emergence of trimethoprim sulfamethoxazole resistance in Stenotrophomonasmaltophilia mediated by acquisition of sul genes[J].Emerg Infect Dis,2007,13(2):559-659.
[5]Correia M,Boavida F,Grosso F,et al.Molecular characterization of a new class 3 integron in Klebsiella pneumoniae[J].Antimicrob Agents Chemother,2003,47(9):2838-2843.
