七氟醚预处理大鼠肾缺血再灌注损伤中NF-κB 表达、NOS活性变化及意义
2011-06-14顾福萍何焕钟顾栋桦徐伯赢
顾福萍,何焕钟,顾栋桦,徐伯赢,沈 洪
(1浙江湖州师范学院医学院,浙江湖州313000;2湖州市中心医院)
肾缺血再灌注是临床中常见的致损伤过程,存在于失血、脱水、感染等原因所致休克、血管梗阻、肾移植等过程中,可导致急性肾损伤。NF-κB作为一种广泛存在的诱导性核转录因子,其在缺血再灌注损伤中的作用是近年来缺血再灌注损伤机制研究的重要进展[1]。活化的 NF-κB可启动和调节众多与免疫和炎症反应有关的细胞因子及粘附分子等炎性介质的基因表达;而抑制NF-κB的表达,则可降低炎性介质的转录,对再灌注损伤的组织产生保护作用[2]。七氟醚是一种吸入麻醉药,已证实其对缺血再灌注心、脑、肾均有较好的保护作用[3~5]。2010年6月,我们观察了七氟醚预处理对肾缺血再灌注大鼠肾组织NF-κB表达和一氧化氮合酶(NOS)活性的影响,旨在探讨七氟醚对肾缺血再灌注损伤的保护作用及机制。
1 材料与方法
1.1 材料 成年健康SD雄性大鼠72只,体质量(200±20)g,购自浙江省医学科学院;肌酐(Cr)、尿素氮(BUN)、NOS试剂盒均购自江苏南京建成生物工程研究所;NF-κB p65抗体购自武汉博士德有限公司。
1.2 模型建立及干预 将72只大鼠随机分为假手术组(对照组)、模型组和七氟醚组各24只。后两组参考 Basile 等[6]方法制作肾缺血再灌注损伤模型。七氟醚组制模前1 h吸入七氟醚:大鼠置于自制的有机玻璃麻醉箱内,通过麻醉气体挥发罐输入O2和七氟醚的混合气体,用麻醉气体监测仪持续测定药物浓度,使实验舱七氟醚浓度维持在2.2%。
1.3 观察项目 制模后4、12、24 h各组分别处死大鼠8只,行以下项目观察。①血清BUN和Cr水平:眼眶取血,采用生化分析仪常规方法测定。②肾组织病理学变化:取左肾纵切用10%中性甲醛固定,常规乙醇脱水,石蜡包埋后切片行苏木精—伊红(HE)染色,光学显微镜观察。③肾组织NF-κB表达:取上述石蜡切片,常规二甲苯脱腊,梯度乙醇入水后,免疫组化法检测。NF-κB阳性表达为棕黄色颗粒,定位于细胞核。于10×40倍光镜下随机选取10个视野计数阳性细胞,用图像采集系统将图像输入计算机并进行人工分析,取平均值。④肾组织NOS活性:取右肾组织于冰生理盐水中漂洗、滤纸拭干、称重后用0.86%冷生理盐水制备10%组织匀浆,根据试剂盒说明检测总NOS(TNOS)及诱生型NOS(iNOS)、原生型NOS(cNOS)活性。
1.4 统计学方法 应用SPSS16.0软件进行统计学处理,计量数据以±s表示,多组比较采用单因素方差分析(ANOVA),组内两两比较采用LSD法。P≤0.05为差异有统计学意义。
2 结果
2.1 血清BUN及Cr水平 各组血清BUN及Cr水平见表1。
2.2 肾组织病理学变化 对照组肾单位结构未见明显异常;模型组早期肾小球及肾间质血管扩张充血,肾小管上皮细胞发生水肿,部分肾小管管腔变窄,少数管腔可见管型,间质有极少量炎性细胞浸润,随再灌注时间延长,损伤加重,24 h时低倍镜下可见皮质区变性广泛,肾小管管腔可见管型,高倍镜下见部分肾小球出现变性坏死,肾小管变性坏死广泛,出现核固缩、溶解、消失,肾小管上皮细胞坏死脱落,变性坏死区有炎性细胞浸润。七氟醚组病理变化较模型组明显减轻,肾脏外观与对照组接近,光镜下可见肾小球扩张充血、局部肾间质充血,但较模型组明显减轻,无明显炎细胞浸润,局部肾小管未出现管型、轻度水样变性。
表1 各组血清BUN及Cr水平比较(n=8,±s)
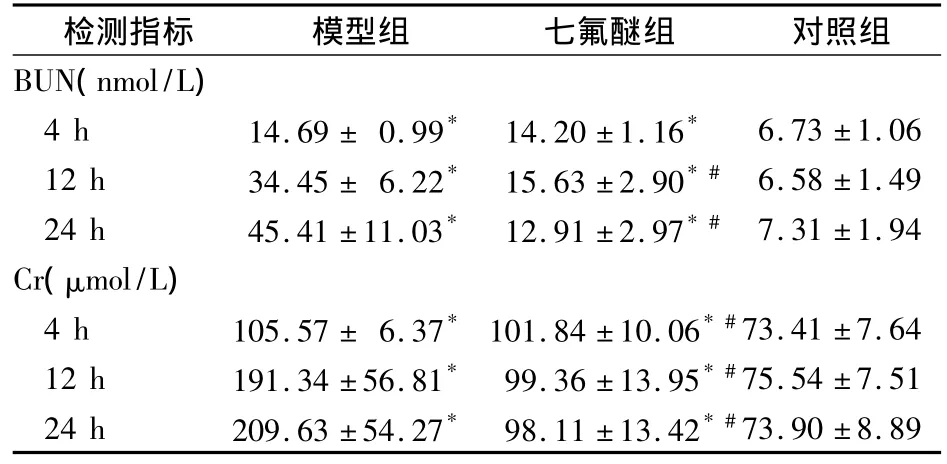
表1 各组血清BUN及Cr水平比较(n=8,±s)
注:与对照组比较,*P <0.05;与模型组同时相比较,#P <0.05
检测指标 模型组 七氟醚组 对照组BUN(nmol/L)4 h 14.69 ± 0.99* 14.20 ±1.16* 6.73 ±1.06 12 h 34.45 ± 6.22* 15.63 ±2.90*# 6.58 ±1.49 24 h 45.41 ±11.03* 12.91 ±2.97*# 7.31 ±1.94 Cr(μmol/L)4 h 105.57 ± 6.37* 101.84 ±10.06*#73.41 ±7.64 12 h 191.34 ±56.81* 99.36 ±13.95*#75.54 ±7.51 24 h 209.63 ±54.27* 98.11 ±13.42*#73.90 ±8.89
2.3 肾组织NF-κB表达 NF-κB表达均定位于肾小管上皮细胞,肾小球中未见表达。对照组NF-κB几乎不表达;各组NF-κB表达情况见表2。
表2 各组肾组织NF-κB表达比较(n=8,阳性细胞数,±s)

表2 各组肾组织NF-κB表达比较(n=8,阳性细胞数,±s)
注:与对照组比较,*P <0.05;与模型组同时间比较,#P <0.05
4 h 12 h 24 h模型组 79.65 ±17.17* 97.62 ±21.21* 108.81 ±15.22组别*七氟醚组 26.09 ± 6.87*# 20.62 ± 7.74*# 28.58 ± 7.43*#对照组1.85 ± 1.12 1.69 ± 1.09 1.74 ± 1.23
2.4 肾组织NOS活性 各组肾组织NOS活性比较见表3。
表3 各组肾组织NOS活性比较(n=24,U/mg prot,±s)
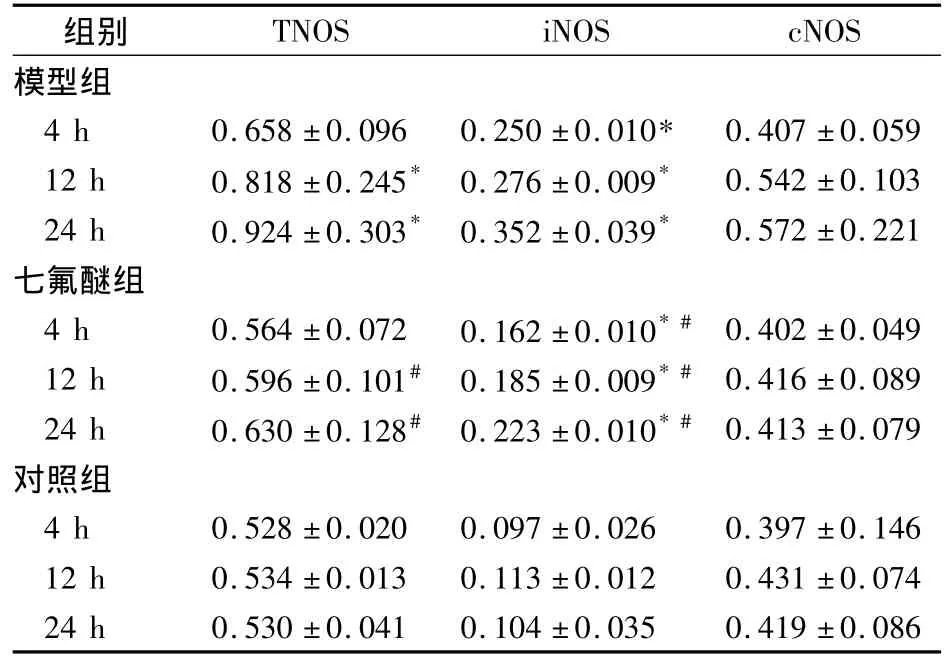
表3 各组肾组织NOS活性比较(n=24,U/mg prot,±s)
注:与对照组比较,*P <0.05;与模型组同时相比较,#P <0.05
组别TNOS iNOS cNOS模型组4 h 0.658 ±0.096 0.250 ±0.010* 0.407 ±0.059 12 h 0.818 ±0.245* 0.276 ±0.009* 0.542 ±0.103 24 h 0.924 ±0.303* 0.352 ±0.039* 0.572 ±0.221七氟醚组4 h 0.564 ±0.072 0.162 ±0.010*# 0.402 ±0.049 12 h 0.596 ±0.101# 0.185 ±0.009*# 0.416 ±0.089 24 h 0.630 ±0.128# 0.223 ±0.010*# 0.413 ±0.079对照组4 h 0.528 ±0.020 0.097 ±0.026 0.397 ±0.146 12 h 0.534 ±0.013 0.113 ±0.012 0.431 ±0.074 24 h 0.530 ±0.041 0.104 ±0.035 0.419 ±0.086
3 讨论
NF-κB是一种多功能核转录因子,正常情况下NF-κB 与 κB 抑制蛋白(I-κB)结合成无活形式存在于细胞质中,当其受氧自由基、内毒素、细胞因子等的刺激后被激活导致NF-κB快速从胞质移位进入细胞核内,结合在被诱导基因启动子上特异的κB位点,调控相应的靶基因表达。近年来研究发现,NF-κB信号系统参与了缺血再灌注损伤过程;抑制NF-κB活性可降低炎性介质的转录,减轻中性粒细胞的聚集,从而对再灌注损伤的组织产生保护作用[2]。七氟醚是一种挥发性麻醉药,研究发现其可通过抑制心肌细胞NF-κB活化、减少TNF-α产生减轻大鼠离体心肌缺血再灌注损伤[7]。Thomas等[8]发现,异氟醚、七氟醚、地氟醚等吸入麻醉药可减轻肾脏缺血再灌注损伤,其作用机制与抑制炎症转录因子NF-κB的结合活性有关。Lee等[9]在大鼠肾脏缺血再灌注模型研究发现,七氟醚预处理能保护肾小球滤过功能。
肾缺血再灌注损伤的机制十分复杂,涉及氧自由基产生、钙超载、中性粒细胞浸润、细胞凋亡,以及血管内皮损伤等多种病理生理过程,其中有众多炎性介质和免疫因子的参与[10,11]。肾脏缺血再灌注时产生大量过氧化物和超氧自由基,激活NF-κB信号转导通路,引起细胞因子、黏附分子以及炎症反应酶类(如iNOS)等物质过度表达,参与肾缺血再灌注损伤的发生发展。NOS是催化合成内源性一氧化氮的酶,目前已知NOS有两类同工酶:原生型(constitutive NOS,cNOS)和诱生型(inducible NOS,iNOS)。NO在肾脏中的作用有直接和间接两种,直接作用即对肾脏的保护作用,间接作用即NO的毒性作用,前者由 cNOS介导,而后者由 iNOS介导[12]。有研究显示[13],再灌注后肾实质中两种NOS mRNA表达均较缺血时显著上调,且以iNOS最为明显。iNOS的过表达会催化产生高浓度NO,直接造成细胞损伤,使肾功能进一步受损。本研究结果显示模型组肾组织NF-κB表达明显增加,随再灌注时间的延长进行性增加,iNOS活性也显著增强。肾功能指标BUN、Cr呈进行性升高,光镜下观察肾组织形态学结构发生不同程度的病理变化,肾小球毛细血管明显扩张充血,肾间质充血、炎性细胞浸润,肾小管管腔可见管型,肾小管上皮细胞变性坏死,出现核固缩、溶解、消失,以24 h受损最为严重。七氟醚预处理组NF-κB的表达、iNOS的活性显著低于模型组;BUN、Cr均明显低于同时相的模型组;光镜下观察肾组织结构受损程度较模型组明显减轻。证实七氟醚预处理可减弱NF-κB活化、降低炎性介质表达,减轻肾缺血再灌注损伤。
本研究结果提示NF-κB是肾缺血再灌注损伤的重要调控因子,抑制NF-κB信号转导通路可能是七氟醚预处理减轻肾缺血再灌注损伤的作用机制。
[1]Rodriguez-Peña A,Garcia-Criado FJ,Eleno N,et al.Intrarenal administration of a molecule releasing nitric oxide,reduces renal ischemia-reperfusion injury in rats[J].American Journal of Transplantation,2004,4(10):1605-1613.
[2]Souza DG,Teixeira MM.The balance between the production of tumor necrosis factor-α and interleukin-10 determines tissue injury and lethality during intestinal ischemia and reperfusion[J].Mem Inst Oswaldo Cruz,2005,100(Suppl,1):59-66.
[3]张厚忠,李红霞,王汉中.七氟醚和缺血预处理对大鼠血清MDA和肝脏组织HSP70表达的影响[J].中国老年学杂志,2008,28(16):1586-1587.
[4]李爱芝,马加海,丁永波,等.七氟醚对大鼠急性肾缺血-再灌注损伤的保护作用[J].临床麻醉学杂志,2008,24(8):690-692.
[5]储晓英,薛庆生,于布为.七氟醚对大鼠局灶性脑缺血再灌注损伤的保护作用[J].中华麻醉学杂志,2006,26(1):65-67.
[6]Basile DP,Donohoe D,Cao X,et al.Resistance to ischemic acute renal failure in the Brown Norway rat:a new model to study cytoprotection [J].Kidney Int,2004,65(6):2201-2211.
[7]Zhong C,Zhou Y,Liu H.Nuclear factor kB and anesthetic preconditioning during myocardial ischemia-reperfusion[J].Anesthesiology,2004,100(3):540-546.
[8]曾因明,邓小明.2007麻醉学新进展,北京:人民卫生出版社,2007:34.
[9]Lee HT,Hua Xu,Charles W.Sevoflurane protects against renal ischemic reperfusion injury in rats[J].Anesthesiology,2002,96(2):A411-A414.
[10]Rah DK,Han DW,Baek HS,et al.Protection of rabbit kidney from ischemia/reperfusion injury by green tea polyphenol pretreatment[J].Arch Pharm Res,2007,30(11):1447-1454.
[11]Bojakowski K,Gaciong Z,Grochowiecki T,et al.Carbon monoxide may reduce ischemia reperfusion injury:a case report of complicated kidney transplantation from a carbon monoxide poisoned donor[J].Transplant Proc,2007,39(9):2928-2929.
[12]Anaya-Prado R,Toledo-Pereyra LH.The molecular events underlying ischemia/reperfusion injury[J].Transplant Proc,2002,34(7):2518-2519.
[13]Kin S,Sasaki T,Gu K,et al.The cytoprotective role of nitric oxide in ischemia-reperfusion injury in the rat kidney[J].Transplant Proc,1995,27(1):754-756.
