天然药物 IHA-01筛选敏感肿瘤细胞株及其对结肠癌细胞增殖的影响
2011-06-14李秋恬李少遊缪延栋耿计伟尹燕鹰
李秋恬,洪 敏,陈 晓,李少遊,缪延栋,耿计伟,李 臣,尹燕鹰,董 坚
(昆明医学院第一附属医院,昆明650032)
IHA-01(代号)是从云南传统药用植物水朝阳旋覆花中提取、精制的天然药物,主要含半萜类抗肿瘤活性成份。2009年8月~2010年12月,我们对IHA-01的敏感细胞株进行了筛选,并对其诱导敏感细胞株凋亡的作用进行了观察,旨在为IHA-01作为抗肿瘤药物的开发和应用提供依据。
1 材料与方法
1.1 材料 IHA-01(本课题组委托中科院昆明植物所提取,相对分子质量为306)。细胞株:人乳腺癌细胞株MDA-MB-231、MDA-MB-435,人肠癌细胞株 HCT-8、HT29、LS-174T,人肺癌细胞株 Calu-1,人肝癌细胞株 SMMC-7721,人鼻咽癌细胞株CNE-2,人胆管癌细胞株 QBC-939,人神经胶质瘤细胞株U251(均购于上海细胞生物研究所细胞库,本室保存);人个旧肺癌细胞株GLC、YTLC(本实验室传代培养)。FACS Calibur流式细胞仪(美国 B-D公司)。
1.2 敏感细胞株筛选
1.2.1 细胞培养及干预 分别选取对数生长期的上述12种肿瘤细胞接种于96孔板,贴壁培养24 h;均分为两组。实验组加入IHA-01,终浓度分别为3.125、6.25、12.5、25 和 50 μg/ml,每个浓度设 5 个复孔;对照组加入等体积不含药物的培养基,96孔板置于温箱中培养48 h。
1.2.2 观察项目及判定标准 CCK-8法测定各组细胞增殖抑制率:试剂作用后采用酶标仪测定波长450 nm、650 nm处各孔吸光度值(A值),细胞增殖抑制率=[1-(A加药组-A空白组)/(A阴性对照组-A空白组)]×100%。用线性回归方法计算半数抑制浓度(IC50)。IC50值最低者为敏感细胞株,IC50值最高者为不敏感细胞株;细胞增殖抑制率最高的作用浓度为最佳作用浓度。
1.2.3 筛选结果 IHA-01对12株肿瘤细胞均有不同程度的抑制杀伤作用,细胞增殖抑制率随IHA-01浓度增加而升高;最佳作用浓度为1.29 μg/ml。MDA-MB-231、MDA-MB-435、HCT-8、HT29、LS-174T、GLC、YTLC、Calu-1、SMMC-7721、CNE-2、QBC-939 和 U251的 IC50值分别为(4.81 ±1.13)、(5.07±2.73)、(1.29 ± 0.35)、(4.77 ± 0.37)、(5.12 ±1.26)、(6.09 ± 1.68)、(7.23 ± 2.57)、(5.33 ±0.82)、(7.67 ± 1.66)、(7.94 ± 1.84)、(6.09 ±1.44)和(7.4 ±0.73)μg/ml,最低及最高 IC50值分别为HCT-8及CNE-2细胞。确定HCT-8为IHA-01敏感株,CNE-2为不敏感株。
1.3 IHA-01干预敏感细胞株及相关指标检测
1.3.1 IHA-01干预及细胞形态观察 取1.29 μg/ml的IHA-01分别作用于HCT-8细胞及CNE-2细胞,48 h后光镜下观察细胞形态变化。
1.2 IHA-01干预及细胞凋亡率检测 取对数生长期HCT-8细胞接种于25cm2培养瓶中并分为两组。实验组加入 IHA-01,使其终浓度为 1.29 μg/ml;对照组加入同体积PBS。药物作用24 h后收集细胞1×106个,PBS重悬于EP管中,缓慢加入70%的冰乙醇1 ml,4℃固定1 h,采用Annexin V/7-AAD染色,结果以Annexin V标记阳性,7-AAD标记阴性,流式细胞仪检测细胞凋亡率。
1.3 IHA-01干预及细胞端粒酶活性检测 取1.29、6.25、12.5、25 和 50 μg/ml浓度的 IHA-01 分别作用于HCT-8细胞(实验组),24 h后收集2×105个细胞采用PCR-ELISA法行端粒酶活性检测,按试剂盒说明书操作。对照组为未加入药物HCT-8细胞。实验重复3次,酶标仪测定450~690 nm处的光密度值(A值)。
1.4 统计学方法 采用 SPSS12.0软件包行统计学处理。计量数据以±s表示,采用方差分析和t检验,P≤0.05为差异有统计学意义。
2 结果
2.1 细胞形态 IHA-01作用后HCT-8细胞数量减少,细胞形态由不规则形变为圆形,胞体皱缩,贴壁能力降低,细胞质密度增加,细胞膜完整;CNE-2细胞仅有部分失去原有形态、胞体皱缩。
2.2 细胞凋亡率 1.29 μg/ml IHA-01作用24 h后,实验组及对照组 HCT-8细胞凋亡率分别为62.3%、11.3%,P <0.01。
2.3 细胞端粒酶活性 两组端粒酶活性比较见表1。由表1可见,不同浓度IHA-01均可抑制端粒酶活性,且呈浓度依赖性。
表1 不同浓度IHA-01作用24 h HCT-8细胞端粒酶活性(n=3,±s)
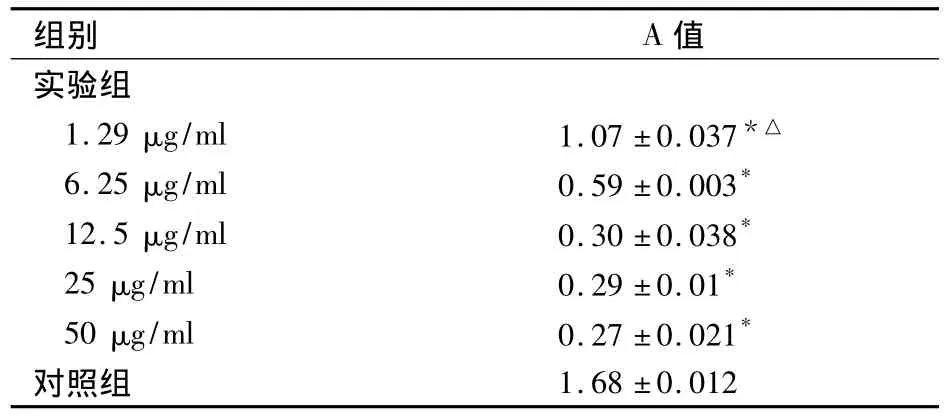
表1 不同浓度IHA-01作用24 h HCT-8细胞端粒酶活性(n=3,±s)
注:与对照组比较,*P<0.01;与实验组其他浓度比较,△P均<0.01
组别 A值1.68 ±0.012实验组1.29 μg/ml 1.07 ±0.037*△6.25 μg/ml 0.59 ±0.003*12.5 μg/ml 0.30 ±0.038*25 μg/ml 0.29 ±0.01*50 μg/ml 0.27 ±0.021*对照组
3 讨论
从天然植物中开发生物活性成分,寻找高效低毒的抗癌新药一直是研究的热点。天然植物产物具有结构独特,生物活性广泛,不易耐药等优点[1],是抗癌活性成分的重要来源。目前临床上常用的抗癌药物,如抑制拓扑异构酶Ⅰ的喜树碱、以抗微管蛋白活性为靶点的紫杉醇和长春新碱等均为从植物中分离筛选、结构改造及化学合成的。IHA-01是从天然植物水朝阳旋覆花中提取、精制而成。水朝阳旋覆花为菊科植物旋覆花属,为多年生草本植物,载于《滇南本草》[2],主治乳岩、乳痈、红肿疼痛、暴赤火眼、目疾疼痛、祛风明目、隐涩羞明伯日,伤风寒热咳嗽。
近年来越来越多的证据表明,肿瘤细胞的发生和转移与细胞程序性死亡有关,部分源自天然植物的化疗药和细胞毒制剂是通过诱导肿瘤细胞的凋亡而起治疗作用的[3~5];化疗药物抗肿瘤治疗的部分机制与诱导细胞凋亡有关[6]。本研究结果显示,IHA-01对12种肿瘤细胞均有诱导凋亡的作用,尤其是对HCT-8细胞。关于药物诱导细胞凋亡的机制,有学者认为与Caspase-9、Caspase-3蛋白酶激活及Survivin蛋白表达下降有关[7],也有学者认为与抑制NF-κB的活性有关[8]。本研究未作上述相关指标检测,有待下一步研究。
端粒酶是一种维持染色体结构和功能稳定的核糖核蛋白,其激活与癌细胞增殖、凋亡和侵袭及肿瘤恶性程度关系密切[9]。研究表明紫杉醇和拓扑替康等植物类抗肿瘤药物的抗瘤作用与影响端粒酶活性有关[10,11],故抑制端粒酶活性可能成为肿瘤治疗的新策略[12~14]。有文献报道端粒酶与细胞凋亡有一定的相关性,端粒酶活性高者细胞凋亡少,反之则凋亡增加[15]。研究证实,植物来源的化疗药物喜树碱在诱导肿瘤细胞凋亡的同时,端粒酶活性亦相应下降[16]。本研究结果显示,IHA-01可明显降低HCT-8细胞的端粒酶活性,且与药物浓度呈正相关。
综上所述,HCT-8细胞为IHA-01的敏感细胞株。IHA-01可明显抑制HCT-8增殖,其机制可能为诱导肿瘤细胞凋亡、降低肿瘤细胞端粒酶活性。本研究为IHA-01的临床应用提供了实验基础和理论依据。
[1]陈聪颖,陆阳,陈泽乃.天然产物在抗癌药物发现和开发中的作用[J].中草药,1999,4(6):144-147.
[2]云南省地方志编纂委员会.云南省志七十卷医药志[M].昆明:云南人民出版社,1995:803.
[3]Choi JH,Ha J,Park JH,et al.Costunolide triggers apoptosis in human leukemia U937 cells by depleting intracellular thiols[J].Jpn J Cancer Res,2002,93(12):1327-1333.
[4]Gurova KV,Gudkov AV.Paradoxical role of apoptosis in tumor progression[J].Cell Biochem,2003,88(1):128-137.
[5]Lowe SW,Lin AW.Apoptosis in cancer[J].Carcinogenesis,2000,21(3):485-495.
[6]汤睿,朱正纲.凋亡途径与肿瘤治疗[J].世界华人消化杂志,2005,13(20):2469-2472.
[7]Tyagi AK,Agarwal C,Singh RP,et al.Silibinin down-regulates surviving protein and mRNA expression and causes caspases activation and apoptosis in human bladder transitional-cell pap illomaRT4 cells[J].Biochem Biophys Res Commun,2003,312(4):1178.
[8]Dhanalakshmi S,Singh RP,Agarwal C,et al.Silibinin inhibits constitutive activation and TNF alpha-induced activation of NF-kappaB and sensitizes human prostate carcinoma DU145 cells to TNF alpha-induced apoptosis[J].Oncogene,2002,21(11):1759.
[9]Folini M,Gandellini P,Zaffaroni N.Targeting the telosome.Therapeutie implications[J].Biochim Biophys Acta,2009,1792(4):309-316.
[10]庞荣清,张步振,陈宏等.紫杉醇对乳腺癌MCF-7细胞端粒酶、凋亡及p53/bcl-2表达影响的研究[J].中国普通外科杂志,2002,17(10):614-615.
[11]沈杨,任慕兰,蔡云朗,等.拓扑替康对人卵巢癌细胞株端粒酶活性表达的影响[J].东南大学学报(医学版),2005,24(2):78-81.
[12]Xie XY,Yang X,Zhang JH,et al.Analysis of hTERT expression in exfoliated cells from patients with bladder transitional cell carcinomas using SYBR green real-time fluorescence quantitative PCR[J].Ann Clin Biochem,2007,44(6):523-528.
[13]Spangler EA,Rogers KS,Thomas JS,et al.Telomerase enzyme activity as a diagnostic tool to distinguish effusions of malignant and benign origin[J].J Vet Intern Med,2000,14(2):146-150.
[14]Takihana Y,Tsuchida T,FukasawaM,et al.Real-time quantitative analysis for human telomerase reverse transcriptase mRNA and human telomerase RNA component mRNA expressions as markers for clinicopathologic parameters in urinary bladder cancer[J].Int J Urol,2006,13(4):401-405.
[15]秦自科,梅骅,戴宇平,等.膀胱肿瘤端粒酶活性及细胞凋亡的研究[J].中华外科杂志,2000,38(9):697-699.
[16]Liu JL,Ge LY,Zhang GN,et al.Telomerase activity and human telomerase reverse transcriptase expression in colorectal carcinoma[J].World J Gastroenterol,2006,12(3):465-467.
