骨髓间充质干细胞促进兔预构皮瓣成活的实验研究
2011-06-14丁志邓辰亮郑江红万伟东茅广宇杨松林
丁志 邓辰亮 郑江红 万伟东 茅广宇 杨松林
随着再生医学的兴起,细胞治疗得到不断发展,干细胞因具有多向分化潜能和自我复制能力而备受关注。其中,间充质干细胞因来源广泛,分离培养容易,增殖和多向分化能力强,已成为干细胞治疗领域的研究热点,被广泛报道应用于各种病损的组织器官。近年来的诸多研究发现,骨髓间充质干细胞(BMSC)除能分化为多种参与血管形成的细胞外,还能分泌 VEGF、IGF、EGF、KGF、TGF、SDF1 等多种促进血管生成的细胞因子[1-2],促进血管再生、改善局部血供,已用于治疗心肌缺血、缺血皮瓣的成活等[3-5]。而预构皮瓣成功的关键也是血管再生,因此用间充质干细胞来促进预构皮瓣的成活应是可行的。因此,本研究在将兔股动静脉血管束植入其腹部皮下的同时,向血管束周围注射BMSC悬液,通过观察其分化作用和旁分泌作用,以及对预构皮瓣成活的影响,探讨BMSC促进预构皮瓣存活的可能性。
1 材料与方法
1.1 材料
DMEM-F12培养基、胎牛血清(Gibco公司,美国);兔抗人VEGF单克隆抗体、FITC标记的BrdU特异性单克隆抗体(Roche公司,瑞典);耐光性菁染料cyb3标记的vWF多克隆抗体 (Santa Cruz公司,加拿大);小鼠抗兔-CD45-FITC、小鼠抗兔-CD90-FITC(Caltage 公司,美国);小鼠抗兔-CD34-FITC、小鼠抗兔-CD45-FITC(Santa Cruz公司,加拿大);BrdU(溴脱氧尿嘧啶)、CFDA-SE(羧基荧光素二醋酸盐琥珀酰亚胺酯)(友谊中联生物科技公司,中国);山羊抗兔罗丹明 (武汉博士德公司,中国);PVDF膜 (Millipore公司,美国);ECL发光试剂盒(Thermo 公司,美国);流式细胞仪(Becton Dickinson公司,美国);电泳仪 EPS-300(天能,中国);16 只健康雄性新西兰大白兔(上海生旺实验养殖场,中国)。
1.2 方法
1.2.1 BMSC的分离培养
体质量约3 Kg的健康新西兰大白兔,麻醉状态下用骨髓穿刺针抽取左侧髂骨骨髓,置入15 mL离心管中,1 000 r/min离心10 min,弃上清,用移液枪吸取含15%小牛血清的DMEM培养液至离心管,反复吹打使之充分混合,接种于25 mL细胞培养瓶,置入37℃、饱和湿度、5%CO2培养箱中培养。24 h后更换培养液,除去未贴壁的细胞,倒置相差显微镜观察细胞生长情况。之后每3天更换培养液,待细胞达到90%融合后,0.25%胰蛋白酶37℃消化1 min,培养液中止胰酶消化,按1∶3传代;同前法换液,至10~12 d细胞90%融合时,按1∶3的比例再次进行传代接种培养;传代培养过程中每3天换液一次,直至贴壁细胞彼此融合,铺满整个培养瓶的底面,重复以上操作。
1.2.2 BMSC的鉴定
取培养至第3代的贴壁细胞,0.25%的胰酶消化法收集细胞,分别取1×106个细胞与抗CD34、CD45、CD29、CD90 抗体(效价均为 1∶50)室温孵育30~40 min,0.1 mol/L PBS洗涤 2次,滴加 FITC 标记的二抗,避光孵育30 min,0.1 mol/L PBS洗涤2次后悬浮,采用流式细胞仪分析。
1.2.3 BMSC的体外BrdU和CFDA-SE标记
取第3代BMSC,移植前48 h对细胞进行换液,用含1%FBS的DMEM完全培养基培养细胞24 h,培养瓶中加入5 μmol/L的BrdU,37℃孵育24 h,离心法收集细胞,PBS重悬细胞。加入等体积的10 μmol/L CFDA-SE,于37℃孵育10 min,用完全培养基离心洗涤细胞2次,放入培养箱中培养24 h,荧光显微镜下观察标记情况。
1.2.4 预构皮瓣模型制备
16只健康雄性新西兰大白兔共构建32个预构皮瓣,每只实验兔的腹部两侧各构建一个股动静脉血管束预构腹部皮瓣,分别为实验组(n=16)和对照组(n=16)。3%戊巴比妥钠自耳缘静脉内注射麻醉,实验兔腹部两侧各标记4 cm×2 cm矩形预构区,短边平行于腹股沟韧带,自尾侧短边中点向后纵向切开后肢皮肤,显微镜下剥离出长约4 cm的股动静血管束,远端结扎切断。在两侧预构区域的中轴线上,于真皮与肉膜层间各制作一皮下隧道,向实验组每个隧道壁分4个点经皮注射浓度为5×106cells/mL的BMSC悬液,每点注射0.05 mL,同法向对照组隧道壁注射等量的生理盐水。将已剥离好的股血管束翻转置入相应的皮下隧道。所有预构区域均在术后2周沿原标记线切开皮肤,于肉膜层下剥离形成由植入的股血管束为轴心血管的岛状皮瓣(图1)。
1.2.5 BMSC移植后的追踪观察
构建预构皮瓣模型术后1周,从两组中各随机选取1个预构区域切下行冰冻切片,丙酮固定,荧光显微镜下观察标记有CFDA-SE的BMSC,观察绿色荧光的量,以反映BMSC的增殖和分布情况。
1.2.6 预构皮瓣VEGF的Western Blot半定量分析
从两组中分别随机选取3个预构岛状皮瓣,共6个皮瓣样本置于干冰上,每样本切取大约200 mg组织,加入1 mL 4℃预冷的T-PER(Tissue Protein Extraction Reagent)组织裂解液,使用电动匀浆器进行组织匀浆,4℃条件下10 000 g离心5 min,收集上清液,使用BCA蛋白定量试剂盒进行总蛋白浓度检测。调整蛋白浓度至10 μg/μL,-20℃保存。制胶(12%分离胶),蛋白上样,电泳,湿法转膜(400 mA横流1 h),PVDF膜用溶解有5%脱脂奶粉的TBST封闭(常温封闭 2 h),加入 VEGF 一抗(TBST,1∶100稀释),4 ℃过夜,TBST 洗膜,加入二抗(TBS,1∶100稀释), 室温反应1 h,TBST洗膜,ECL (Pierce ECL Western Blotting Substrate,32106)显色 1 min,暗室曝光X线片,应用灰度分析软件进行光密度分析。
1.2.7 预构皮瓣的免疫荧光化学染色
从两组中各随机选取4个预构岛状皮瓣,共8个皮瓣样本,制作连续冰冻切片,顺序加入vWF一抗(1∶200)和罗丹明标记的二抗(1∶100),以非特异血清代替一抗作为阴性对照,室温下孵育2 h,PBS洗片;再顺序加入针对 BrdU 的一抗(1∶100),二抗为FITC 标记(1∶100),室温下孵育 2 h,PBS 洗片,荧光显微镜下观察。
1.2.8 预构岛状皮瓣存活率大体观察
两组中余下的各8个岛状皮瓣均缝回原处,形成岛状皮瓣后的第七天,麻醉动物,观察皮瓣颜色、皮温、弹性质地和毛发生长情况,相同物距下用数码相机(Canon 550D)进行皮瓣摄像,图像输入计算机,应用Image-Pro Plus.V5.0,经图像增强、分割、待测面积的二值化处理,精确测量皮瓣存活部分及坏死部分面积,根据公式计算出各皮瓣存活率。

1.2.9 统计学方法
2 结果
2.1 BMSC的形态学观察
原代细胞在接种24 h后,可见部分贴壁的圆形细胞;48~72 h 后,细胞呈纺锤形、梭形、多角形,48 h后这些细胞形成明显的细胞集落,大小不一,每个集落约由十几到几十个细胞组成,细胞集落逐渐增多、增大,集落之间相互靠进;12~15 d可达到90%融合,融合后呈旋涡状。以1∶3传代的细胞24 h内完全贴壁,4~6 d内达到90%融合。原代培养发现局部区域有少许小而圆的细胞,传代后消失。第2代以后,细胞形态贴壁细胞形态呈梭形﹑三角形﹑扇形和圆形,平铺生长,不再形成明显的集落(图2)。
2.2 BMSC的鉴定
流式细胞仪分析显示,第3代细胞均一性较好,达99%以上,BMSC具有独特的免疫学表型,造血谱和内皮细胞标记CD34和CD45呈阴性表达,间充质干细胞表面标记CD29、CD90呈阳性表达,说明传代贴壁生长的梭形细胞为BMSC。
2.3 BMSC悬液注射后1周的观察
BMSC悬液注射入预构区隧道壁后1周,荧光显微镜下观察冰冻切片,发现实验组皮下组织内均匀分布绿色的BMSC,并参与到小血管壁中;对照组内未发现绿色荧光标记的细胞(图3)。
2.4 岛状皮瓣存活率的大体观察
形成岛状皮瓣时,未发现股血管栓塞现象,岛状预构皮瓣形成后7 d,实验组皮瓣大部分成活良好,颜色粉红,皮温正常,有毛发生长,弹性及质地与周围正常皮肤组织相似,仅边缘部分少许区域颜色暗红;对照组皮瓣近一半区域皮肤颜色变黑、组织回缩、弹性差、质地变硬、切割组织不出血。经图像分析,实验组和对照组皮瓣存活率分别为(93.1±2.6)%和(51.5±7.5)%,两组间差异有统计学意义(P<0.05)。
2.5 Western Blot检测结果
实验组皮瓣组织内VEGF含量明显高于对照组(图 4),两组间差异显著(P<0.05)。
2.6 BrdU/vWF免疫荧光双标记检测
免疫荧光双标检测结果显示,细胞悬液注射后第14天,实验组免疫荧光组织切片可见大量BrdU染色阳性的细胞,胞核呈现绿色荧光,胞浆中有红色荧光信号,含有双色荧光的细胞密集地整合在血管壁中,对照组免疫荧光组织切片未发现绿色及红色荧光信号表达的细胞(图5)。
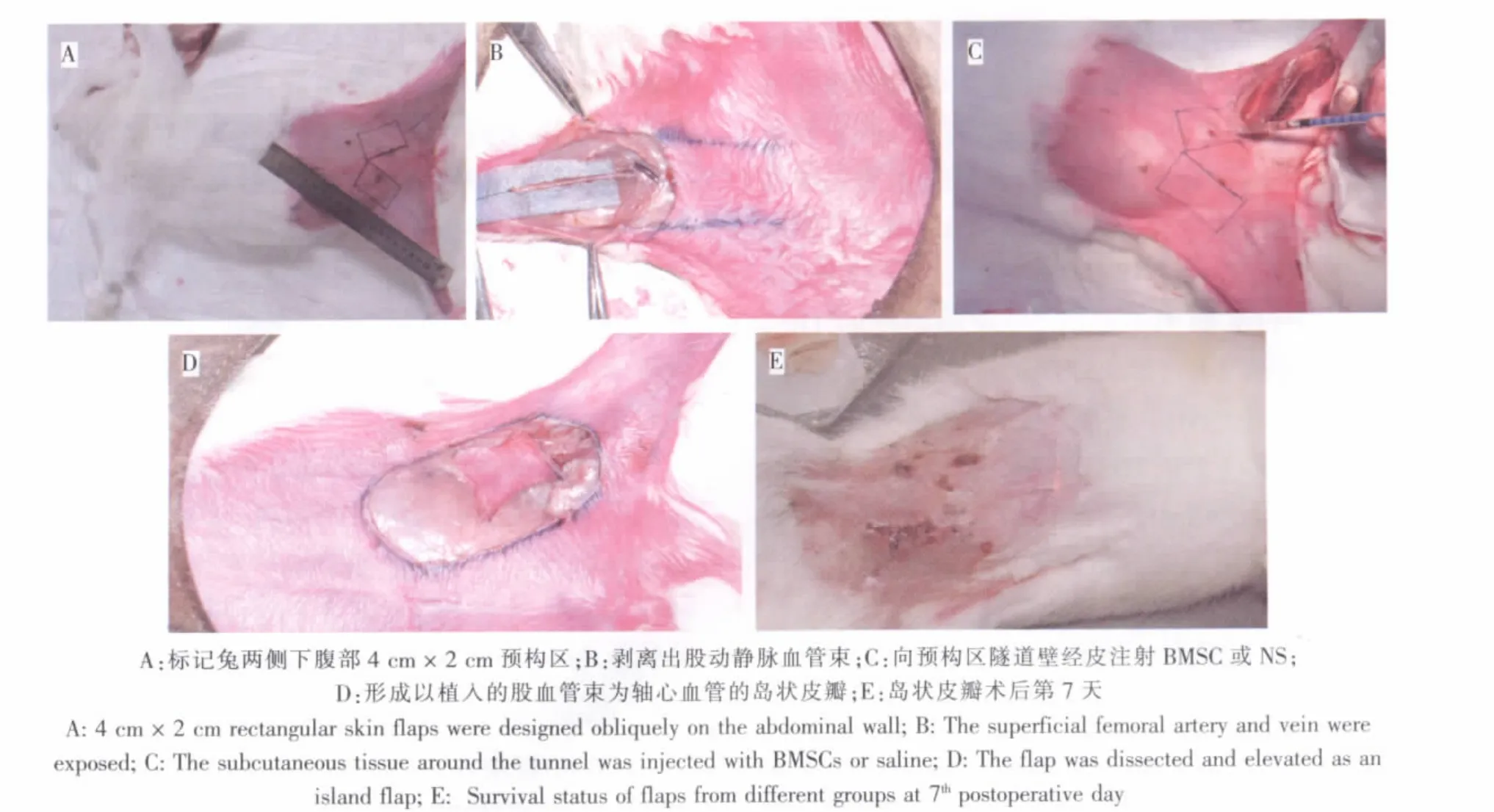
图1 预构皮瓣模型制备Fig.1 The preparation of prefabricated flap model

图2 BMSC的形态学观察(光镜,200×)Fig.2 Morphology observationof BMSC (Light microscope,200×)
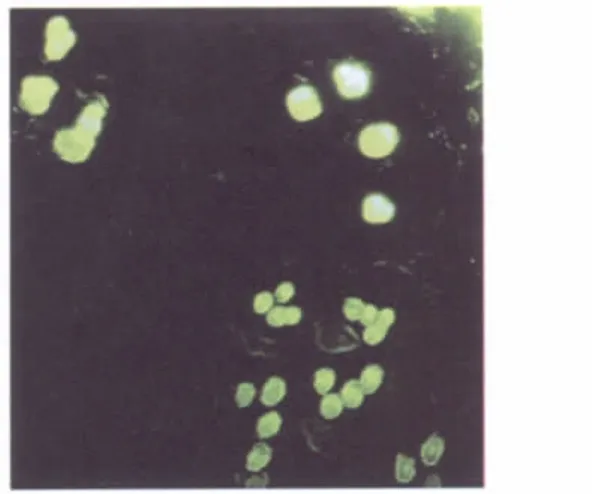
图3 BMSC移植后第7天Fig.3 Morphology observation of BMSC on the 7thday after transplantation
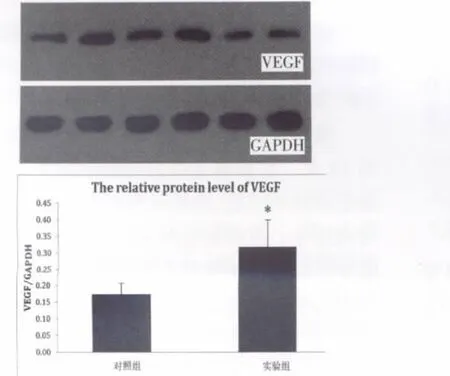
图4 预构皮瓣内VEGF的Western Blot半定量测定(Line1、3、5 为对照组;Line2、4、6 为实验组;*:P<0.05)Fig.4 Western Blot semi-quantitative analysis of VEGF protein levels from different groups.The mean VEGF level was higher in the flaps of BMSCs group when compared with control groups(P<0.05)

图5 BrdU/VWF免疫双标荧光染色(100×)Fig.5 The BrdU/vWF bone mesenchymal stem cells positive stain aggregate especially in flaps from experiment group at 14 days after transplantation
3 讨论
预构皮瓣成功的关键是血管载体与预构区域之间建立起充分的血管连接,即血管再生。血管再生包括血管新生和血管生成两个基本过程[6],前者是指内皮前体细胞分化为成内皮细胞,形成原始血管网的过程;后者是指从已存在的血管,以出芽方式长出新毛细血管的过程。过去曾认为血管新生只发生在胎儿期,近来发现成体内也有内皮前体细胞,即内皮祖细胞分化为血管内皮细胞的血管新生过程。因此,要促进预构皮瓣内的血管再生,就要增加局部内皮祖细胞的数量和促进已存在的血管出芽生长。许多研究表明,VEGF、bFGF、TGF-β等多肽类生长因子能明显促进已存在的血管出芽生长,增加了预构皮瓣内的血管密度,从而提高了预构皮瓣的存活率[7-8]。但这些生长因子半衰期都很短,有潜在的副作用,疗效有限[9-10]。近年来,干细胞的治疗性血管再生作用引起了广泛关注,其中BMSC因为因取材方便、可体外大量培养增殖、免疫原性低以及能分泌多种细胞因子等优点,而成为该领域的研究热点。BMSC移植后不仅通过分化为相应的功能细胞发挥作用,而且还 可 以 分 泌 VEGF、IGF、EGF、KGF、TGF、Ang1、SDF1等多种细胞因子,共同促进血管生成,已有报道用BMSC来治疗心肌缺血、外周缺血性疾病,以及促进缺血皮瓣的成活、创面愈合等,但用BMSC促进预构皮瓣的血管再生尚未见报道。因此,我们在本研究中探索了BMSC促进预构皮瓣成活的可行性。实验显示,实验组岛状皮瓣的平均成活率明显高于对照组,证实了BMSC同样能促进预构皮瓣的成活。我们在形成岛状皮瓣时,肉眼观察到实验组股血管束周围小血管明显较对照组丰富,且所有皮瓣中均没有发现植入的股血管束发生栓塞,所以对照组的岛状预构皮瓣较大范围皮肤坏死只能是皮瓣中小血管再生不充分造成的。
本实验中,通过对预构皮瓣中VEGF的Western Blot半定量分析发现,实验组皮瓣组织内VEGF含量明显高于对照组,说明BMSC悬液注射到预构皮瓣内,可增加皮瓣内VEGF的含量。我们也发现对照组皮瓣内有少量VEGF,可能是由于手术创伤引起皮瓣局部组织炎症、缺氧而产生的少量内源性VEGF。
有报道发现,BMSC能在体内分化为血管内皮细胞[5,11]。我们通过免疫荧光双标记检测发现,实验组皮瓣中的新生小血管管壁内密布胞核呈现绿色荧光,同时胞浆呈现红色荧光的细胞,表明该细胞正是由BMSC分化而来的血管内皮细胞或血管内皮祖细胞。所以,BMSC不仅通过分泌促进血管出芽的VEGF等细胞因子发挥作用,同时还能通过分化为血管内皮系细胞,形成原始血管网的血管新生,共同促进预构皮瓣内的血管再生,促进预构皮瓣的成活。
本实验移植的BMSC为同种异体,但术后第7天进行的冰冻切片追踪观察发现,移植到异体兔内的BMSC均匀分布于皮下,保持了良好的生物活性,体现了BMSC不被异体排斥的免疫特性,其机理被认为是BMSC表面只表达少量HLA2Ⅰ类抗原,不表达HLA2Ⅱ类抗原,以及通过旁分泌作用抑制B细胞和T细胞增殖,激活T细胞凋亡,从而形成免疫抑制。由于BMSC具有多种表面标记物,且尚未筛选到其独有的标志分子,给鉴定带来一定的困难,故我们选择了 CD34、CD45、CD29、CD90 进行检测[12]。
总之,本研究证明,BMSC异体移植能促进预构皮瓣的成活,但细胞悬液的最恰当浓度、用量、给药途径和给药时点,以及促进血管再生的更深入机制等都还有待进一步研究。
[1]Hiasa K,Egashira K,Kitamoto S,et al.Bone marrow mononuclear cell therapy limits myocardial infarct size through vascular endothelial growth factor[J].Basic Res Cardiol,2004,99(3):165-172.
[2]Tse HF,Siu CW,Zhu SG,et al.Paracrine effects of direct intramyocardial implantation of bone marrow derived cells to enhance neovascularization in chronic ischaemic myocardium[J].Eur J Heart Fail,2007,9(8):747-753.
[3]Bonab MM,Alimoghaddam K,Talebian F,et al.Aging of mesenchymal stem cell in vitro[J].BMC Cell Biol,2006,7(1):14-21.
[4]Zheng Y,Yi C,Xia W,et al.Mesenchymal stem cells transduced by vascular endothelial growth factor gene for ischemic random skin flaps[J].Plast Reconstr Surg,2008,121(1):59-69.
[5]Fang LJ,Fu XB,Sun TZ,et al.An experimental study on the differentiation of bone marrow mesenchymal stem cells into vascular endothelial cells[J].Zhonghua Shao Shang Za Zhi,2003,19(1):22-24.
[6]Tepper OM,Galiano RD,Kalka C,et al.Endothelial progenitor cells:the promise of vascular stem cells for plastic surgery[J].Plast Reconstr Surg,2003,111(2):846-854.
[7]Zhang F,Fischer K,Komorowska-Timek E,et al.Improvement of skin paddle survival by application of vascular endothelial growth factor in a rat TRAM flap model[J].Ann Plast Surg,2001,46(3):314-319.
[8]Uhl E,Barker JH,Bondar I,et al.Improvement of skin flap perfusion by subdermal injection of recombinant human basic fibroblast growth factor[J].Ann Plast Surg,1994,32(4):361-365.
[9]Gurunluoglu R,Meirer R,Shafighi M,et al.Gene therapy with adenovirus-mediated VEGF enhances skin flap prefabrication[J].Microsurgery,2005,25(5):433-441.
[10]Haws MJ,Erdman D,Bayati S,et al.Basic fibroblast growth factor induced angiogenesis and prefabricated flap survival[J].J Reconstr Microsurg,2001,17(1):39-42.
[11]Planat-Benard V,Silvestre JS,Cousin B,et al.Plasticity of human adipose lineage cells toward endothelial cells:physiological and therapeutic perspectives[J].Circulation,2004,109(5):656-663.
[12]Dominici M,LeBlanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The international society for cellular therapy position statement[J].Cytotherapy,2006,8(4):315-317.
