大鼠实验性脑梗死后AQP4表达与MRI变化的相关性研究
2011-06-14鹿寒冰董瑞国李晓宾朱士光庄丽丽安晓雷李传玲
鹿寒冰 董瑞国 李晓宾 朱士光 郭 靖 赵 辉 庄丽丽 安晓雷 李传玲
脑水肿是脑梗死后重要的继发性病理改变,与梗死的预后密切相关,水通道蛋白(AQP)是近年来发现的一组与水通透有关的细胞膜转运蛋白,是影响水跨膜转运和细胞内外环境平衡调节的主要膜蛋白,而脑组织中的水通道蛋白主要为AQP4,可能与脑水肿的形成密切相关。MRI对脑组织含水量的变化特别敏感,脑组织含水量的增加导致T1和T 2弛豫时间延长,通过对T1和T2信号强度值的测定,可以对脑组织含水量作定量分析[1]。本研究采用MRI的T1,T2,FLAIR,DWI序列相关指标定量分析大鼠实验性脑梗死后脑水肿的动态变化,并与AQP4的表达水平进行相关性分析,进一步探讨AQP4在脑梗死后脑水肿发生、发展和演变过程中的作用机制。
1 材料与方法
1.1 实验动物的选择 选用健康成年清洁级SD雄性大鼠45只,体质量240~300g(由徐州医学院实验动物中心提供,合格证号:SCXK(苏)2005-0005)。
1.2 动物及分组 大鼠被随机分为假手术组15只、脑梗死组30只,两组大鼠又各分为6h、1、3、5、7d五个亚组。
1.3 试剂与仪器 一抗(兔来源AQP4多克隆抗体)为美国Santa Cruz公司产品;二抗(二步法免疫组化试剂盒)由北京中山公司提供;生物医学图像分析系统为德国LEICA公司产品。
1.4 模型制作 采用改良的Zea Longa线栓法建立右侧大脑中动脉阻塞模型。大鼠用10%水合氯醛腹腔麻醉,小心游离右颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA),结扎颈总动脉和颈外动脉,用直径为0.24 mm标准鱼线头端浸蜡5 mm后插入CCA,随后将线栓插入ICA,调整鱼线方向使其避开翼腭动脉进入ICA颅内段,插入深度约定18~20 mm,遇阻力后即停止,造成局灶性脑梗死,在ICA根部结扎,假手术组为颈内动脉不插魚线,余操作同前。
1.5 试验阳性大鼠选择 脑梗死大鼠模型制作成功,待动物清醒后按Longa5分制标准评分:0分,无神经缺损症状;1分,不能伸展对侧前爪;2分,向对侧旋转;3分,向偏瘫侧倾倒;4分,不能自发行走,意识丧失。其中,0分及4分者被剔除,凡手术中大鼠死亡、蛛网膜下腔出血或无honer氏征者剔除,用来自同一批次的大鼠制成模型后补足数目。假手术组大鼠无明显神经功能缺损,均入组。
1.6 MRI扫描 采用GE Signa 3.0T超导 MRI成像设备,专用动物线圈为接收线圈。大鼠俯卧位,头置于线圈中央,自主呼吸。TIWI(IR FSE序列):TR=2195ms、TE=15ms;T2WI(FSE序列):TR=2600ms、TE=124ms;FLAIR (IR-FSE序列)成像:TR=8000、TE=133ms、TI=2250ms;DWI(EPI序列):TR=2275ms,TE=101ms,b值分别为0、1000s/mm2,冠状面扫描,各序列采集8层,层厚2mm,间距0.2mm,矩阵256×192,FOV:6 cm×5 cm。两组大鼠于造模后6 h、1、3、5、7 d行 MRI扫描
1.6.1 梗死体积测定 通过MRI机上的功能键自动测量各层感兴趣区(reigion of instrest,ROI)即梗死区面积,其中梗死6 h时在DWI序列上测量,其它时间点在FLAIR序列上测量,按公式[2]:梗死体积=各层面积之和×(层厚+层间距)-首尾两层面积之和×1/2层间距。
1.6.2 T1WI、T2WI、FLAIR、DWI序列SIR的测定 各序列分别通过MRI机上的功能键自动测量各层梗死区的平均信号强度值(signal intensity,SI),并同时测量对侧相应区域的SI,得出两侧半球各层感兴趣区的平均SI值(即各层感兴趣区的SI值之和除以层数),继而算出信号强度比SIR(即病灶侧平均SI/对侧平均SI),来反应脑梗死的相对含水量。假手术组在与梗死组相对应层面随机取感兴趣区,测量信号强度值,除以对侧相应区域信号强度值,得出信号强度比。
1.7 组织切片制备 两组大鼠MRI扫描后,常规左心室灌注固定,取右侧大脑,在于视交叉处断开鼠脑,以此切片为标准冠状切面,然后向后再切成5mm冠状切片,用冰冻切片机连续冠状位切片,片厚30μm,进行免疫组化染色。
1.8 免疫组化染色 采用Power Vision TM二步法进行免疫组化染色。冰冻切片用3%过氧化氢孵育5min,以阻断内源性过氧化物酶,一抗(浓度为1∶150)为兔来源 AQP-4多克隆抗体 (美国Santa Cruz公司)室温下孵育60min,按二步法免疫组化试剂盒(北京中山公司)说明书进行操作;DAB显色时间统一为3 min,显色后光镜观察。阴性对照用PBS代替一抗进行孵育。.
1.9 图像分析 采用Leica Qwin生物医学图像分析系统进行染色深浅定量分析,用灰度值(OD value)表示。每只大鼠各取2张切片,每张切片在右侧大脑皮质大脑中动脉分布区取3个区域测量其平均灰度值,然后减去各自相同区域背景区平均灰度值,取其负数,使均为正数值,两张切片的均值作为最终平均灰度值。
1.10 统计学处理 采用SPSS12.0软件,两组均数间的比较采用两个独立样本的t检验,多组间比较采用单因素方差分析,组间两两比较用LSD法,直线相关分析采用pearson法。P<0.05为差异有显著性。
2 结 果
2.1 假手术组信号强度 假手术组大鼠左右侧大脑半球各序列信号强度相比差异均不明显(P均>0.05)。
2.2 脑梗死体积测定 脑梗死模型大鼠在造模后6h,在DWI序列即开始出现梗死灶,至1d时梗死体积明显增大,在3d时达到高峰,之后逐渐减小,至7d时仍高于6h时的梗死体积,不同时间点间比较差异明显(F=58.367,P<0.01)(图1~7)。
2.3 T1WI,T2WI,FLAIR序列SIR的测定 脑梗死模型大鼠在梗死后不同时间点间,在T1WI T2WI、FLAIR、DWI各序列上SIR差异均明显(F=27.790、231.886、86.135、23.467;均 P<0.01)(表1、2、3、4)。
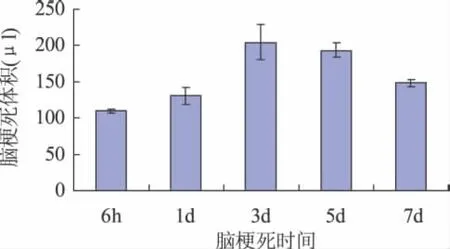
图1 不同时间点梗死体积测定(±s)
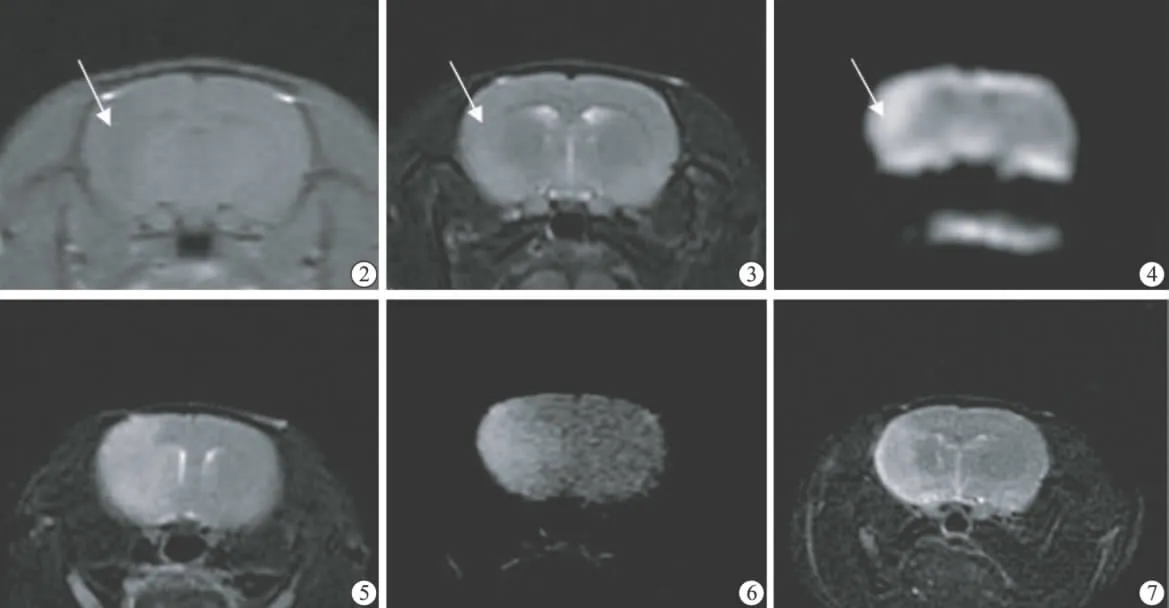
图2 脑梗死后6h T1 WI可见略低信号梗死灶;图3 脑梗死后6h T2 WI与前同一层面,可见略高信号梗死灶;图4 脑梗死后6h DWI与前同一层面,可见明显高信号梗死灶;图5 脑梗死后3d T2 WI可见体积明显增大的梗死灶,信号强度较6h时增高;图6 脑梗死后3dDWI与前同一层面,可见体积明显增大的梗死灶,信号强度较6h时增高;图7 脑梗死后7d T2 WI可见梗死灶体积较3d时缩小,信号强度较3d时降低
表1 两组大鼠脑梗死后不同时间点T1 WI序列信号强度比(±s,%)
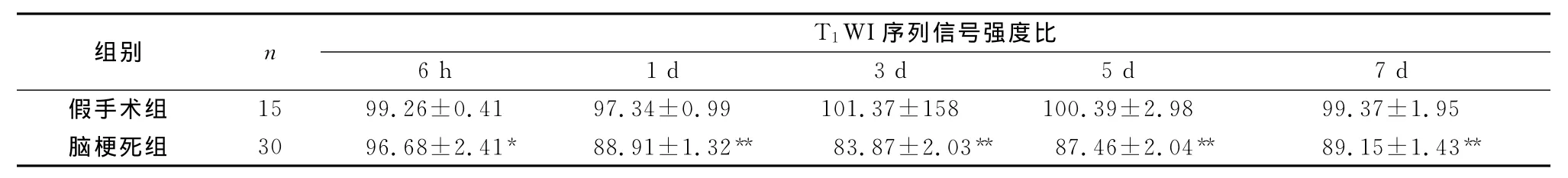
表1 两组大鼠脑梗死后不同时间点T1 WI序列信号强度比(±s,%)
注:与假手术组比较,*P<0.05,**P<0.01
组别 n T1 WI序列信号强度比6 h 1 d 3 d 5 d 7 d假手术组 15 99.26±0.41 97.34±0.99 101.37±158 100.39±2.98 99.37±1.95脑梗死组 30 96.68±2.41* 88.91±1.32** 83.87±2.03** 87.46±2.04** 89.15±1.43**
表2 两组大鼠脑梗死后不同时间点T2 WI序列信号强度比(±s,%)
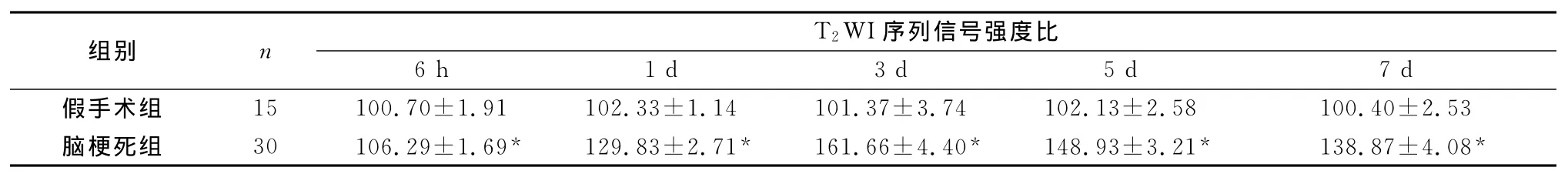
表2 两组大鼠脑梗死后不同时间点T2 WI序列信号强度比(±s,%)
注:与假手术组比较,*P<0.01
组别 n T2 WI序列信号强度比6 h 1 d 3 d 5 d 7 d假手术组 15 100.70±1.91 102.33±1.14 101.37±3.74 102.13±2.58 100.40±2.53脑梗死组 30 106.29±1.69* 129.83±2.71* 161.66±4.40* 148.93±3.21* 138.87±4.08*
表3 两组大鼠脑梗死后不同时间点FLAIR序列信号强度比(±s,%)
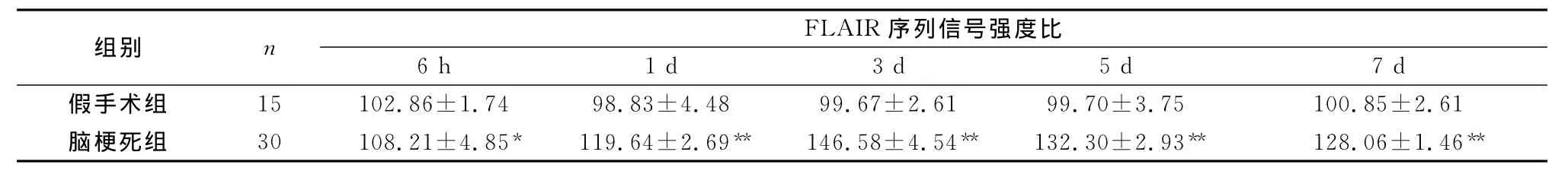
表3 两组大鼠脑梗死后不同时间点FLAIR序列信号强度比(±s,%)
注:与假手术组比较,*P<0.05,**P<0.01
组别 n FLAIR序列信号强度比6 h 1 d 3 d 5 d 7 d假手术组 15 102.86±1.74 98.83±4.48 99.67±2.61 99.70±3.75 100.85±2.61脑梗死组 30 108.21±4.85* 119.64±2.69** 146.58±4.54** 132.30±2.93** 128.06±1.46**
表4 两组大鼠脑梗死后不同时间点DWI序列信号强度比(±s,%)
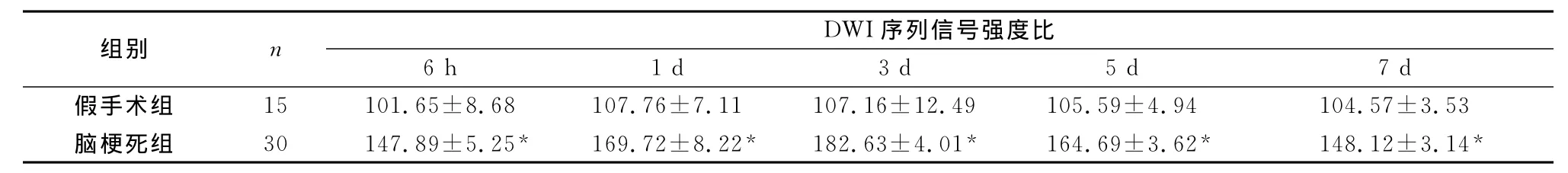
表4 两组大鼠脑梗死后不同时间点DWI序列信号强度比(±s,%)
注:与假手术组比较,*P<0.01
组别 n DWI序列信号强度比6 h 1 d 3 d 5 d 7 d假手术组 15 101.65±8.68 107.76±7.11 107.16±12.49 105.59±4.94 104.57±3.53脑梗死组 30 147.89±5.25* 169.72±8.22* 182.63±4.01* 164.69±3.62* 148.12±3.14*
2.4 脑梗死区皮层AQP4的表达水平 在脑梗死后6 h梗死侧大脑AQP4表达水平即增高,主要位于星形胶质细胞终足包绕毛细血管壁形成的一层胶质界膜上,随着梗死时间的延长其表达亦明显增强,第3 d达高峰,以后逐渐下降,7 d时仍高于假手术组;各时间点脑梗死组AQP4的表达水平均明显高于假手术组(P<0.01);不同时间点间比较假手术组AQP4的表达水平差异不明显(F=0.341,P>0.05),而脑梗死组各时间点间差异明显(F=28.489,P<0.01)(表5)。
表5 脑梗死侧大脑皮层AQP4表达水平的动态变化(±s,OD值)
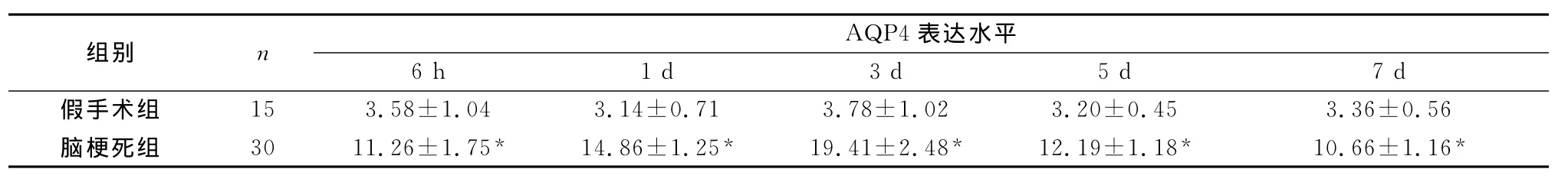
表5 脑梗死侧大脑皮层AQP4表达水平的动态变化(±s,OD值)
注:与假手术组比较,*P<0.01
组别 n AQP4表达水平6 h 1 d 3 d 5 d 7 d假手术组 15 3.58±1.04 3.14±0.71 3.78±1.02 3.20±0.45 3.36±0.56脑梗死组 30 11.26±1.75* 14.86±1.25* 19.41±2.48* 12.19±1.18* 10.66±1.16*
2.5 脑梗死体积与AQP4表达水平的相关性分析
脑梗死组大鼠各时间点病灶侧半球脑梗死体积与相应时间点大脑皮层AQP4表达水平的平均灰度值呈正相关(r=0.575,P<0.01)。
2.6 T1WI、T2WI、FLAIR、DWI序 列 SIR 与AQP4表达水平的相关性分析 将脑梗死组大鼠各序列不同时间点的序列SIR与相应时间点病灶侧大脑皮层AQP4表达水平的平均灰度值进行相关性分析,显示T1WIT的信号强度比与AQP4的表达水平呈负相关(r=-0.610;P<0.01),T2WI、FLAIR、DWI序列的信号强度比均与AQP4的表达水平 呈 正 相 关 (r=0.586、0.668、0.795;P 均<0.01)。
3 讨 论
本研究通过MRI对大鼠脑梗死模型进行研究,为了减少MRI机器不稳定性、周围环境的变化、电源电压的波动等因素造成的系统误差,本实验参照朱国行等实验的测量计算方法,采用信号强度比的计算[3],这样可减少每次检查时老鼠体位差别以及扫描层面不完全一致所造成的人为误差。DWI(弥散加权成像)是对水分子的横向弥散运动特别敏感的成像技术,在局部脑组织缺血后30 min内MRI可见水的弥散作用减低,出现高信号改变,主要反映急性期的细胞毒性脑水肿,而常规T2WI在动脉阻塞3~4 h才出现高信号[4]。本实验发现脑梗死后6 h在T1WI、T2WI、FLAIR序列脑梗死灶表现尚不明显,梗死灶的范围亦不易确定,而DWI上已经出现了较明显的高信号梗死灶,故本实验在脑梗死后6 h在DWI序列上测量脑梗死体积,而在其它时间点DWI序列梗死灶的范围没有T2WI、FLAIR序列清晰,本实验中DWI序列在各个时间点图像均有不同程度的变形与伪影,可能与大鼠脑体积较小、弥散加权图像的空间分辨率有限、磁敏感效应易造成高信号伪影等有关,因此在应用弥散加权图像诊断脑梗死的同时应结合常规 MRI,以避免假阳性。FLAIR序列由于抑制了脑脊液的信号,同时增加了T2权重成分,背景信号减低,增加了病灶与正常组织间的对比以及与脑脊液的对比,对靠近脑脊液的区域如皮层、脑室旁的病变的显示大为改善,故本实验在脑梗死后1、3、5、7d采用在FLAIR像上测量梗死体积的变化来反应脑水肿的吸收情况。
AQP4为水分子转运通过细胞膜脂质双分子层的一种膜蛋白,脑组织中的AQP主要为AQP4,在面向毛细血管内皮细胞、软脑膜和脑室室管膜侧胶质细胞的细胞膜或足突上表达明显[5]。本实验结果亦显示AQP4在大脑皮层中毛细血管周围的星形胶质细胞终足上表达丰富,同时皮层边缘软脑膜下及脑室周围的胶质细胞界膜上也有表达。
近期许多研究表明,AQ4的表达与脑水肿密切相关[6]。Taniguchi等的研究发现,大脑中动脉阻塞后AQP4 mRNA的表达上调,第3 d达高峰,第7 d仍处于较高水平,皮质的分子层和外颗粒层可见AQP4 mRNA及蛋白质表达最强[7]。陈英辉等的实验发现,AQP4表达水平在大鼠脑缺血再灌注后6 h即开始增高,随再灌注时间的延长,其表达量逐渐增加,再灌注24~48 h达到高峰,其表达与脑组织含水量和伊文氏蓝水平呈正相关,提示AQP4表达参与了脑缺血再灌注后继发血脑屏障的开放和脑水肿的发生[8]。张新宇等通过在大鼠脑内注射TNF-α后,发现早期就可出现脑水肿,并测得AQP4表达明显上调、BBB通透性显著增加,且二者呈显著正相关,推测TNF-α通过多种途径破坏BBB,继而诱导AQP4表达上调,进一步加重脑水肿形成恶性循环[9]。黄垂学等采用自由落体硬膜外撞击法致大鼠重度脑创伤模型进行实验发现,脑损伤后4 h,脑组织中AQP4表达开始上调,1 d后达高峰,持续3 d后下降,7 d时接近假手术组水平[10]。
本研究结果显示AQP4的表达水平与MRI上病灶侧半球脑水肿体积、T2WI、FLAIR、DWI序列平均SIR值呈正相关,与T1WI序列的SIR呈负相关。T2WI对组织总含水量增加的血管源性水肿敏感[11],这亦从侧面说明了AQP4的表达水平与血脑屏障破坏导致的血管源性脑水肿有关。DWI的高信号改变主要反映急性期的细胞毒性脑水肿,本实验在脑梗死后的急性期与亚急性早期AQP4的表达水平与DWI的平均SIR值呈正相关,说明AQP4的表达水平与脑梗死后细胞毒性脑水肿的形成发展亦密切相关。本实验结合MRI的各项脑水肿指标从多个方面说明脑梗死后AQP4的表达促发了缺血性脑水肿的形成与发展,且脑梗死后AQP4的过度表达可能与血管源性脑水肿及细胞毒性脑水肿形成与发展均相关。
AQP4在脑中作用的具体机制及其表达调控的机制还不十分明确,且存在很大的分歧,需要进一步的实验研究来证实。针对AQP4进行调控从而为临床治疗脑水肿研提供新的思路与理论依据的研究具有越来越广阔的前景。由于研究技术、设备的限制,对超早期(<6 h)的梗死尚未进行研究,随着MRI设备的更新和新技术的发展,平面回波(EPI)/T2* WI、梯度回波 (GRE)/T2* WI、灌注成像(PWI)和MR波谱(MRS)等的运用,还可对缺血周围的血流、理化性质改变等作进一步的分析,将有利于对脑梗死后脑水肿的形成机制及治疗作更深层次的研究。
1 Lin W,Venkatesan R,Gurleyik K,et al.An absolute measurements of water content using magnetic resonance imaging in two focal cerebral ischemic rat models.Cereb Blood Flow Metab,2000,20(1):37-44.
2 李晓宾,董瑞国,程广军,等.应用MRI动态评估亚低温对大鼠出血性脑水肿的干预效应.中国临床康复,2006,10(18):82-85.
3 朱国行,姚景莉,秦 震,等.甘露醇治疗脑血管病性脑水肿的MRI研究.中国神经精神疾病杂志,1997,23(5):286-288.
4 Thomas M,Ringer MD,Tobias Neumann-Haefelin MD.Reversal of early diffusion-weighted magnetic resonance imaging abnormalities does not necessarily reflect tissue salvage in experimental cerebral ischemia.Stroke,2001,32(10):2362-2367.
5 Manley GT,Fujimura M,Ma T,et al.Aquaporin-4 deletion in mice reduces brain edema after acute water toxication and ischemic stroke.Nat Med,2000,6(2):159-163.
6 Papadopoulos MC,Verkman AS.Aquapofin-4 and brain edema.Pediatr Nephrol,2007,22(6):778-862.
7 Taniguchi M,Yamashita T,Kumura E,et al.Induction of aquaporin-4 water channel mRNA after forcal cerebral ischemia in rat.Brain Res Mol Brain Res,2000,78(1-2):131-137.
8 陈英辉,赵永波,呙登俊,等.水通道蛋白4在大鼠脑缺血再灌注损伤中的作用.临床神经病学杂志,2006,19(3):197-199.
9 张新宇,孙晓川.肿瘤坏死因子α诱发脑水肿的机制.重庆医科大学学报,2008,33(4):432–436.
10 黄垂学,李俊驹,赵建农,等.脑损伤后水通道蛋白4表达与血脑屏障通透性的关系.中华神经外科疾病杂志,2008,7(3):205-208.
11 Burdette JH,Elster AD,Ricci PE,et al.Acute cerebral infarction:Quantification of spin-density and T2“shine-through”phenomenon on diffusion-weighted MR images.Radiology,1999,212(2):333-339.
