依达拉奉干预对大鼠脑出血模型细胞凋亡相关通路的影响
2011-06-14丁素菊吴丹红
韩 宁 丁素菊 吴丹红
脑出血后存在神经细胞凋亡已经为许多研究所证实。Qureshi等发现ICH患者发病后24 h内的血肿周围组织中即可检测到凋亡细胞,5d时仍存在凋亡现象[1]。Xue等在大鼠自体动脉血ICH模型的研究中发现,术后4 h即开始出现细胞凋亡,并可持续4周[2]。另有研究发现,自由基与细胞凋亡有着密切的关系,脑出血后由于周围组织缺血、红细胞破裂、铁离子释放及炎症反应等,促使自由基大量生成,而自由基可以通过损伤DNA、影响信号传导以及参与表达调控等介导细胞凋亡。我们前期研究发现大鼠脑出血模型中自由基和细胞凋亡呈正相关[3]。
目前研究认为细胞凋亡途径主要有三条,包括线粒体途径、死亡受体途径(TNF受体途径)及内质网途径。已有大量研究证实,线粒体途径和神经系统凋亡密切相关,脑出血后Cyto C释放是神经细胞凋亡的一个关键事件[4]。对于内质网途径和死亡受体途径在脑出血后细胞凋亡中的作用及其与自由基的相关性目前研究较少。
1 材料与方法
1.1 材料 清洁级雄性SD大鼠,体重300g左右,购于中科院。多克隆的兔抗Caspase-3抗体、FITC标记的绵羊抗兔IgG抗体、DAB染色试剂盒购自武汉博士德公司,多克隆兔抗TNF-α抗体、抗体稀释冻干粉、多克隆兔抗Caspase-8抗体购自北京博奥森生物技术有限公司,HRP-抗兔Ig G抗、tween-20、Hoechst染色试剂盒购自碧云天生物技术研究所,Triton-100购自AppliChem公司。
1.2 方法
1.2.1 模型建立参照 Deinsberger[5]、周中和等[6]报道方法,采用二次注血/退针法制备大鼠ICH模型,大鼠称重后给予10%水合氯醛腹腔注射麻醉(0.4 g/kg);大鼠麻醉后俯卧位固定于大鼠脑立体定位仪[7]上,门齿沟水平比耳间线低2.6 mm;常规备皮消毒、切开,选择注射点为尾壳核,将微量注射仪尖端定位于前囟前0.5 mm,中线旁开3 mm,垂直进针6 mm,用微型手钻在此钻一直径0.5 mm的小孔;用1 ml注射器取大鼠自体股静脉不凝血80μl,沿所钻小孔进针6 mm(相当于大鼠尾壳核部位),先注入20μl,停针2 min后继续缓慢注入60μl(2 min内均匀注入)后,留针约2 min,退针2 mm,再停针约2 min,缓慢将注射器完全退出。假手术组为只进针到尾壳核后不注血,停针6 min后退针。骨蜡封闭颅骨创口,缝合头皮及大腿内侧皮肤,局部皮肤用碘汀消毒,置于温暖环境中直至清醒。
1.2.2 模型成功判断
大鼠苏醒后参照Bederson[8]法进行神经功能缺陷评分,即0分:前爪伸直,无神经功能缺损;1分:脑部病变对侧腕关节、肘关节屈曲,肩内收屈曲;将尾巴提起,瘫痪侧前肢回收屈曲于腹下(正常侧前肢向地面伸展);2分:上述体征+向麻痹侧推阻力下降;3分:活动时向麻痹侧打圈(呈追尾状)。评分≥2分者入选。
1.2.3 分组
将SD大鼠随机分为假手术组、模型组、依达拉奉干预组(1 mg/kg、3 mg/kg)。模型组和两种剂量的干预组又各自分为6、12、24、48、72 h、7、14 d七个亚组。假手术组(n=6),模型组和依达拉奉干预组(两个剂量)每一亚组(n=6)。
依达拉奉干预组于造模成功后1 h给予依达拉奉腹腔注射(3 mg/kg组以药物原液注射,1 mg/kg将原液稀释为相同容量后注射),1次/24 h,分别于6、12、24、48、72 h、7、14 d七个时间点处死。
假手术组及模型组造模完毕后,以等量生理盐水腹腔注射。假手术组于造模后24 h处死;模型组分别于造模后相应时间点处死大鼠并取材。
1.2.4 TNF-α免疫组织化学染色 各组相应时间点处死后,使用免疫组织化学染色的卵白素-生物素复 合 物 法 (avidin-biotin comeplex,ABC)制 作TNF-α的免疫染色。用10μl磷酸盐缓冲溶液代替一抗(抗TNF-α抗体)作为阴性对照。阳性对照为已知商品化的阳性片。TNF-α定位于细胞浆,光镜下以细胞核周边呈棕黄色或褐色为TNF-α阳性染色。利用图像管理系统在200倍视野下随机选择5个不重复视野,输入Image-Pro Plus图像处理软件分析系统,记取平均灰度值。
1.2.5 凋亡相关蛋白的免疫印迹检测 提取总蛋白,应用BCA试剂盒定量,SDS-PAGE凝胶电泳,电转移至硝酸纤维素膜,于水平摇床室温封闭1 h,4℃一抗孵育过夜(封闭液配一抗,此处一抗为兔抗的Caspase-3抗体1∶100/兔抗 Caspase-8抗体1∶200),室温二抗孵育2 h(二抗为HRP-抗兔IgG抗体),ECL系统显色。
1.2.6 统计学处理 数据以均数±标准差表示,采用SPSS11.0统计软件。多组间比较用方差分析,两组间比较用t检验。以P<0.05为有统计学差异。
2 结 果
2.1 TNF-α在脑组织含量
假手术组于针道周围可见少量TNF-α阳性表达细胞,24 h时表达量最高,7、14d未见阳性表达。模型组和药物干预组均于6 h即可观察到TNF-α阳性细胞,主要位于血肿周围及同侧皮质,从形态观察以星形胶质细胞和小胶质细胞居多,也可见神经元阳性表达;12、24 h阳性细胞数持续增加;3 d时达到高峰,范围也明显扩大,于血肿周边细胞、双侧皮质、海马均可见TNF-α阳性细胞;7 d时模型组阳性表达明显减少,药物干预组阳性表达消失;14 d时模型组、药物干预组均未见阳性表达(表1、图1、2)。
表1 不同时间点各组大鼠TNF-α表达量的变化(±s,平均灰度值)
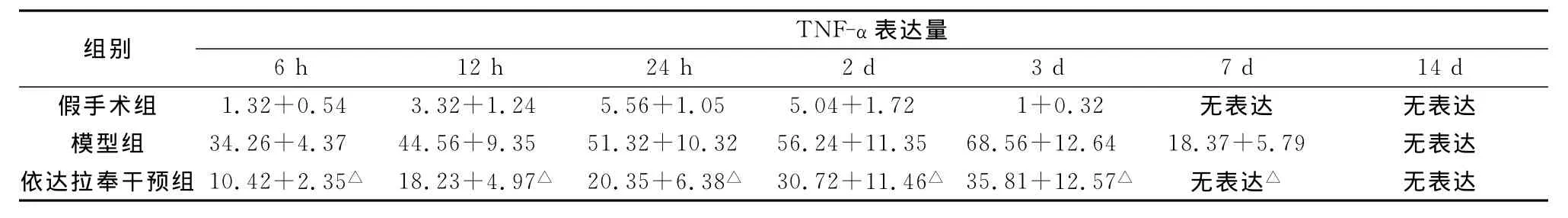
表1 不同时间点各组大鼠TNF-α表达量的变化(±s,平均灰度值)
注:与模型组比较,△P<0.01
组别TNF-α表达量6 h 12 h 24 h 2 d 3 d 7 d 14 d无表达 无表达模型组 34.26+4.37 44.56+9.35 51.32+10.32 56.24+11.35 68.56+12.64 18.37+5.79 无表达依达拉奉干预组 10.42+2.35△ 18.23+4.97△ 20.35+6.38△ 30.72+11.46△ 35.81+12.57△ 无表达△假手术组 1.32+0.54 3.32+1.24 5.56+1.05 5.04+1.72 1+0.32无表达
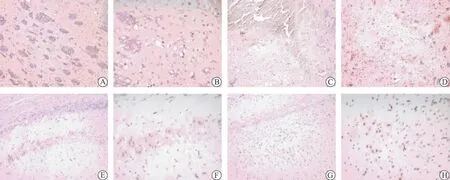
图1 免疫组化检测TNF-α在脑组织中的表达水平
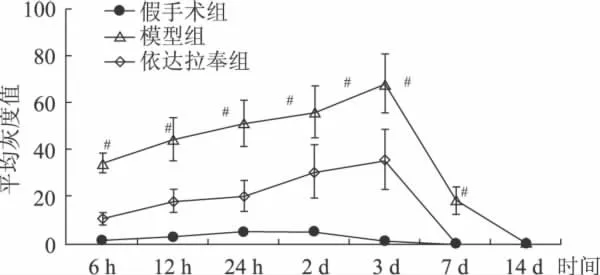
图2 不同时间点各组大鼠TNF-α含量的变化,与依达拉奉干预组比较,#P<0.01
2.2 Caspase-3免疫荧光
假手术组针道周围细胞核数量略减少,可见少量Hoechst浓染细胞,Caspase-3表达较手术对侧略增加。模型组和两种剂量的药物干预组均于6 h即可观察到Hoechst浓染细胞,24 h明显增加,72 h达高峰,之后逐渐减少,14 d时于血肿周围仍可见少量Hoechst浓染细胞,各个时间点模型组均较3 mg/kg药物干预组浓染细胞量大。模型组和两种剂量的药物干预组6 h即可观察到Caspase-3阳性表达,表达高峰为24 h,模型组阳性表达量均较3 mg/kg药物干预组明显增高(图3)。
2.3 Caspase-3的 Western blot检测
假手术组选择72h,其余各组选择6、72 h两个时间进行Caspase-3的 Western blot检测。Full Caspase-3表示未经切割的无活性酶原,分子量为35k D,Cleaved Caspase-3为切割后的活性酶,切割后分子量为17k D。半定量检测发现假手术组72 h未见Caspase-3激活;模型组及两种药物干预组均于6 h即出现Caspase-3激活,72 h量明显增加;两个时间点激活后的Caspase-3表达量:模型组>药物干预组(1 mg/kg)>药物干预组(3 mg/kg)(图4)。
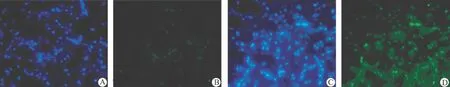
图3 免疫荧光检测Caspase-3在脑组织中的表达水平
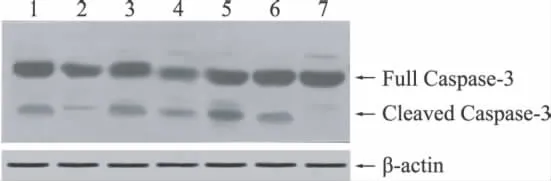
图4 Western blot检测脑组织中Caspase-3的激活 1、2为药物干预组(3 mg/kg)72、6 h;3、4为药物干预组(1 mg/kg)72、6 h;5、6为模型组72、6 h;7为假手术组72 h
2.4 血肿周边脑组织caspase-8的表达及激活 假手术组选择72 h,其余各组选择24、72 h两个时间进 行 Caspase-8 的 Western blot 检 测。Full Caspase-8表示未经切割的无活性酶原,分子量为57 k D,Cleaved Caspase-8为切割后的活性酶,分子量为45 k D。半定量检测发现假手术组72 h未见Caspase-8激活;模型组及两种药物干预组于24 h可见Caspase-8激活,72 h量明显增加;两个时间点激活后的Caspase-8表达量:模型组>依达拉奉组1(1 mg/kg)>依达拉奉组2(3 mg/kg)(图5)。
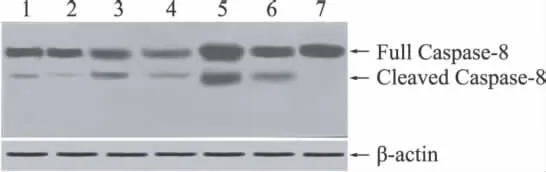
图5 Western blot检测脑组织中Caspase-8的激活 1、2为药物干预组(3 mg/kg)72、24 h;3、4为药物干预组(1 mg/kg)72、24 h;5、6为模型组72、24 h;7为假手术组72 h
3 讨 论
通常情况下肿瘤坏死因子-α(TNF-α)是由单核细胞或巨噬细胞产生,是继即早基因(Immediate early gene,IEG)表达后首个增高的前炎症因子,具有多种生物学效应。有研究证实脑出血后TNF-α表达及分泌水平明显升高[9],在出血后48 h达到高峰[10],TNF-α 表 达 量 增 加 与 凝 血 酶 有 密 切 的 关系[9]。项洁等发现TNF-α表达量与细胞凋亡呈正相关[11],认为 TNF-α的表达也是细胞凋亡触发机制之一。本实验发现脑出血后6 h既有TNF-α的表达和分泌,72 h时表达量最高,7 d时模型组明显减少,药物干预组表达消失;14 d时模型组和药物干预组均未观察到TNF-α阳性表达。
大量研究证实,TNF-α可以通过激活死亡受体Fas/APO-1诱导细胞凋亡,Fas属于 TNFR/NGFR家族成员,是Ⅰ型跨膜受体蛋白,分布于胸腺细胞、激活的T和B淋巴细胞、巨噬细胞、肝、脾、肺、心、脑、肠、睾丸和卵巢细胞等。Fas具有三个富含半胱氨酸的胞外区和一个称为死亡结构域的胞内区。TNF-α与Fas结合后Fas三聚化使胞内的DD区构象改变,然后与接头蛋白FADD的DD区结合,而后FADD的N端DED区就能与Caspase-8(或-10)前体蛋白结合,形成 DISC,引起caspase-8、10通过自身剪激活,它们启动caspase的级联反应,使caspase-3、-6、-7激活,这几种 Caspase可降解胞内结构蛋白和功能蛋白,最终导致细胞凋亡。
本实验发现脑出血后在TNF-α表达增高的同时,Caspase-8和Caspase-3也出现表达量的增加,通过Western blot检测发现模型组和药物干预组均于6h即出现Caspase-3表达量增加和激活,72h表达量高于6h;两个时间点激活型和非激活型Caspase-3表达量模型组均高于药物干预组。模型组和药物干预组于24h可检测到激活型的Caspase-8,72h表达量明显增加;两个时间点激活型的Caspase-8表达量模型组均大于药物干预组。Caspase-8激活时程和TNF-α表达时程相一致,但晚于Caspase-3的激活,说明除了TNF通路以外,还有其他上游Caspase参与激活Caspase-3,从而参与脑出血后的细胞凋亡。
1 Qureshi AI,Suri MF,Ostrow PT,et al.Apoptosis as a form of cell death in intracerebral hemorrhage.Neurosurgery,2003,52(5):1041-1048.
2 Xue M,Del Bigio MR.Intracerebral injection of autologous whole blood in rats:time course of inflammation and cell death.Neurosci Lett,2000,283(3):230-232.
3 Ning HAN,Su-Ju DING,Tao WU,et al.Correlation of free radical level and apoptosis after intracerebral hemorrhage in rat.Neurosci Bull,2008,24(6):351-358.
4 李 玮,周中和,王景周.大鼠脑出血后血肿周围组织线粒体ATPase-6基因表达及TUNEL阳性细胞动态变化研究.中风与神经疾病杂志,2003,20(4):292-294.
5 Deinsberger W,Vogel J,Kuschinsky W,et al.Experimental intracerebral hemorrhage:description of a double injection model in rats.Neurol Res,1996,18(5):475-477.
6 周中和,曲 方.一种改良大鼠自体血脑出血模型:二次注血/退针法.中国临床神经科学,2004,12:406-408.
7 包新民,舒斯之.大鼠脑立体定位图谱.第1版.北京:人民卫生出版社,1991.39-40.
8 Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination.Stroke,1986,17(3):472-476.
9 Hua Y,Wu J,Keep RF,et al.Tumor necrosis factor-alpha increases in the brain after intracerebral hemorrhage and thrombin stimulation.Neurosurgery,2006,58(3):542-550.
10 Zhang X,Li H,Hu S,et al.Brain edema after intracerebral hemorrhage in rats:the role of inflammation.Neurol India,2006,54(4):402-407.
11 项 洁,沈 霞,耿德勤.肿瘤坏死因子-α在大鼠脑缺血再灌注中的表达及对神经细胞凋亡的影响.中国临床康复,2004,8(28):6094-6095.
