重组腺病毒介导神经营养因子基因转染对体外培养脊髓神经元存活和分化的影响
2011-06-13范东艳范洪学
刘 然,王 苹,范东艳,范洪学,郭 丽*
(1.吉林大学公共卫生学院卫生毒理学教研室,吉林长春130021;2.长春市中心血站;
3.吉林大学第一医院;4.西藏大学医学院)
脊髓损伤(spinal cord injury,SCI)是一种发病率极高且较难治愈的疾病。因为SCI最终导致瘫痪,所以不仅给患者本人及家庭带来严重的经济负担也带来了巨大的社会问题[1,2]。如何在SCI后维持脊髓神经元存活和轴突的再生能力,延缓其变性坏死是目前神经科学和临床科医学迫切需要解决的难点和热点问题。神经营养因子 (neurotrophic factors,NTFs)是一类调节神经系统发育、成熟、维持神经功能的天然蛋白质。神经营养因子是神经元存活和发挥功能的基础,具有影响神经系统发育成熟,调节神经递质的传递,影响神经损伤的病理反应,促进神经元修复和再生等功能,所以神经营养因子是保护神经元和促进其修复再生的必需因子。文献报道,SCI后脑源性神经生长因子(BDNF)和NT3的表达上调可以促进脊髓神经元、轴突和髓鞘的再生修复[3,4]。本实验通过观察BDNF和NT3在体外脊髓神经元培养中的作用,比较它们对脊髓神经元生长发育作用的影响,为临床上应用NTFs治疗脊髓损伤提供实验依据。
1 材料与方法
1.1实验动物与器材动物:Wistar大鼠购自吉林大学医学院动物中心。细胞培养试剂:DMEM/F12和胎牛血清购自Gibco公司。胰蛋白酶购自Gibco公司。兔抗鼠神经元特异性烯醇化酶 (neur onals pecific enolase,NSE)和Alexa Fluor 555标记的山羊抗小鼠IgG的二抗购于Molecular Probes公司,倒置相差显微镜Olympus公司。激光扫描共聚焦显微镜Olympus公司。Ad-BNNF和Ad-NT3为本实验室采用pAdeasy系统构建的,BDNF或NT3基因插入pAd-ShuttleCMV,然后与缺乏E1和E3区序列的腺病毒大质粒pAdeasy-1,在E Coli BJ5183细胞中进行同源重组,293细胞内包装病毒。重组腺病毒滴度为2×108VP/ml。
1.2脊髓背根神经节神经元分离参考文献[5]的方法进行分离。取新生24 h Wistar大鼠,无菌条件下剥离背部皮肤及软骨,暴露椎体外侧隐窝中圆形脊神经节,逐个摘除,置于预冷PBS内,剥除神经节表面筋膜,置于另一个盛有预冷PBS的平皿中,眼科剪将神经节剪至0.5 mm3大小的碎块,并用预冷PBS冲洗3遍,将组织块移入盛有0.25%胰蛋白酶的离心管中,37℃培养箱中消化20 min,用含10%FBS的DMEM/F12培养基终止消化,吸管轻柔吹打数次,滤掉组织块,离心(1 000 rpm/min 10 min),弃上清,以10%FBS的DMEM/F12培养基再次重悬,200目滤网过滤,计数细胞存活率为90%,调整细胞浓度为1×106/ml,接种于35 mm培养皿上。
1.3实验分组细胞接种3 d后,分别加入重组腺病毒滴度为2×108VP/ml的Ad-BDNF和Ad-NT3,无血清转染3 h,转入正常培养基继续培养15 d,以未加任何神经营养因子为对照。同时将BDNF和NT3联合应用,并与单独应用组进行比较。
1.4免疫荧光染色免疫荧光染色在诱导的不同时间收获样本。弃去培养基,用Hank’s溶液洗涤2次,加入4%的多聚甲醛溶液,固定30 min。用PBS洗涤3×5 min,加入0.1%Triton X-100处理15 min,5%山羊血清封闭1 h,加入一抗(NSE,1∶100),室温孵育1 h,用PBS洗涤3×15min,加入Alexa Fluor 555标记的山羊抗小鼠IgG的二抗(1∶400),室温避光放置1 h,PBS洗涤3×15 min,轻轻摇动。弃掉洗涤液,最后样品均再用1 g/ml的Hoechest33342复染细胞核,室温温育5 min。甘油封片后,用Fluview 1000激光扫描共聚焦显微镜观察。阴性对照实验中,用PBS代替第一抗体来排除非特异性的二抗结合。共聚焦显微镜观察PMT(电压值)为650,C.A(针孔值)为100,采用单通道扫描,检测波长分别为405 nm和563 nm。阳性计数:×400荧光显微镜下,随机选取6个区域用目镜网格测同尺计算阳性细胞率(%),即阳性细胞数/网格范围内的细胞总数,取平均值。
1.5统计学处理所有资料均采用SPSS13.0软件包进行统计学处理。计量资料用(s)表示。
2 结果
2.1形态学观察脊髓神经元细胞倒置显微镜下观察培养24 h后,可见大部分细胞已贴壁且呈现均匀分布,胞体呈圆形或椭圆形,可见细胞突起。随培养时间延长,神经元细胞突起增多形成网络。培养的第9 d后镜下可见,细胞数减少出现死亡细胞。神经元在普通培养基中可维持存活20 d左右。
2.2神经元细胞免疫荧光染色本实验采用免疫荧光技术检测原代培养的脊髓背根神经节神经元含量,结果显示NSE阳性细胞,染色呈红色荧光。正常培养6 d的脊髓神经元细胞中NSE阳性神经元占40%左右(见图1)。
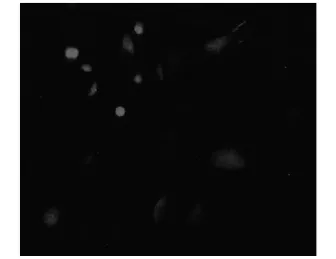
图1 正常培养6 d的脊髓神经元细胞NSE免疫荧光染色(×400)
2.3神经营养因子对脊髓神经元存活的影响在BDNF和NT3转染后,持续培养到第15 d,计数神经元的存活率。结果显示,单纯细胞培养组神经元仅有(25±2.18)%的存活;BDNF组神经元的存活率为(50±3.42)%;NT3组神经元的存活率为(42±3.12)%;BDNF+NT3组神经元存活率为(63±2.53)%。脊髓神经元存活率联合应用与单独应用相比有显著性差异(P<0.05)。
2.4NTFs转染后不同时间脊髓神经元存活的变化在BDNF和NT3转染后,持续培养的同时间点,观察NSE阳性细胞数,结果发现在持续培养8 d时,NTs转染组的NSE阳性细胞比6 d时间点略高。8 d后神经元死亡明显减慢,而单纯培养组的神经元存活呈线性下降(见图2)。
3 讨论
神经营养因子是维持神经元存活、分化和发挥功能的基础。在体内脊髓神经元的存活不仅需要从血液中摄取营养物质,而且需要多种神经营养因子的支持,这些因子可来自神经细胞本身,也可来自外周细胞。当神经元受损处于凋亡前状态,若给予积极的干预措施,有望逆转或减缓神经元的变性坏死。文献报道,BDNF能够促进损伤后轴突的存活,还能促进神经元功能恢复[6,7]。Johnson等最近报道了NT3结合PDGF能够促进神经前体细胞在脊髓损伤部位分化为神经元。Zhang等应用NT3修饰神经干细胞移植治疗小鼠脊髓损伤模型,发现移植30天后,脊髓功能明显改善,损伤部位转染阳性细胞增加[8,9]。腺病毒载体作为一种高效的基因转移载体被广泛应用于外源基因转导哺乳动物细胞。原因是腺病毒基因组结构稳定,可插入大片段的外源基因,不发生基因重排,对宿主细胞要求不严,可感染分裂期细胞,也可感染静止期的细胞。另外腺病毒基因组不与宿主基因组发生整合,安全可靠,是基因治疗的理想载体。本实验采用重组腺病毒介导NT3和BDNF基因转染体外培养的脊髓神经元,比较了神经营养因子对体外培养的脊髓神经元存活影响,发现BDNF和NT3均对脊髓神经元有一定的保护作用。并且两种营养因子联合转染作用更强,表明两种因子对脊髓神经元的存活有叠加效应,推测它们可能是通过不同的神经生长调节途径发挥作用。观察BDNF组、NT3组和BDNF+NT3组作用后不同时间点脊髓神经元的存活率,发现单纯培养的脊髓神经元培养对照组随培养时间延长细胞数目明显减少。而添加NTFs组的脊髓神经元的存活率在8 d时略高于前一时间点。推测这可能是由于BDNF、NT3不仅对脊髓神经元具有营养、支持、保护的作用,而且还可能促进了神经前体细胞向神经元分化。实验中分离提取的神经元取材于椎体外侧隐窝中的脊神经节,这个区域除了含有大量的脊髓神经元外还有许多神经前体细胞,这些前体细胞具有分化潜能,在 BDNF和NT3的作用下,可能分化成脊髓神经元。Bonner等的实验结果也证实了这个推测[10]。
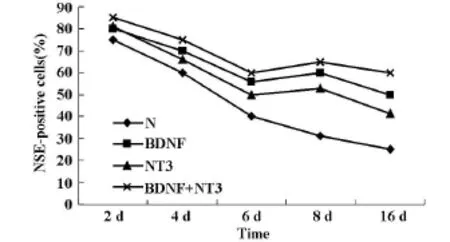
图2 NTFs转染后不同时间脊髓神经元存活的变化
本实验分离培养的脊髓神经元24 h后,可见大部分细胞贴壁呈现均匀分布,细胞突起明显。随培养时间延长,神经元细胞突起增多形成网络。分别在培养的不同时间检测NSE阳性细胞率,结果显示,体外培养的脊髓神经元存活率随培养时间延长下降,但NTFs作用的脊髓神经元存活率明显高于对照组(P<0.05),而且BDNF+NT3作用组的神经元存活率与各实验组相比存活率最高。
脊髓损伤修复的机制虽然还不清楚,但目前的大量研究已经证实神经营养因子在脊髓损伤后的修复起到了关键性的作用。虽然各种因子由于其自身的特异性,使其发挥效应的途径不尽相同,但总的来说神经营养因子在脊髓损伤后的修复是不可缺少的。随着研究的不断深入和对神经营养因子认识的不断加深,脊髓损伤的治疗将会取得更大的发展。
[1]Beattie MS,HermannGE,Rogers RC,et al.Cell death in models of spinal cord injury[J].Prog Brain Res,2002,137:37.
[2]Widenfalk J,Lundströmer K,Jubran M,et al.Neurotrophic factors and receptors in the immature and adult spinal cord after mechanical injury or kainic acid[J].J Neurosci,2001,21(10):3457.
[3]Gulino R,Lombardo SA,Casabona A,et al.Levels of brain-derived neurotrophic factor and neurotrophin-4 in lumbar motoneurons after low-thoracic spinal cord hemisection[J].Brain Res,2004,1013(2):174.
[4]Bjartmar C,Wujek JR,Trapp BD.Axonal loss in the pathology of MS:consequences for understanding the progressive phase of the disease[J].J Neurol Sci,2003,206(2):165.
[5]禹晓东,罗卓荆,张 琳.嗅鞘细胞对培养脊髓神经元生长状态的影响[J].中华神经外科疾病研究杂志,2006,5(1):40.
[6]Plunet W,Kwon BK,Tetzlaff W.Promoting axonal regeneration in the central nervous system by enhancing the cell body response to axotomy[J].J Neurosci Res,2002,68(1):1.
[7]Obata K,Noguchi K.BDNF in sensory neurons and chronic pain[J].Neurosci Res,2006,55(1):1.
[8]Johnson PJ,Tatara A,Shiu A,et al.Controlled release of neurotrophin-3 and platelet-derived growth factor from fibrin scaffolds containing neural progenitor cells enhances survival and differentiation into neurons in a subacute model of SCI[J].Cell Transplant,2010,19(1):89.
[9]Zhang L,Gu S,Zhao C,Wen T.Combined treatment of neurotrophin-3 gene and neural stem cells is propitious to functional recovery after spinal cord injury[J].Cell Transplant,2007,16(5):475.
[10]Bonner JF,Blesch A,Neuhuber B,et al.Promoting directional axon growth from neural progenitors grafted into the injured spinal cord[J].J Neurosci Res,2010,88(6):1182.
