荧光定量RT-PCR检测沙门氏菌方法的建立
2011-06-13苏明权马越云肖凤静彭年才郝晓柯
杨 柳,苏明权,马越云,焦 刚,常 亮,肖凤静,李 明,彭年才,郝晓柯*
(1.第四军医大学西京医院全军临床检验医学中心,陕西西安710032;2.西安天隆科技有限公司,陕西西安710043)
沙门氏菌是一种常见、重要的人兽共患病原菌,在公共卫生学上具有重要意义[1]。沙门氏菌是主要的肠道致病菌,易引起食物中毒。在我国,以沙门氏菌引起的食物中毒占细菌性食物中毒的首位[2]。目前对食品中的沙门氏菌检测手段仍采用常规生物学培养鉴定法辅以抗原和抗体的免疫学检测技术,病原微生物分离培养、生理生化鉴定、血清分型和免疫酶等表型特征检测方法,常规方法繁琐、耗时耗力,不能满足日益发展的需要。因此,为有效地预防和控制疾病发生,建立快速、敏感而又特异的检测沙门氏菌的方法是非常必要的。本研究根据沙门氏菌全基因组中fimY基因序列设计特异性引物和探针,采用实时荧光定量PCR技术,建立沙门氏菌实时荧光定量PCR检测方法,为食源性沙门氏菌污染的快速检测提供方法学支持。
1 材料和方法
1.1 材料
1.1.1实验菌株 伤寒沙门氏菌(ATCC14028)购自中国菌种保藏中心;大肠杆菌、金黄色葡萄球菌、绿脓杆菌、白色念珠菌、福氏痢疾志贺氏菌、肠球菌为本科经临床分离鉴定后的保存菌株。
1.1.2仪器和试剂 所用仪器为美国ABI公司的PE7700型基因定量扩增仪和西安天隆科技有限公司的TL580型荧光定量PCR仪;主要试剂为PCR Mix、Taq酶、dNTP、细菌基因组DNA 抽提试剂盒均购自TaKaRa公司。
1.1.3引物和探针的设计与合成 采用沙门氏菌fimy基因序列[4]设计引物和探针,以FAM为报告基团,以TAMRA为淬灭基团,引物和探针均由TaKaRa公司合成。其引物和探针序列分别为:
上游引物:5′-TCGTCATTCCATTACCTACC-3′;
下游引物:5′-AAACGTTGAAAAACTGAGGA-3′。
探 针 序 列:5′ FAM-TCTGGTTGATTTCCTGATCGCA-TAMRA3′。
1.2 方法
1.2.1沙门氏菌重组标准品的制备
1.2.1.1目的基因的扩增 以伤寒沙门氏菌作为实验菌株提取模DNA,应用所设计的引物对进行PCR扩增,产物经1.5%琼脂糖凝胶电泳,获的目的扩增片段,产物回收纯化后测吸光度定量。
1.2.1.2目的片段与载体的连接 在10 μ l连接反应体系中,包括:2 ×Buffer 5 μ l,PGEM-T-easy vector 1 μ l,PCR 产物 2 μ l,T4 DNA 连接酶 1 μ l,用无菌水补足至10 μ l,轻轻混匀,室温放置1 h,4℃过夜连接。
1.2.1.3重组质粒的转化 取上述连接产物1 μ l加入100 μ l新鲜配制的E coli JM109感受态细胞中,轻轻混匀,即冰浴30 min,42℃热休克90 s,即冰浴2 min后,加入 800 μ l预热的 LB培养液中,37℃220 rpm/振摇1 h。12 000 rpm/离心 5 min,弃上清剩余约100 μ l菌液,混匀,用L型玻棒均匀涂布于含Amp+/IPTG/X-Gal的筛选平板,37℃培养过夜,同时设定未转化菌作为阴性对照。
1.2.1.4重组质粒的鉴定 挑取经Amp/IPTG/XGal抗性筛选出的白色转化的菌落,与LB培养液(含有Amp+)中,进行小量增菌,37℃220 rpm/振摇过夜。对重组质粒进行PCR,T-A克隆阳性的菌落提取质粒,送宝生物公司进行测序。
1.2.2重组质粒标准品标准曲线的绘制 将鉴定好的重组质粒,测A值,计算出原始拷贝数,然后按比例稀释成1011-101拷贝数/ml浓度梯度,加入25 μ l反应体系,置实时荧光定量PCR扩增仪上进行扩增,反应条件为94℃预变性10 min,95℃变性25 s,60℃退火30 s,进行40个循环。反应结束后在计算机上自动形成标准曲线。
1.2.3荧光定量PCR检测体系的建立 在 25 μ l反应体系中,PCR Master Mix(包括10×PCR缓冲液,MgCl2,dNTP,DNA 聚合酶等)12.5 μ l,上、下游引物(10 μ mol/L)各 0.5 μ l,探针(10 μ mo1/L)0.5 μ l,DNA模板 0.5 μ l,用灭菌重蒸水补足 25 μ l。荧光定量PCR反应条件:94℃预变性10 min,95℃变性25 s,60℃退火30 s,进行40个循环。
1.2.4沙门氏菌荧光定量PCR方法实验条件的验证
1.2.4.1特异性实验 分别以伤寒沙门氏菌、大肠杆菌、金黄色葡萄球菌、白色念珠菌、绿脓杆菌、福氏痢疾志贺氏菌、肠球菌制备模板,用所建立的荧光定量PCR方法进行特异性验证。
1.2.4.2敏感性实验 将制备的沙门氏菌重组质粒,利用核酸蛋白分析仪检测其浓度并换算为拷贝数,用无菌水10倍系列稀释,每个稀释度取2 μ l作为模板,进行荧光定量PCR扩增,测定其最低检测值。
1.2.4.3重复性实验 取3种不同浓度(1010、107和104)沙门氏菌重组质粒,经重复性扩增实验,观察沙门氏菌荧光定量PCR扩增体系的重复性效果。
1.2.4.4稳定性实验 将自制的沙门氏菌荧光定量扩增体系混合后分装,-20℃冷冻保存,定期取出检测。
1.2.4.5模拟标本的检测 将沙门氏菌制备一定浓度的菌悬液,分别加入到1%的奶粉生理盐水中混匀,应用裸磁粒子吸附奶粉中的沙门氏菌后提取模板DNA,进行荧光定量PCR扩增,同时以分离培养作对照。
1.2.4.6临床粪便标本的检测 将可疑的粪便标本约1 g于15 ml无菌离心管中,加10ml无菌生理盐水,充分振荡混匀,应用裸磁粒子吸附粪便中的沙门氏菌后提取模板DNA,进行荧光定量PCR扩增,同时以分离培养作对照。
2 结果
2.1沙门氏菌标准品重组质粒购建结果从沙门氏菌基因组DNA,用伤寒沙门氏菌扩增引物进行PCR扩增,产物经10 g/L琼脂糖凝胶电泳获得约119 bp大小片段(图1)。产物纯化回收后将产物克隆至载体,提取质粒酶切后送Takara公司进行测序,结果证明扩增片段与序列完全相符。
2.2沙门氏菌标准曲线的绘制将制备的沙门氏菌重组质粒标准品,按原液、101-1011浓度进行稀释,采用本文所建立的荧光定量扩增体系进行扩增,结果重组质粒标准品浓度在104-1010可形成较为理想的扩增曲线(图2)和标准曲线(图3)。
2.3最低检测限结果将标准品原液作梯度稀释成101-109拷贝/ml,进行荧光定量PCR扩增,结果显示本方法最低检测限为103拷贝/ml,相当于100个菌细胞。
2.4特异性实验结果以伤寒沙门氏菌和6种其它细菌制备的基因组DNA为模板,进行荧光定量PCR扩增,结果除沙门氏菌外,其他6种相关细菌均响应(图4),证实有较好的特异性。
2.5稳定性实验结果将-20℃冷冻保存的沙门氏菌荧光定量扩增体系,以104、107、1010重组质粒为模板,分别在1周、1个月到6个月间分别进行荧光定量PCR扩增,结果在6个月内三种重组质粒的测 定CT值无明显的变化(表1)。

图1 沙门氏菌PCR扩增结果

图2 沙门氏菌重组质粒标准品的扩增曲线图
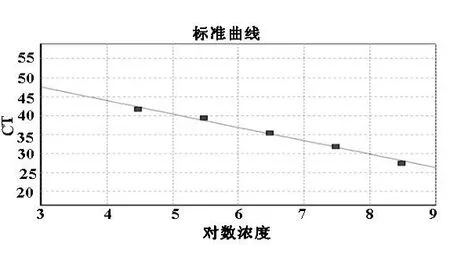
图3 沙门氏菌重组质粒标准曲线图
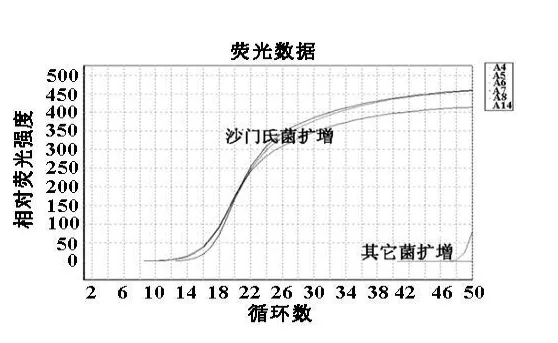
图4 特异性实验结果

表1 沙门氏菌荧光定量扩增体系的稳定性检测结果
2.6重复性实验结果对3种1010、107和104浓度沙门氏菌重组质粒,经重复性扩增实验,测定结果进行统计学分析,结果,1010循环阀值分别为:20.59、21.05,平均阀值为:20.82±0.33,变异系数为:1.56%,;107循环阀值分别为:31.40、31.37平均阀值为:31.39±0.02,变异系数为:0.07%;104循环阀值分别为:39.40、39.88,平均阀值为:39.14±0.37,变异系数为:0.94%,显示具有良好的重复性。
2.7模拟感染标本的检测结果取10份模拟污染奶粉标本,分别采用荧光定量PCR法和分离培养法进行同步检测,结果二种方法均能对奶粉中的沙门氏菌进行有效检出,二者符合率为100%。
2.8临床标本的检测应用实时荧光定量PCR方法和分离培养法分别对35份粪便标本进行对比检测,结果:荧光定量PCR法阳性16份,阳性检出率为:45.7%;分离培养法阳性14份,阳性检出率:40.0%。结果显示,荧光定量PCR法和分离培养法均能对粪便标本中的沙门氏菌进行有效的检出,而荧光定量PCR法快速(4 h)与分离培养法(3-4天)相比时间大为缩短。
3 讨论
荧光定量PCR技术是在常规PCR技术发展起来的一种新的核酸定量技术,PCR检测沙门氏菌的特异性,取决于所选择的扩增靶序列是否为沙门氏菌高度保守的特异性片断,能否忠实地扩增靶序列,由人工合成的一对寡核苷酸引物和探针序列决定。反之,引物设计又取决于沙门氏菌是否具有显著特征的属或种特异性靶序列,显然靶序列的选择和引物和探针的设计是试验成功与否的关键。目前用于沙门氏菌PCR检测的基因主要有:agfA、fimA、iagAB、IS200、invA、iroB、mkfA、ompC 和viaB 等基因[3-6]。但某些基因存在一些问题,如采用IS200会产生假阳性,会扩增志贺氏菌等,采用invA基因还可造成假阴性或漏检,而且它还会扩增一些非沙门氏菌,造成假阳性。另外,上述有些基因只适用于检测某些沙门氏菌,而非沙门氏菌属,显然也不应采用。沙门氏菌fimY基因序列与Gen Bank网络数据库中登录的所有物种核苷酸序列进行比对的结果,以及生物信息学方法证明,该基因在沙门氏菌内高度保守,而相对于其它物种则具有高度特异性。所以采用沙门氏菌fimY基因序列设计沙门氏菌检测的特异引物和探针更具特异性和实用性[7,8]。
实时荧光定量PCR方法学建立的关键是要有可靠稳定的标准品,为保证所建立方法的准确性和可靠性,本研究首先成功构建沙门氏菌重组质粒标准品,并对方法学建立的实验条件进行探索。结果显示,利用本研究所设计的引物和探针建立的扩增体系,经实时荧光定量PCR扩增对沙门氏菌和其它相关细菌的检测证实具有较好的特异性;敏感性检测结果分析显示,本方法的最低检测限为103拷贝/ml,相当于100 cfu/ml;并具有良好的稳定性和重复性。实验结果证实,利用实时荧光定量PCR方法快速检测沙门氏菌,不仅能快速检测食(乳)品中的沙门氏菌,还可直接用于临床粪便中沙门氏菌的诊断。
[1]张艳红,吴延功,杜元钊,等.沙门氏菌快速检测方法研究进展[J].动物医学进展,2001,22(2):39.
[2]Manzano M,Cocolin L,Astori G,et al.Development of a PCR microplatecapture hybridization method for simple,fast and sensitive detection of Salmonella serovars in food[J].Molecular and Cellular Probes,1998,12:227.
[3]Cohen HJ,Mechanda S.PCR Amplification of the fimA Gene sequence of Salmonella typhimurium,a specific method for Detection of Salmonella spp[J].Applied and Environmental Microbiology,1996,62(12):4303.
[4]Dinjus U,Hanel I,Bauerfeind R,et al.Detection of the induction of Salmonella enterotoxin gene expression by contact with epithelial cells with RT-PCR[J].FEMS Microbiol Lett,1997,146(2):175.
[5]Kubori TY,Matsushima.Supramolecular structure of the Salmonella typhimurium type III protein secretion system[J].Science,1998,280:602.
[6]Mahon J,Lax AJ.A quantitative polymerase chain reaction method for the detection in avian faeces of Salmonella carrying the spvR gene[J].Epidemiological Infection,1993,111:455.
[7]Yeh K S,Chen T H,Liao C W,et al.International Journal of FoodMicrobiology,2002,78():227.
[8]李光伟,邱杨,肖性龙,等.沙门氏菌荧光实时定量PCR检测试剂的研制及应用[J].微生物学通报,2007,34(3):496.
