雷公藤内酯醇及其衍生物的神经保护作用及机制
2011-06-12崔艳秋王晓民
崔艳秋 陆 莉 王晓民
(1.首都医科大学燕京医学院基础医学系,北京 101300;2.首都医科大学基础医学院药理系,北京 100069;3.首都医科大学基础医学院神经生物学系,教育部神经变性病学重点实验室,北京 100069)
雷公藤(tripterygium wilfordiihook.f.)又名水莽草、黄药、黄藤、黄藤木、黄腊藤、菜虫药、断肠草等,为卫矛科雷公藤属多年生藤本植物,是我国的传统中药。最早收载于《神农本草经》,称其为“莽草”,其“味辛温。主风头痈肿、乳痈、疝瘕,除结气疥搔,杀虫鱼。生山谷。”明代李时珍的《本草纲目》中对雷公藤也有记载。雷公藤根、茎、花均有毒性,药用部分为去二层皮的根木质部,具有活血化瘀、清热解毒、消肿散结、杀虫止血等功效。现代医学中雷公藤的应用也十分广泛,药理及临床研究证实,雷公藤具有抗炎、抗肿瘤、免疫调节等多种活性,临床上广泛用于类风湿性关节炎、肾病综合征、系统性红斑狼疮、器官移植排斥反应等多种免疫异常性疾病的治疗。
1 雷公藤内酯醇及其衍生物
雷公藤提取物的化学成分极其复杂,自1936年首次从雷公藤根部提取到萜类色素雷公藤红素(tripterine)后,迄今已从雷公藤中提取分离出100余种成分[1]。研究分析表明雷公藤含有二萜、三萜、倍半萜、生物碱等多种有效成分及糖类、有机酸、卫茅醇、色素及无机盐等多种化学物质。其中,二萜类化合物为雷公藤的主要活性成分,三萜和生物碱亦具活性。
雷公藤内酯醇(triptolide,T10),又名雷公藤甲素,外观呈白色针状结晶体,是雷公藤中含量最高、活性和毒性最强的原生化合物,也是雷公藤的主要活性成分。T10是小分子脂溶性物质,T10相对分子量为360,分子结构如图1A。T10是一种具有松香烷骨架的二萜,含有3个环氧基团和一个α,β-不饱和五元内酯环,这些基团在一定条件下会发生反应,其中C-12,13环氧远离A,B环,空间位阻较其他两个环氧基团小,在亲核离子的进攻下容易发生开环反应而被修饰[2]。雷公藤氯内酯醇(tripchlorolide,T4)是从雷公藤中提取出的一种微量的二萜单体化合物[3],相对分子量为397,分子结构如图1B。Yu D Q等[2]以亲核试剂攻击T10的C-12和13位,再将12位羟基酰化并氯化修饰后亦得到T4。作为T10的衍生物,T4不仅提高了母体化合物的溶解性和免疫抑制活性,也使其毒性大大降低[3]。此外,以T10为先导化合物,将C-5羟化修饰,亦可获得新化合物——5-羟雷公藤内酯醇〔(5R)-5-hydroxytriptolide,又名 LLDT-8〕,该化合物相对分子量为376.4,分子结构如图1C。Zhou R等[4]通过一系列体内外实验证实,LLDT-8也是一个低毒、高效、具有很强免疫抑制活性的新型雷公藤二萜化合物。Wong K F等[5]对T10及其衍生物进行构效关系研究,结果显示 C-14 位的 β-羟基(β-hydroxyl)和 γ-丁内酯(γ-butyrolactone)结构是其发挥抗炎及免疫调节作用的主要活性基团。
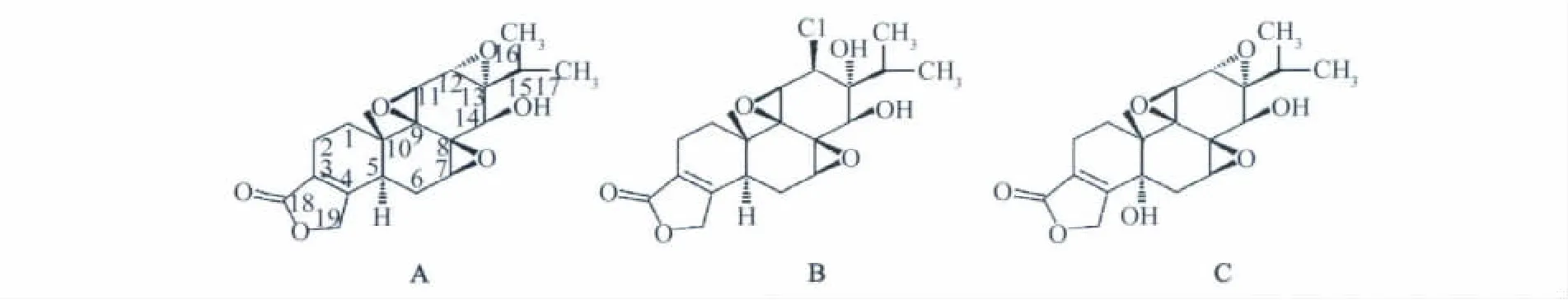
图1 雷公藤内酯醇及其衍生物的分子结构式Fig.1 Structures of triptolide and its analogues
2 T10及其衍生物的神经保护作用
2.1 帕金森病
帕金森病(Parkinson’s disease,PD)是一种常见的神经系统退行性疾病,其病理特征是中脑黑质多巴胺(dopamine,DA)能神经元渐进性的变性死亡,纹状体内DA含量明显下降,从而表现出以静止性震颤、运动迟缓、肌僵直和姿势步态异常为主要特征的临床症状[6]。大量在体和离体实验的研究结果均表明T10及其衍生物对PD动物及细胞模型具有明确的神经保护作用。Zhou H F 等[7]的研究发现,T10(5 μg/Kg-1·d)预处理24 d能够显著改善黑质区注射脂多糖(lipopolysaccharide,LPS)引起的大鼠黑质DA能神经元减少和纹状体DA含量下降。Gao J P等[8]亦证实,T10能够在保护1-甲基-4-苯基吡啶离子(1-methyl-4-phenyl pyridinium,MPP+)注射于大鼠黑质部位所引起DA能神经元进行性损伤和明显的行为异常。横断内侧前脑束(medial forebrain bundle,MFB)可直接损伤黑质致密部DA能神经元,引起纹状体DA能纤维变性损伤;T4能够显著改善单侧MFB横断引起的大鼠行为异常,抑制黑质DA能神经元的损伤和纹状体DA含量下降[9]。此外,T4还对1-甲基-4-苯基-1,2,3,6 四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)作用于 C57BL/6 小鼠引起的行为改变和黑质纹状体DA系统损伤具有明显的保护作用[10]。在离体实验中,T4能够促进原代培养的中脑神经元轴突的生长,对抗MPP+所致的DA能神经元损伤[9];在原代培养的神经元-胶质细胞混合培养体系中,T10能够明显对抗LPS所引起的DA摄取减少、TH免疫阳性神经元缺失和形态异常[11]。综上所述,T10及其衍生物能够在体内和体外实验中拮抗多种神经毒性物质对DA能神经元的损伤作用。
2.2 阿尔茨海默病
阿尔茨海默病(Alzheimer’s disease,AD)是以进行性痴呆为主要临床特征的神经系统退行性疾病,其标志性的病理改变是多发于皮层和海马的β淀粉样蛋白(β-Amyloid,Aβ)沉积、老年斑(senile plaques,SP)形成、神经元内神经纤维缠结(neurofibrilar tangle,NFT)、神经元减少以及轴索和突触异常等。Chen L F等[12]的实验发现T4能够明显改善海马内注射Aβ1-40引起的阿尔茨海默病大鼠模型的学习记忆能力下降,抑制小胶质细胞的活化。体外实验[13]也显示T10对Aβ导致的PC12细胞损伤具有明显的保护作用。Wu M等[14]将Aβ1-42作用于原代培养的皮层神经元,引起神经元大量死亡,而T4能够增加神经元的存活率,减少Aβ1-42引起的神经元凋亡。上述结果提示,T10及其衍生物能够保护Aβ引起的神经元损伤,并改善动物的行为异常。
2.3 多发性硬化
多发性硬化(multiple sclerosis,MS)是一种中枢神经系统炎性反应性脱髓鞘疾病,其发病机制与CD4+T淋巴细胞介导的中枢神经系统免疫反应有关,发病的关键是血脑屏障受到破坏,炎性细胞侵入中枢神经系统导致。MS的病理表现在许多方面与实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)有相似之处,因此 EAE是研究人类MS理想的动物模型。Fu Y F等[15]的研究发现LLDT-8可以减少髓鞘少突胶质糖蛋白(myelin oligodendroglia glycoprotein,MOG)引起的 EAE发病,降低EAE严重程度。Kizelsztein P等[16]亦证实口服 T10可以使小鼠EAE发病延迟,临床症状减少,复发率降低。这些结果说明,T10及其衍生物能够对抗EAE所致的神经损伤。
3 T10及其衍生物的神经保护作用机制
3.1 抑制小胶质细胞活化和炎性反应因子的释放
小胶质细胞是脑内重要的免疫细胞,正常时占脑内细胞总数的10%左右。在内源性或外源性损伤因素的刺激下,小胶质细胞过度激活,合成和分泌大量细胞毒性物质,在中枢神经系统炎性损伤和神经退行性疾病的发病过程中扮演重要角色。体外实验[17-18]显示,T4可以抑制Aβ1-42或LPS活化的小胶质细胞合成和释放一系列炎性反应因子如:TNFα、IL-1β、NO、PGE2等,并下调 iNOS、COX2等酶的表达。Zhou H F 等[7]和Jiao J等[19-20]在离体和在体实验中均证实T10可以抑制LPS和Aβ1-42引起的小胶质细胞异常活化和炎性反应因子 TNFα、IL-1β和 NO生成增多。另有研究[15,21]报道,T10 和 LLDT-8 均可以通过抑制炎性反应因子IL-2和/或IFN-γ释放来减少EAE的发病率和严重程度。Ma C G等[21]的研究还发现T10可以上调具有抑制炎性反应作用的细胞因子IL-10的表达。上述结果表明,T10及其衍生物可以通过抑制小胶质细胞的活化和炎性反应因子的释放,从而减弱炎性反应损伤过程,发挥神经保护作用。
3.2 抑制MAPKs和NF-κB信号通路
丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)是细胞内的一类丝氨酸/苏氨酸蛋白激酶,它存在于大多数细胞内,是真核细胞转导细胞外信号到细胞内引起细胞反应的一类重要信号系统,是联系细胞膜受体与细胞内重要调节靶点的酶类。MAPKs通过调控基因的转录表达,从而影响细胞的生物学行为,如生长发育、炎性反应及应激反应等。目前,在真核细胞中已发现有4条MAPKs信号转导通路:细胞外调节激酶(extracellular signal-regulated kinase,ERK)通路,p38 MAPK通路、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)/应激活化蛋白激酶(stress-activated protein kinase,SPAK)与ERK5/大丝裂素活化蛋白激酶1(big MAP kinase 1,BMK1)。它们可被不同的细胞外信号激活,从而产生不同的生物效应[22]。在原代培养的小胶质细胞,T4可以抑制Aβ引起的JNK磷酸化,从而减少下游炎性反应因子的释放[18]。T10则在LPS活化的巨噬细胞和小胶质细胞均能抑制JNK的活化,而对ERK和p38 MAPK通路则没有影响[23-24]。说明JNK可能是T10及其衍生物抑制炎性反应因子的释放,发挥神经保护作用的重要分子靶点。
核因子-κB(nuclear factor kappa B,NF-κB)是一种普遍存在于真核细胞中的快反应转录因子,在静息状态下与抑制性蛋白IκB结合并以非活性状态存在于胞质内。抑制状态的NF-κB对环境的变化比较敏感,可以被多种刺激激活,转入细胞核内调节一系列参与免疫、炎性反应及凋亡的基因表达。NF-κB的激活参与AD、PD的病理过程,并在Aβ或LPS介导的小胶质细胞的炎性反应中发挥重要作用[24]。大量研究[18,24-28]已证实雷公藤提取物能够抑制多种免疫细胞,包括T淋巴细胞、树突状细胞、巨噬细胞、小胶质细胞和星形胶质细胞等的细胞内NF-κB活化,或者通过稳定 NF-κB/IκBα 复合物,抑制 IκBα 磷酸化和 NF-κB核转位从而减轻炎性发应[16]。提示转录因子NF-κB也是T10及其衍生物发挥神经保护作用和抑制神经免疫炎性反应的重要靶点。
3.3 抗氧化活性
氧化应激(oxidative stress)是指机体内自由基的产生与清除失去平衡,或外源性氧化剂的过量摄入导致自由基在体内堆积引起细胞毒性。过量的自由基进攻多不饱和脂肪酸可引起脂质过氧化,导致生物膜结构和功能的改变;损伤蛋白质的巯基和氨基使蛋白质变性、交联,使酶的活性丧失;损伤DNA可导致细胞突变。氧化应激与多种神经系统炎性反应和退行性疾病的发病及进展密切相关[29]。Pan X D 等[17]的研究发现,T4能够抑制LPS引起的小胶质细胞内活性氧自由基生成增加。He Q H等[30]的研究也证实,T10能抑制谷氨酸引起的PC12细胞内ROS生成和线粒体膜电位升高。上述结果提示,T10及其衍生物具有一定程度的抗氧化活性并与其神经保护作用密切相关。
3.4 促进神经营养因子释放
脑内神经元的分化、成熟、存活以及突触建立都需要神经营养因子(neurotrophic factor,NTFs)的参与。NTFs及其受体水平的改变可导致神经元死亡,神经系统损伤后神经组织修复和再生功能的异常进而导致某些神经系统退行性疾病的发生。NTFs家族由众多成员组成,其中与神经系统退行性疾病密切相关的NTFs主要有:神经生长因子(nerve growth factor,NGF)、脑源神经营养因子(brain derived neurotrophic factor,BDNF)、胶质细胞源神经营养因子(glial cell line-derived neurotrophic factor,GDNF)等。Xue B等[31]报道,T10不影响星形胶质细胞合成和释放BDNF和GDNF,但明显促进星形胶质细胞NGF mRNA的表达及细胞质和培养上清液的NGF蛋白水平。另有研究[9]显示,T4以剂量依赖的方式促进原代培养的中脑多巴胺能神经元BDNF mRNA的表达,并可放大NGF的神经营养作用。这些证据表明,T10及其衍生物通过调节神经营养因子的表达和释放发挥神经保护作用。
3.5 拮抗兴奋性神经毒性和Ca2+超载
兴奋性神经毒性是指由谷氨酸等兴奋性神经递质引起的以N-甲基-D-天冬氨酸 (N-methyl-D-aspartate,NMDA)受体为主的兴奋性氨基酸受体过度持续兴奋而导致神经元死亡的过程。在大多数病理情况下,NMDA受体过度兴奋介导的Ca2+内流引起的神经细胞迟发性损伤在兴奋性毒性作用中占主导地位。兴奋性神经毒性参与许多神经退行性疾病的发病及进展过程,正常状态下作为第二信使的Ca2+,在兴奋毒性损伤时,其含量的异常增高导致细胞结构和功能代谢的不可逆损伤,促进了兴奋毒性的发展。体外实验研究[13,30]表明,T10能够显著降低 Aβ 引起的细胞内Ca2+浓度升高,从而减轻Aβ对PC12细胞的损伤和毒性作用,也能明显拮抗谷氨酸诱导的PC12细胞凋亡。以上的结果提示T10可通过降低胞内Ca2+的浓度、抑制神经元钙超载,发挥神经保护作用。
目前,大量研究已经证实T10及其衍生物具有明确的神经保护作用,具体机制涉及抗炎和免疫调节、抗氧化应激、神经营养等多个方面(图2)。相信随着研究的不断深入,T10及其衍生物调控的靶分子和生物活性基团将会进一步明确,由此将开发出具有中国自主知识产权的高效的神经保护药物,从而使祖国的传统中药走向世界,为人类造福。
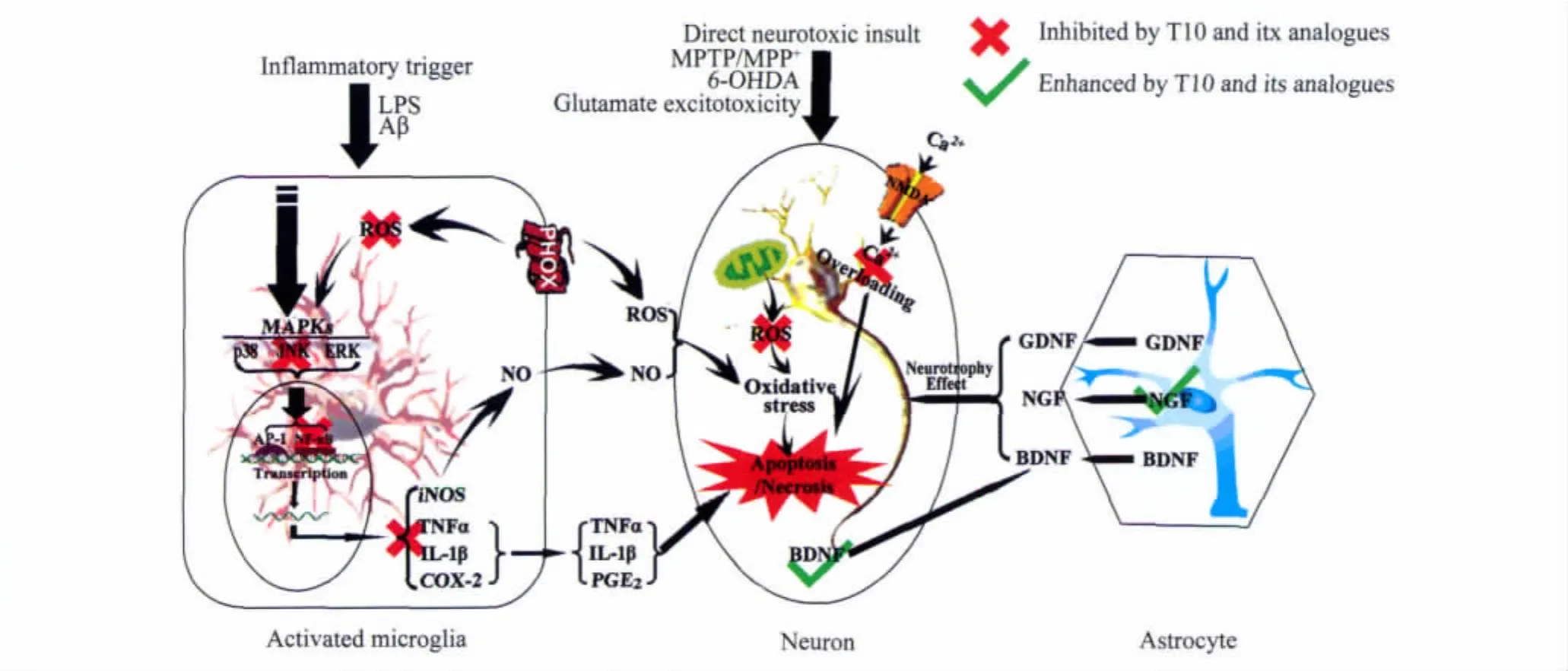
图2 T10及其衍生物神经保护作用机制Fig.2 Neuroprotective mechanisms of triptolide and its analogues
[1]Xue J,Jia X B,Tan X B,et al.Chemical constituents oftripterygium wilfordiihook.f and its toxicity[J].China J TCM and Pharmacy,2010,25(5):726-731.
[2]Yu D Q,Zhang D M,Wang W B,et al.Structure modification of triptolide,a diterpenoid fromtripterygium wilfordii[J].Acta Pharmaceutica Sinica,1992,27(11):830-836.
[3]Lu X Y,Ma P C,Chen Y,et al.The isolation and structure of tripchorolide(T4)from trypterygium wilfordii[J].Acta Academiae Medicinae Sinicae,1990,12(3):157-161.
[4]Zhou R,Zhang F,He P L,et al.(5R)-5-Hydroxytriptolide(LLDT-8),a novel triptolide analog mediates immunosuppressive effects in vitro and in vivo[J].Int Immunopharmacol,2005,5(13-14):1895-1903.
[5]Wong K F,Chan J K,Chan K L,et al.Immunochemical characterization of the functional constituents oftripterygium wilfordiicontributing to its anti-inflammatory property[J].Clin Exp Pharmacol P,2008,35(1):55-59.
[6]Lotharius J,Brundin P.Pathogenesis of Parkinson’s disease:dopamine,vesicles and alpha-synuclein[J].Nat Rev Neurosci,2002,3(12):932-942.
[7]Zhou H F,Liu X Y,Niu D B,et al.Triptolide protects dopaminergic neurons from inflammation-mediated damage induced by lipopolysacharide intranigral injection[J].Neurobiol Dis,2005,18(3):441-449.
[8]Gao J P,Sun S,Li W W,et al.Triptolide protects against 1-methyl-4-phenyl pyridinium-induced dopaminergic neurotoxicity in rats:implication for immunosuppressive therapy in Parkinson’s disease[J].Neurosci Bull,2008,24(3):133-142.
[9]Li F Q,Cheng X X,Liang X B,et al.Neurotrophic and neuroprotective effects of tripchlorolide,an extract of chinese herbtripterygium wilfordiihook.f,on dopaminergic neurons[J].Exp Neurol,2003,179(1):28-37.
[10]Hong Z,Wang G,Gu J,et al.Tripchlorolide protects against MPTP-induced neurotoxicity in C57BL/6 mice[J].Eur J Neurosci,2007,26(6):1500-1508.
[11]Li F Q,Lu X Z,Liang X B,et al.Triptolide,a Chinese herbal extract,protects dopaminergic neurons from inflammation-mediated damage through inhibition of microglial activation[J].J Neuroimmunol,2004,148(1-2):24-31.
[12]Chen L F,Wang X J,Xu G Y,et al.Effect of tripchlorolide on microglia activation in Alzheimer disease rat[J].Chinese Journal of Anatomy,2009,32(4):485-487.
[13]Gu M,Zhou H F,Xue B,et al.Effect of Chinese herbtripterygium wilfordiihook.f monomer triptolide on apoptosis of PC12 cells induced by Aβ1-42[J].Acta Physiologica Sinica,2004,56(1):73-78.
[14]Wu M,Zhu Y G,Pan X D,et al.Involvement of Wnt/beta-catenin signaling in tripchlorolide protecting against oligomeric beta-amyloid-(1-42)-induced neuronal apoptosis[J].Yao Xue Xue Bao,2010,45(7):853-859.
[15]Fu Y F,Zhu Y N,Ni J,et al.(5R)-5-Hydroxytriptolide(LLDT-8),a novel triptolide derivative,prevents experimental autoimmune encephalomyelitis via inhibiting T cell activation[J].J Neuroimmunol,2006,175(1-2):142-151.
[16]Kizelsztein P,Komarnytsky S,Raskin I.Oral administration of triptolide ameliorates the clinical signs of experimental autoimmune encephalomyelitis(EAE)by induction of HSP70 and stabilization of NF-κB/IκBα transcriptional complex[J].J Neuroimmunol,2009,217(1-2):28-37.
[17]Pan X D,Chen X,Zhu Y G,et al.Neuroprotective role of tripchlorolide on inflammatory neurotoxicity induced by lipopolysaccharide-activated microglia[J].Biochem Pharmacol,2008,76(3):362-372.
[18]Pan X D,Chen X C,Zhu Y G,et al.Tripchlorolide protects neuronal cells from microglia-mediated beta-amyloid neurotoxicity through inhibiting NF-kappa B and JNK Signaling[J].Glia,2009,57(11):1227-1238.
[19]Zhou H F,Niu D B,Xue B,et al.Triptolide inhibits TNF-α,IL-1β and NO production in primary microglial cultures[J].Neuroreport,2003,14(7):1091-1095.
[20]Jiao J,Xue B,Zhang L,et al.Triptolide inhibits amyloidβ1-42-induced TNF-α and IL-1β production in cultured rat microglia[J].J Neuroimmunol,2008,205(1-2):32-36.
[21]Ma C G,Fan H C,Yu J Z,et al.Triptolide inhibits EAE through downregulation of MMP-9/INF-γ and upregulation of IL-10[J].J Neurol Sci,2009,285(S1):S200-S201.
[22]Chang L,Karin M.Mammalian MAP kinase signalling cascades[J].Nature,2001,410(6824):37-40.
[23]Kim Y H,Lee S H,Lee J Y,et al.Triptolide inhibits murine-inducible nitric oxide synthase expression by down-regulating lipopolysaccharide-induced activity of nuclear factorκB and c-Jun NH2-terminal kinase[J].Eur J Pharmacol,2004,494(1):1-9.
[24]Gong Y T,Xue B,Jiao J,et al.Triptolide inhibites COX-2 expression and PGE2 release by suppressing the activity of NK-κB and JNK in LPS-treated microglia[J].J Neurochem,2008,107(3):779-788.
[25]Wang Y,Mei Y H,Feng D C,et al.Triptolide modulates T-cell inflammatory responses and ameliorates experimental autoimmune encephalomyelitis[J].J Neurosci Res,2008,86(11):2441-2449.
[26]Liu Q Y,Chen T Y,Chen G Y,et al,Immunosuppressant triptolide inhibits dendritic cell-mediated chemoattraction of neutrophils and T cells through inhibiting Stat3 phosphorylation and NF-κB activation[J].Biochem Bioph Res Co,2006,345(3):1122-1130.
[27]Wu Y Y,Cui J,Bao X F,et al.Triptolide attenuates oxidative stress,NF-kappa B activation and multiple cytokine gene expression in murine peritoneal macrophage[J].Int J Mol Med,2006,17(1):141-150.
[28]Dai Y Q,Jin D Z,Zhu X Z,et al.Triptolide inhibits COX-2 expression via NF-kappa B pathway in astrocytes[J].Neurosci Res,2006,55(2):154-160.
[29]Cuzzocrea S,Riley D P,Caputi A P,et al.Antioxidant therapy:a new pharmacological approach in shock,inflammation,and ischemia/reperfusion injury[J].Pharmacol Rev,2001,53(1):135-159.
[30]He Q H,Zhou H F,Xue B,et al.Neuroprotective effects and mechanism of tripteryygium wilforddi hook.f monomer triptolide on glutamate induced PC12 cell line damage[J].J Peking Univ(Health Sci),2003,35(3):252-255.
[31]Xue B,Jiao Ji,Zhang L,et al.Triptolide upregulates NGF synthesis in rat astrocyte cultures[J].Neurochem Res,2007,32(7):1113-1119.
