鸡血藤黄酮类有效部位对人非小细胞肺癌A549细胞凋亡与线粒体膜电位的影响
2011-06-12赵京霞梁代英罗晓琴王笑民
王 燕 李 萍 林 燕 赵京霞 刘 欣 何 薇 梁代英 罗晓琴 王笑民*
(1.北京市中医研究所,北京 100010;2.首都医科大学附属北京中医医院,北京 100010)
鸡血藤(spatholobus suberectus dunn)黄酮类有效部位是养血活血类中药,常用于肿瘤患者。研究[1-2]表明,鸡血藤提取物在体内、体外试验中均呈现抗肿瘤作用。采用聚酰胺柱色谱法从鸡血藤醇提取物中分离获得的富含黄酮类化合物组分“鸡血藤黄酮类有效部 位 (spatholobus suberectus column extract,SSCE)”,SSCE在体外试验中抑制肿瘤活性最强[3]。
本试验组选用敏感的肺癌细胞系A549细胞株作为研究对象,观察SSCE作用后细胞凋亡的情况及线粒体膜电位的改变,以探讨鸡血藤抗肿瘤的物质基础,为寻找新的高效低毒的新型抗癌先导化合物提供依据。
1 材料和方法
1.1 材料与仪器
恒温CO2培养箱(日本三洋公司),SA1000酶标仪(奥地利 Asyshitech公司),激光共聚焦显微镜FV500(日本Olympus公司)。
1.2 药品与试剂
SSCE由北京市中医研究所药化室制备。F12培养基(美国HyClone公司);胎牛血清(美国Gibco公司);胰蛋白酶(美国Gibco公司);细胞增生试剂盒cell counting kit-8(CCK-8,日本同仁化学公司),Annexin V-PI双染试剂盒(Cat K 101-25,美国BioVision公司),Hoechst染料(日本同仁化学公司),JC-1染料(北京碧云天公司),Mitotracker Red(Cat PA-3017,瑞士Lonza公司)。
1.3 细胞系及细胞培养
人肺腺癌A549细胞系购自协和细胞中心。细胞培养条件:F12培养基,含10%胎牛血清和1%双抗(青霉素100 U/mL,链霉素100 mg/L),置于37℃、5%CO2的恒温箱中培养。
1.4 细胞活性检测
采用CCK-8检测,取对数生长期细胞制成单细胞悬液,调细胞个数为2×107/L,接种于96孔板中,每孔100 μL,于37℃、5%CO2的恒温培养箱中培养24 h后,吸出上清液,每孔加入100 μL含SSCE或无SSCE的培养液。
实验分为4组,分别为:①对照组:A549细胞+完全F12培养;②低剂量组:A549细胞+40 mg/L SSCE;③中剂量组:A549细胞+80 mg/L SSCE;④高剂量组:A549细胞+160 mg/L SSCE。每组至少设3个副孔,培养24、48、72 h 后,每孔加入 10 μL CCk-8 溶液,培养 4 h,在酶标仪上测450 nm处吸光度A,并计算细胞增生抑制率(inhibition rate,IR),实验重复3次。
细胞增生抑制率(%)=(1-实验组A/对照组A)×100%。
1.5 细胞凋亡检测
1)Annexin V-PI双染法激光共聚焦显微镜观察:细胞以1×105/mL传送于Petri小皿中,分为对照组及SSCE 组(160 mg/L,作用24 h、48 h),用 PBS洗2次,分别加入 100 μL 1 × Binding Buffer缓冲液,5 μL Annexin V-FITC 和 5 μL PI,室温避光孵育 15 min,再加入400 μL 1×Binding Buffer缓冲液,激光共聚焦观察。激发波长Ex=488 nm;发射波长Em=530 nm。
2)Hoechst染色倒置荧光显微镜观察:将细胞传送于提前放置好洁净盖玻片的24孔板中,细胞密度1×105/mL,待细胞贴壁后,向孔内加入SSCE(160 mg/L),同时设正常对照组,SSCE作用24 h后,取出细胞爬片,于PBS溶液中漂洗3 min×3次,漂洗后于预冷的固定液中(甲醛与丙酮1∶1混合)固定细胞8 min,向固定好的细胞滴加 Hoechst33342(5 μmol/L 50 μL),37℃孵育15 min,取载玻片,每片上滴加1滴防荧光淬灭剂,将细胞片扣于载玻片上,于正置荧光显微镜下观察细胞核变化。
1.6 线粒体检测
1)JC-1染色激光共聚焦显微镜观察:细胞以1×105/mL传送于Petri小皿中,分为对照组及SSCE组(160、80、40 mg/L,作用 24 h),用 PBS 洗 2 次,加入JC-1(50 mg/L,200 μL),37 ℃孵育 20 min,激光共聚焦显微镜观察。JC-1是检测线粒体膜电位的荧光探针,在线粒体膜电位较高时,JC-1聚集在线粒体的基质(matrix)中,形成聚合物(J-aggregates),可以产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体(monomer),可以产生绿色荧光。这样就通过荧光颜色的转变来检测线粒体膜电位的变化。
JC-1单体的最大激发波长为514 nm,最大发射波长为529 nm;JC-1聚合物(J-aggregates)的最大激发波长为585 nm,最大发射波长为590 nm。实际观察时,使用常规的观察红色荧光和绿色荧光的设置即可。用软件计算红绿荧光比值。
2)Mitotracker Red染色激光共聚焦显微镜检测:细胞以1×105/mL传送于Petri小皿中,分为对照组及SSCE组(160 mg/L,作用24 h),用 PBS洗2次,加入 Mitotracker(5 mg/L,200 μL),37 ℃孵育 20 min,激光共聚焦显微镜观察。
1.7 统计学方法
数据采用SPSS 16.0软件处理,实验数据以均数±标准差(±s)表示。组间比较采用折因方差分析和均数的两两比较,以P<0.05为差异有统计学意义。
2 结果
2.1 SSCE对A549细胞活性的影响
相同处理时间不同浓度SSCE作用后,对细胞活性的影响与对照组相比差异均有统计学意义,低、中、高3个剂量的 SSCE作用24 h后,抑制率分别为10.29%、31.52% 和42.75%;各剂量 SSCE 处理 48 h后,抑制率分别为 27.15%、38.85% 和 57.49%;各剂量 SSCE处理 72 h后,抑制率分别为 15.13%、15.10%和 37.52%,详见表 1。
表1 不同浓度SSCE作用相同时间对A549细胞增生的影响Tab.1Effect of SSCE on the proliferation of A549 cells(±s)n=6
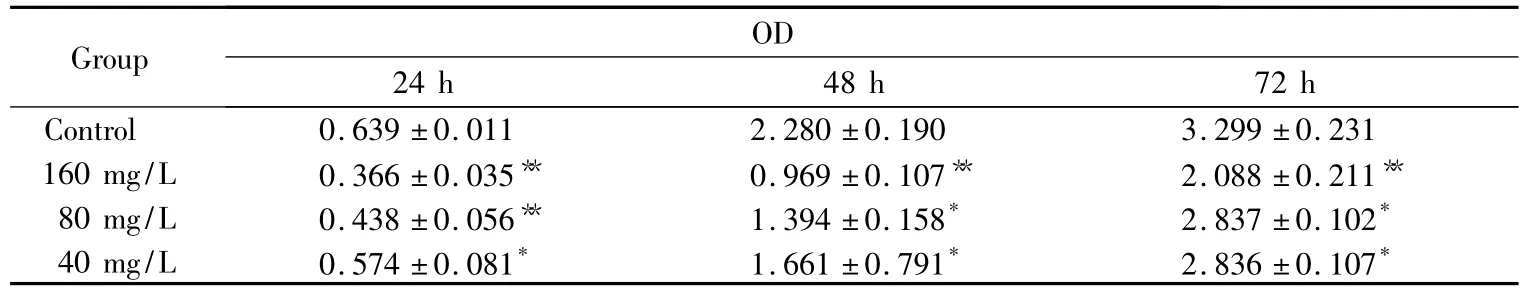
表1 不同浓度SSCE作用相同时间对A549细胞增生的影响Tab.1Effect of SSCE on the proliferation of A549 cells(±s)n=6
* P <0.05,** P <0.01 vs control;SSCE:spatholobus suberectus column extract;OD:optical density.In each group the time of reaction was the same,and the effects of different concentration of SSCE on cell proliferation were compared.
Group OD 24 h 48 h 72 h Control 0.639 ±0.011 2.280 ±0.190 3.299 ±0.231 160 mg/L 0.366 ±0.035** 0.969 ±0.107** 2.088 ±0.211**80 mg/L 0.438 ±0.056** 1.394 ±0.158* 2.837 ±0.102*40 mg/L 0.574 ±0.081* 1.661 ±0.791* 2.836 ±0.107*
2.2 SSCE对细胞凋亡的影响
磷脂酰丝氨酸(phosphatidylserine,PS)正常位于细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。发生PS外翻的细胞能够结合AnnexinV-FITC呈绿色荧光图像。凋亡晚期和死亡细胞能够被PI染成红色。因此,未被染色的为正常细胞,单染绿色荧光的为早期凋亡,红绿双染的为晚期凋亡,单染红色的为死亡细胞。SSCE在浓度160 mg/L作用于A549细胞24 h后,细胞单染绿色(图1B),表明发生了早期凋亡。作用48 h后,细胞呈红绿双染,表明为晚期凋亡(图1D)。

图1 SSCE作用24、48 h后Annexin V-PI染色激光共聚焦显微镜观察PS外翻Fig.1 Immunofluorescence staining of Annexin V-PI in SSCE incubated A549 cells(600×)
在荧光显微镜下观察,正常细胞的细胞核呈正常的蓝色,阳性对照组大量细胞的细胞核出现致密浓染,或呈碎块状致密浓染(图2A),而SSCE组在浓度160 mg/L作用24 h,部分细胞核出现致密浓染(图2B)。
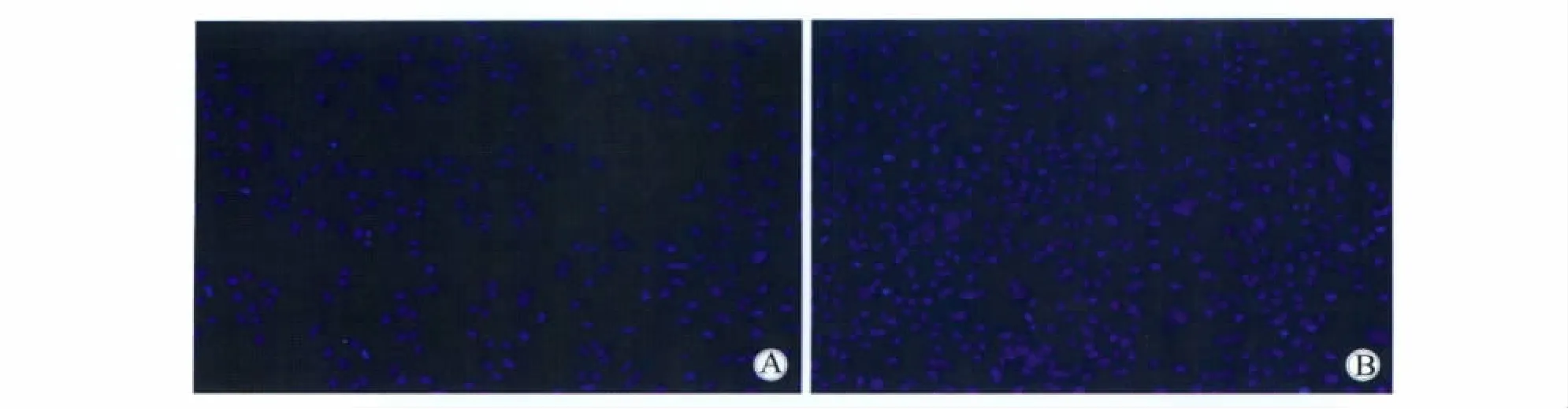
图2 SSCE作用24 h后Hochest33342染色倒置荧光显微镜观察细胞核Fig.2 Immunofluorescence staining of Hochest33342 in SSCE incubated A549 cells(100×)
2.3 SSCE对细胞线粒体的影响
SSCE作用于A549细胞24 h后,红色荧光向绿色荧光转变,绿色荧光与红色荧光比值升高,详见表2,图3。
正常细胞线粒体经染色后,呈均匀的棒状、颗粒状(图4A);SSCE作用于细胞24 h后,线粒体由颗粒状、棒状变为点状,并向细胞核聚集(图4B)。
表2 不同剂量SSCE作用A549细胞24 h后线粒体膜电位的改变Tab.2 Effect of SSCE on the mitochondrial membrane potential of A549 cells(±s)n=4

表2 不同剂量SSCE作用A549细胞24 h后线粒体膜电位的改变Tab.2 Effect of SSCE on the mitochondrial membrane potential of A549 cells(±s)n=4
** P <0.01 vs control;SSCE:spatholobus suberectus column extract.
SSCE Green fluorescence/Red fluorescence Control 0.557 ±0.082 160 mg/L 3.057 ±0.365**80 mg/L 2.426 ±0.440**40 mg/L 1.954 ±0.451**
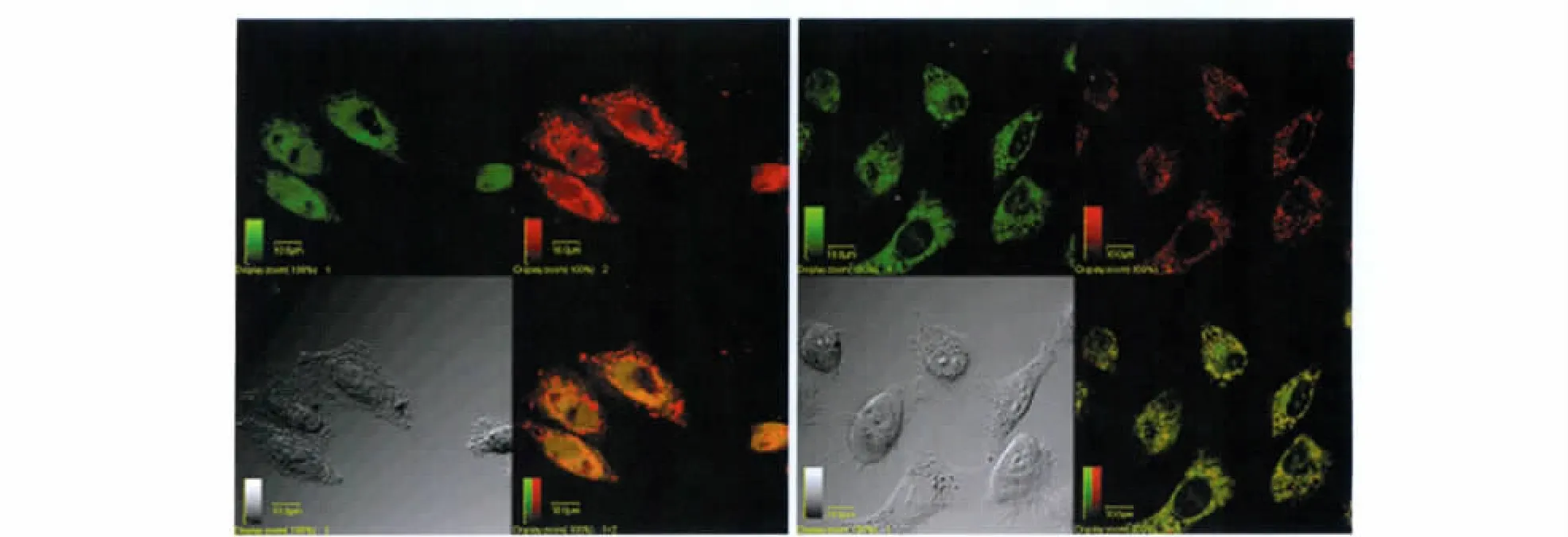
图3 SSCE作用24 h后JC-1染色激光共聚焦显微镜观察线粒体膜电位Fig.3 Immunofluorescence staining of JC-1 in SSCE incubated A549 cells(600×)
3 讨论
鸡血藤是一味养血活血中药,中医古籍记载用于治疗月经不调、血虚萎黄、风湿痹痛等症,药化分析发现其含有大量黄酮类化合物。现代药理学研究[3]证实鸡血藤具有刺激骨髓造血功效,近年来研究[3]发现鸡血藤粗提物及其总黄酮组分在细胞水平和整体的动物水平都表现出抗肿瘤活性,其中富含黄酮成分的有效部位SSCE在体外抑瘤作用最强。
人们一直以为细胞增生和分化的异常是肿瘤发生的主要原因,随着对细胞凋亡概念的引入,人们开始从细胞凋亡的角度审视肿瘤的发生[4]。细胞凋亡是细胞对内外刺激信号做出的应答反应,在机体的许多生理、病理过程中都起到重要的作用。
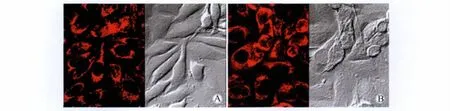
图4 SSCE作用24 h后Mitotracker red染色激光共聚焦显微镜观察线粒体形态Fig.4 Immunofluorescence staining of Mitotracker red in SSCE incubated A549 cells(600×)
线粒体不仅在细胞存活而且在细胞凋亡通路中起着核心作用。细胞凋亡过程中,线粒体形态和功能均发生显著变化。线粒体跨膜电位的下降或线粒体膜通透性转运孔开放是调节细胞凋亡的中心环节。在致凋亡因子的刺激下,线粒体膜通透性转运孔开放,线粒体跨膜电位降低或丧失,线粒体基质中释放出凋亡蛋白使细胞凋亡。刘丽启等[5]报道线粒体跨膜电位的耗散是细胞凋亡级联反应过程中最早发生的时间,而一旦线粒体跨膜电位耗散,细胞就会进入不可逆的凋亡过程。
本研究前期实验通过流式细胞仪对PS及细胞周期进行了检测,发现SSCE可以使细胞周期S期细胞增多,G0-G1和G2-M期细胞减少。本研究结果进一步证实,SSCE作用于细胞24 h后,PS表现外翻、细胞质固缩,线粒体由棒状变成点状,并向细胞核聚集,线粒体膜电位显著下降,有明显的凋亡特征;提示SSCE可能对线粒体凋亡通路发挥作用。
凋亡通路包括线粒体凋亡途径和死亡受体凋亡途径,随着细胞生物学研究的深入,新的细胞死亡途径逐渐被揭示出来,如胀亡、自噬、副凋亡等[6]。在细胞程序性死亡过程中,各种通路不是单独起作用的,而是相互交联的,有彼此重叠的机制出现。因此,SSCE诱导A549细胞凋亡的机制仍需进一步研究。
[1]唐勇,王笑民,何薇,等.鸡血藤提取物体外抗肿瘤实验研究[J].中国中医基础医学杂志,2007,13(4):306-308.
[2]薛丽君,韩景光,李定文.鸡血藤提取物的抗肿瘤作用研究[J].现代医药卫生,2009,25(1):3-5.
[3]富琦,唐勇,罗晓琴,等.鸡血藤SSCE体内抗肿瘤作用及机制研究[J].中国中药杂志,2009,34(12):1570-1573.
[4]汤睿,朱正纲.凋亡途径与肿瘤治疗[J].世界华人消化杂志,2005,13(20):2469-2472.
[5]刘丽君,彭建新,洪华珠,等.线粒体在细胞凋亡中的变化与作用[J].细胞生物学杂志,2005,27(2):117-120.
[6]敏云馨,马忠仁.细胞程序性死亡通路的研究进展[J].生物技术报,2009,11:20-23.
