PTTG、bFGF及PCNA在垂体腺瘤中的表达及其与侵袭性的关系
2011-06-12鲁润春贾桂军牛国栋徐志卿
鲁润春 贾桂军 冉 然 牛国栋 倪 明 徐志卿 贾 旺*
(1.首都医科大学附属北京天坛医院神经外科,北京 100050;2.首都医科大学基础医学院,北京 100069)
侵袭性垂体腺瘤是指垂体腺瘤向周围生长侵袭硬脑膜、神经、颈内动脉、骨质、海绵窦甚至长入脑室[1]。此肿瘤在临床上表现为疗效差、术后复发率高及内分泌学缓解率低,是神经外科的一个难题[2]。垂体腺瘤侵袭性发生的机制与细胞增生活性、细胞周期调节、细胞外基质调控、血管生成、癌基因及抑癌基因瘤等相关[3-4],但目前临床上尚无有效的垂体的生物学判定指标。本研究组从癌基因、血管生成调控及细胞增生活性相关的生物学因子出发,采用实时定量反转录PCR的方法对PTTG、bFGF及PCNA在转录水平的联合检测,旨在确定3者和垂体腺瘤侵袭性之间的关系,确定一个可靠的判断垂体腺瘤侵袭性的生物学指标。
1 材料和方法
1.1 临床资料
1.1.1 一般资料
研究病例选取首都医科大学附属北京天坛医院神经外科从2009年3月至2010年1月期间经蝶或开颅手术切除并经术后病理证实的垂体腺瘤65例。入组标准:①临床资料完整:包括临床表现、手术记录、病理、术前内分泌学检查、影像学资料等;②经蝶手术或开颅手术切除肿瘤,有可供研究的肿瘤组织(至少100 mg);③病理证实为垂体腺瘤。本组病例共收治符合标准的病人65例,男性32例,女性33例;其中侵袭组40例,非侵袭组25例,侵袭组中有复发/残留垂体腺瘤9例;所有病人术前均行内分泌学检查并术后行免疫组化确定内分泌类型:无功能型29例,泌乳素(prolactin,PRL)腺瘤6例,生长激素(growth hormone,GH)腺瘤9例,卵泡刺激素(follicle-stimulating hormone,FSH)腺瘤12例,促皮质激素(adrenocorticotropic hormone,ACTH)腺瘤3例,促甲状腺激素(thyroid stimulating hormone,TSH)腺瘤1例,混合性腺瘤5例(表1)。
1.1.2 侵袭分组标准
本组病例的侵袭性分组参考了Hardy-Wilson分级(手术+影像学),其中海绵窦侵袭是根据Knosp分级。侵袭性垂体瘤的判断标准:① 鞍底侵犯标准(以下任一条):肿瘤直径大于4 cm,蝶窦腔内见到肿瘤(鞍底骨质破坏);垂体瘤突破鞍底,向蝶窦内突出;斜坡骨质信号异常,边缘不光整。② 垂体瘤向上方侵袭的标准:突入第三脑室和/或侧脑室伴或不伴脑积水。③海绵窦侵袭(符合以下任意1条可诊断):颈内动脉(inter carotid artery,ICA)包绕程度大于等于67%(8/12);颈内动脉沟腔隙消失;肿瘤跨过ICA外侧连线;大于等于3个海绵窦腔隙消失;海绵窦下方腔隙或外侧腔隙消失。根据以上标准我们将本组病例分为侵袭组40例,非侵袭组25例,其中侵袭组中有复发或残留者9例。垂体瘤的侵袭性和其免疫组化病理类型的关系见表2。

表1 65例垂体腺瘤免疫组织化学分型Tab.1 Classification of 65 cases with pituitary adenoma according to immunohistochemical analysis
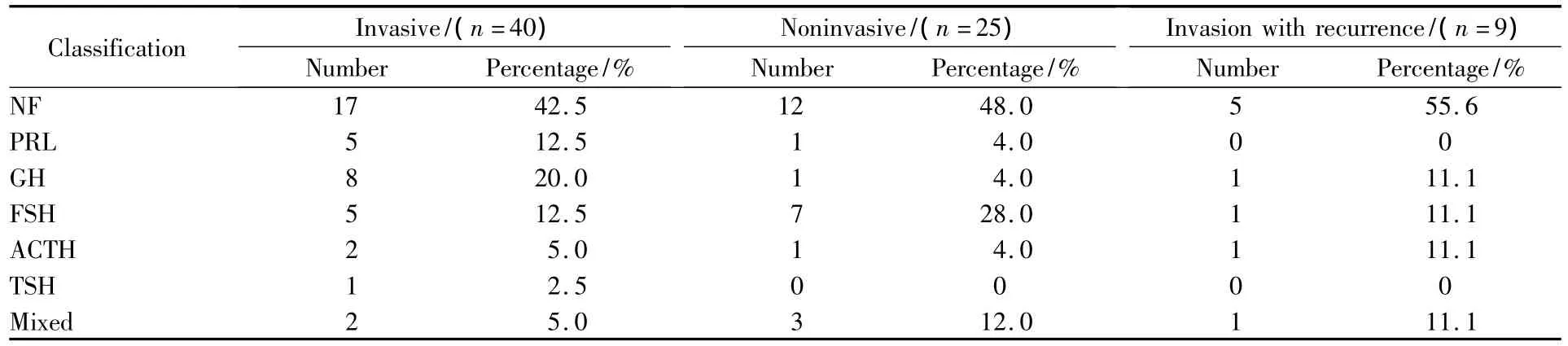
表2 65例垂体腺瘤病理类型和侵袭性的关系Tab.2 Immunohistochemical classification of 40 invasive PAs and 25 noninvasive PAs
1.2 实验方法及结果判定
1.2.1 实验方法
本实验组采用实时定量反转录PCR(RT-PCR)的方法对肿瘤标本中PTTG、PCNA及bFGF mRNA的表达水平进行检测。新鲜标本取材后立即分块储存于液氮中,mRNA提取采用RNase mini试剂盒(Invitrogen),反转录采用SuperScriptTMⅢ First-strand synthesis System for RT-PCR(Invitrogen),RT-PCR反应在7300实时PCR反应系统(Applied Biosystems)中完成,反转录采用的引物如下。

1.2.2 结果分析
应用相对定量分析软件进行分析,显示扩增曲线,比较各组目的基因表达量。整个实时定量PCR的过程是在7300实时PCR反应系统(Applied Biosystems)完成。荧光信号用7300系统SDS软件进行分析。
1.3 统计学方法
采用SPSS 13.0软件进行统计学分析。部分数据直接在实时PCR反映系统中进行分析计算。DNA表达的数据均在7300实时PCR反映系统中得出,计量资料的分析采用t检验及秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 侵袭组与非侵袭组之间3种因子表达的差异
侵袭组与非侵袭组之间PTTG mRNA表达水平差异有统计学意义(P=0.040),且2组之间PCNA表达水平差异也有统计学意义(P=0.011),而bFGF在2组之间的表达水平差异无统计学意义(P=0.483)。侵袭型腺瘤中功能型腺瘤与无功能型之间仅bFGF表达水平差异有统计学意义(P<0.01),而非侵袭组中功能组与无功能组之间3个指标表达水平差异均无统计学意义(表3)。

表3 侵袭组与非侵袭组PTTG、PCNA、bFGF表达的比较Tab.3 Expression of PTTG,PCNA and bFGF in invasive and noninvasive PAs
2.2 PTTG和PCNA表达的相关性
PTTG和PCNA的表达水平为明显的正相关,Pearson系数为0.985(P<0.05)。虽然 bFGF在侵袭组和非侵袭组之间表达无明显差别,但bFGF和PTTG之间的表达也呈正相关,但相关性较低,Pearson系数为 0.264(P=0.038)。
3 讨论
3.1 PTTG和侵袭性垂体腺瘤
PTTG是从GH4垂体瘤细胞系中分离出的一个癌基因,其在正常垂体组织中很少表达,而垂体腺瘤中PTTG的表达率超过90%[5]。PTTG的生理作用包括抑制细胞凋亡、调节细胞增生活性、促进肿瘤血管生成、调节DNA的损伤与修复,当然还包括和肿瘤侵袭性或浸润性的发生相关。已有研究[5-7]证实PTTG和肺癌、乳癌等肿瘤的侵袭性相关。动物实验[8]证明PTTG可促进基质金属蛋白酶-2(matrix metallopeptidase 2,MMP-2)的表达而促进细胞基质的形成。同时PTTG可以促进血管内皮生长因子(vascular endothelial growth factor,VEGF)及bFGF的表达,后者可以反过来促进 PTTG 的表达而形成正反馈作用[4,9-11]。VEGF和bFGF均可显著促进肿瘤血管生成,这些作用均可能直接或间接导致肿瘤的侵袭。本研究显示人垂体腺瘤中侵袭组和非侵袭组之间PTTG mRNA的表达差异有统计学意义(P<0.05),但年龄、性别、肿瘤直径及腺瘤类型之间表达差异无统计学意义(P>0.05)。Zhang X等[10]发现功能性腺瘤中侵袭蝶窦者较局限于蝶鞍内者PTTG表达显著升高,娄四龙等[11]研究也证实PTTG在蛋白和mRNA水平的表达侵袭组明显高于非侵袭组。值得注意的是上述研究的侵袭分组标准也部分采用了Knosp分级,同时还结合了Hardy-Wilson分级以及术中所见等,研究的设计和本研究近似。近上研究和本研究的不同在于同时使用PCR和免疫组织化学检测方法测试蛋白和RNA的表达水平,而且2个水平的表达一致,更从侧面辅证了本研究的结果。以上结果说明PTTG和垂体腺瘤的侵袭性密切相关,可作为肿瘤侵袭性的判定指标。
3.2 侵袭性垂体腺瘤和血管生成及bFGF
既往研究[9-10]结果表明侵袭性垂体腺瘤中微血管密度显著高于非侵袭性腺瘤,同时还显示大腺瘤中微血管密度(microvessel density,MVD)也大于微腺瘤,这说明血管生成和垂体腺瘤侵袭性的发生有密切关系。bFGF能促进内皮细胞再生、促进血管内皮细胞分裂从而诱导血管生成[4,9]。同时 bFGF可以和VEGF 及 MMPs协同促进血管生成[4,10-12]。本研究显示侵袭组与非侵袭组之间bFGF的表达差别无统计学意义(P>0.05)。国内崔友强等[12]的一组泌乳素腺瘤中发现bFGF和侵袭性密切相关,但上述研究的侵袭分组采用的是结合影像、手术所见及病理的Lewis诊断标准,和本研究组的标准有所差别;本组资料中PRL腺瘤例数较少(6例),未进行相关的差异分析。由此可见bFGF和垂体腺瘤侵袭性之间的关系不明确,是否能将其作为侵袭性判断的指标还有待进一步研究证实。
3.3 PCNA及肿瘤细胞增生活性与垂体瘤的侵袭性
PCNA是DNA聚合酶的一个辅助蛋白,其表达和肿瘤细胞的增生活性密切相关[4,13]。本组病例中侵袭组和非侵袭组之间PCNA的表达差异有统计学意义(P<0.05),但不同年龄、性别、肿瘤直径及腺瘤类型之间表达差异无统计学意义(P>0.05)。Saeger W
等[14]研究发现侵袭组PCNA表达显著高于非侵袭组,
同时PCNA和肿瘤的生长速度呈正相关。本研究组单独将组中的29例无功能腺瘤进行分析,也得出了
PCNA表达有显著差异的结论(P>0.05);但Saeger W等[14]的研究无功能腺瘤判定较本研究组更为广泛。本研究组将无功能腺瘤和临床无症状的FSH腺瘤汇总进行分析,分组标准和Saeger W等[14]的分组标准接近,得出了和他们相似的结果。上述研究结果均来自免疫组化检测方法,与我们采纳的PCR测试结果相互印证。
3.4 PTTG和bFGF在肿瘤发生及侵袭中的协同作用
PTTG的C末端的富含脯氨酸的CH3序列可以激活信号通路,促进bFGF的表达;同时bFGF的表达可反过来促进PTTG的表达,2者共同形成正反馈,诱导肿瘤血管生成,促进肿瘤生长及增加其侵袭性[4,10-12]。本研究结果显示2者之间的相关性有统计学意义。娄四龙等[11]的研究显示2者均和垂体腺瘤侵袭性显著相关,且二者之间呈正相关。结合以上研究可说明在人垂体腺瘤中PTTG和bFGF 2者之间的相互诱导可能是垂体腺瘤发生发展特别是侵袭性的重要相关因素。综上所述,PTTG和PCNA在侵袭性垂体腺瘤中的表达显著高于非侵袭性垂体腺瘤(P<0.05),PTTG
和PCNA和垂体腺瘤的侵袭性生长有密切关系,可能作为垂体腺瘤侵袭性生长的重要标志物;而bFGF在侵袭与非侵袭性垂体腺瘤之间的表达差异无统计学意义,bFGF和垂体腺瘤的侵袭性无明显关系,可能与促进垂体腺瘤的形成、发展与侵袭的发生相关。
[1]张荣,周良辅.侵袭性垂体瘤的诊断和治疗[J].临床外科杂志,2004,12(4):201-202.
[2]Michael B.Management of aggressive pituitary adenomas:current treatment strategies[J].Pituitary,2009,12(3):256-260.
[3]Kontogeorgos G.Predictive markers of pituitary adenoma behavior[J].Neuroendocrinology,2006,83(3-4):179-188.
[4]Alper G,Niki K,Olaf A,et al.What are the markers of aggressiveness in prolactinomas:changes in cell biology,extracellular matrix components,angiogenesis and genetics[J].Eur J Endocrinol,2007,156(2):143-153.
[5]McCabe C J,Anthony P,Hearrey,et al.Pituitary tumour transforming gene in endocrine cancer[J].Clin Endocrinol,2003,58(6):673-682.
[6]Jacob T,Deepthi K,Naibedya C.The emerging role of pituitary tumor transforming gene in tumorigenesis[J].Clin Med Res,2006,4(2):130-137.
[7]Salehi F,Kovacs K,Scheithauer B W,et al.Pituitary tumor-transforming gene in endocrine and other neoplasms:a review and update[J].Endocrine-Related Cancer,2008,15(3):721-743.
[8]Malik M T,Kakar S S.Regulation of angiogenesis and invasion by human pituitary tumo transforming gene(PTTG)through increased expression and secretion of matrix metalloproteinase-2(MMP-2)[J].Molecul Cancer,2006,5(61):611-613.
[9]De la Torre N G,Turner H E,Wass J A.Angiogenesis in prolactinomas:regulation and relationship with tumour behaviour[J].Pituitary,2005,8(1):17-23.
[10]Zhang X,Horwitz G A,Prezant T R.Structure,expression,and function of human pituitary tumor-transforming gene(PTTG)[J].Molecul Endocrinol,1999,13(1):156-166.
[11]娄四龙,霍钢,郑履平,等.P53、bFGF和MVD的表达与垂体腺瘤侵袭性的关系[J].重庆医学,2007,36(19):1943-1945.
[12]崔友强,滕良珠,李国新,等.PT TG和bFGF在垂体瘤中的表达及临床意义[J].山东医药,2005,45(30):12-13.
[13]Bravo R,Frank R,Blundell P A.Cyclin/PCNA is the auxiliary protein of DNA polymerase-delta[J].Nature,1987,326(6112):515-517.
[14]Saeger W,Lüdecke B,Lüdecke D K.Clinical tumor growth and comparison with proliferation markers in nonfunctioning(inactive)pituitary adenomas[J].Exp Clin Endocrinol Diabetes,2008,116(2):80-85.
