一种植物病毒检测新方法—纳米上转换荧光技术
2011-06-12张明哲吴志毅张永江闻伟刚林晓佳陈吴健刘鹏程李明福
张明哲, 陈 曦, 吴志毅, 张永江, 闻伟刚, 林晓佳陈吴健, 吴 蓉, 刘鹏程, 李明福
(1.浙江出入境检验检疫局,杭州 310012; 2.中国检验检疫科学研究院,北京 100029;3.宁波出入境检验检疫局,宁波 315012; 4.杭州出入境检验检疫局,杭州 310012;5.湖州出入境检验检疫局,湖州 313000)
近年来,随着我国人民生活水平不断提高,对肉、蛋、奶的需求持续增加,进而带动国内饲料养殖业对豆粕需求强劲,同时国内食用油消费逐年递增,而国产大豆与国外转基因大豆相比含油量低,价格较高,不具有竞争力,因此压榨量呈现下降趋势,进一步导致我国进口转基因大豆大幅增长,国内大豆压榨行业对进口大豆的依赖性增强。2009年我国大豆进口量达到4 255.2万t,连续第5年创下历史最高纪录。
随着大豆进口量不断增加,菜豆荚斑驳病毒(Bean pod mottle virus,BPMV)、烟草环斑病毒(Tobacco ringspot virus,TRSV)等有害生物随大豆传入风险也在逐步增大。仅2009年1-3月份舟山口岸就截获菜豆荚斑驳病毒31批次,进口大豆的生物安全问题再一次引起人们的关注。据2007年5月农业部发布《中华人民共和国进境植物检疫性有害生物名录》统计,大豆可作为寄主的检疫性病毒有:菜豆荚斑驳病毒(Bean pod mottle virus,BPMV),番茄环斑病毒(Tomato ringspot virus,ToRSV),南芥菜花叶病毒(Arabismosaic virus,A rMV),南方菜豆花叶病毒(Southern bean mosaic virus,SBMV),烟草环斑病毒(Tobacco ringspot virus,TRSV)等。这些病毒都是进境大豆种子必须检疫的对象,属于我国禁止进境的检疫性有害生物,寄主范围广,危害大,一旦传入我国并定殖下来,将很难根除,会对我国农业生产造成不可估量的损失。由于目前尚无有效的病毒防治方法,因此加强口岸检疫工作是防止这些病毒传入的唯一有效途径。
1 目前主要使用的植物病毒检测技术
目前主要使用的植物病毒检测技术为血清学方法和分子生物学方法。
1.1 血清学方法
血清学方法具有严格的特异性和较高的灵敏度,是目前植物病毒检测最为常用和有效的手段之一。植物病毒作为抗原,主要是通过其蛋白壳与特异性的抗体结合,使抗原失去活力,这种抗原抗体体外结合的过程叫做免疫反应,也叫血清反应[1]。由于不同病毒产生的抗血清都有各自的特性,因此可以用已知病毒的抗血清来鉴定病毒种类。而自从1977年,Clark等人首次将酶联免疫吸附法(ELISA)应用于植物病毒检测领域,ELISA法已成为血清学检测植物病毒的首选方法,其基本原理是,以酶催化的颜色反应指示抗原抗体的结合[2]。目前国内植物检疫主要使用的是双抗体夹心ELISA法,该方法优点在于操作简单,检测时间短,但同时也存在检测目标单一,进口商品化试剂盒价格高昂等缺点。
1.2 分子生物学方法
分子生物学检测法是通过检测病毒核酸(DNA,RNA)可将检测灵敏度达到皮克(pg)级甚至飞克(fg)级,相比血清学方法具有更高的灵敏度,并且检测的特异性更强,范围更广,对各种病毒、类病毒都可以检测,还可以进行大批量的样本检测[1]。目前最常用的主要有反转录PCR(reverse transcrip tion po lymerase chain reaction,RT-PCR)、荧光定量PCR(real-time PCR)、核酸杂交技术(nucleic acid hybridization)、DNA微阵列技术(DNA microarray)等[4]。但是,分子检测技术及其应用也存在一些不足,主要体现在(1)提取核酸和逆转录的过程都比较繁琐和复杂,且容易产生非特异性扩增和假阳性结果;(2)对于苗木种子等核酸提取困难,常含有抑制物质,易造成结果的假阴性。
2 纳米上转换荧光技术及其应用
基于现状,我国各出入境口岸及产地植物病毒检验检疫迫切需要高灵敏、快捷简便以及高通量的检测新技术,而磁性纳米颗粒(magnetic nanoparticles,MNP)和上转换荧光(up-converting phosphor,UCP)材料的出现是解决这个问题的新亮点。
2.1 磁性纳米颗粒
自从20世纪70年代磁性纳米颗粒被首度用于生物分离后[5],近10年来,MNP已被广泛用于生物活性物质的富集和分离。MNP是一类智能型的纳米磁性材料,既具有纳米材料所特有的性质如粒径小,比表面极大,偶联容量高,又具有磁响应性及超顺磁性,可以在恒定磁场下聚集和定位[6]。通过对MNP表面不同修饰,具有表面活性基团,能进一步与药物、抗体、蛋白质、酶、细胞及DNA等多种分子偶联[7]。如:Lee等通过将Ni2+直接固定在丙二醇与环氧乙烷共聚物修饰的磁性Fe3 O4表面,形成Ni-MNPs,利用Ni对组氨酸标记的蛋白质的特异性,应用外部磁场将组氨酸标记的GFP从混合溶液中高效分离[8]。Tan等合成了一个基因磁性纳米捕获剂(GMNC),将其用于富集、分离和检测痕量的具有单碱基错配的DNA/mRNA分子[9]。
利用磁性纳米颗粒易于磁性富集和磁性分离的特点,在其表面包被特异性抗体,从而顺利完成病毒分离和富集等过程,具有检测速度快和对人为因素不敏感等优点。但是仅利用纳米磁性颗粒,只能对植物病毒进行富集,为了能更加快速迅捷的对病毒进行检测,我们还需要一种生物标记手段,使病毒检测的结果更加直观。
2.2 上转换荧光材料
上转换发光(图1),是指将两个或两个以上的低能光子转换成一个高能光子的现象,一般特指将红外光转换成可见光[10]。近年来,上转换荧光材料作为生物标记物普遍被用于生物检测领域,与传统的荧光标记物相比具有毒性低、化学稳定性好、发光强度高而稳定和Stokes位移大等优点[11]。
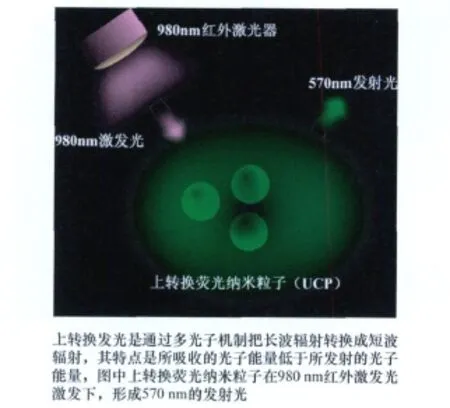
图1 上转换发光示意图
这种材料主要由主基质(host matrix)、吸收子(absorber)和发射子(eMitter)3种成分构成[12]。可作为主基质的晶体材料有:氧硫化物(如Y2 O2 S、GdO2 S、La2 O2 S 等)、氟化物(如 YF3、GdF3、LaF3等)、镓酸盐(如 YGaO3、Y3Ga5O12等)以及硅酸盐(如YSi2 O5、YSi3 O7等)等;常作为吸收子的稀土金属离子有:镱离子(Yb3+)、铒离子(Er3+)、钐离子(Sm3+)等;常作为发射子的稀土金属离子有:铒离子(Er3+)、钬离子(Ho3+)、铥离子(Tm3+)、铽离子(Tb3+)等[13]。吸收子和发射子这一离子对在主基质晶格内适宜的空间取向和距离,是产生上转换发光的基础。上转换发光的过程(如图1),就是UCP内的吸收子(如Yb3+)吸收低能量光子(红外光区,如980 nm),在经过一系列的内部能量转过后,将光子的能量连续传递给发射子(如Er3+),使其释放一个高能光子(可见光区,如570 nm)的过程。
2.3 纳米上转换荧光技术
纳米上转换荧光技术一方面利用磁性纳米颗粒作为载体对目标物进行分离、富集和定位;另一方面引入上转换荧光材料作为标记物的免疫检测方法。利用独特的上转换发光现象,将微观进行的免疫反应以可见光信号的形式表现出来,并通过与集成化的光学电子元件相结合后,被物理换能器接收进而转换为电压值或电流值,并与目标被检物的浓度值一一对应,从而实现定量检测。
目前国内纳米上转换荧光技术研究,主要有Wang等以MNP作为核酸载体,UCP作为荧光标记物检测DNA[14];Lu等以磁性纳米Fe3O4为核,合成出具有磁性的Fe3 O4@NaYF4:Yb,Er上转换荧光纳米颗粒[15]。他们对这种上转换荧光颗粒表面进行了氨基修饰,成功与链霉亲和素连接,揭示了纳米上转换荧光技术在生物检测方面的潜在应用。Guo等对合成的NaY4:Yb,Er上转换荧光纳米颗粒的表面进行修饰并将其作为标记物来检测DNA的杂交,进而实现了对细菌的检测[16]。
作者在这些研究的基础上,将纳米上转换荧光技术拓展到植物病毒检测领域,对MNP和UCP进行表面抗体修饰及表征,通过抗体抗原特异性结合进行病毒富集、分离和荧光标记,并采用多光谱影像检测系统对特定波长荧光的有无以及强度分别进行定性和定量分析(图2),从而实现高效、灵敏的检测目标(数据未发表)。纳米上转换荧光技术应用于检测植物病毒的优点在于高度的抗干扰性、多元性、稳定性、安全性:
(1)高度的抗干扰性:MNP智能型的纳米磁性材质和UCP特殊的发光机制极大限度地降低了外界因素干扰。
(2)高度的多元性:MNP的磁响应性及超顺磁性及UCP独特的可自由组合的多样化特征光谱使其具备了多重检测的能力。
(3)高度的稳定性:UCP的发光现象是产生于结构内部的纯粹物理过程,且其以能量较低的红外光作为激发光,对植物病毒影响小。
(4)高度的安全性:MNP材料具有良好的生物安全性,UCP为惰性合成材料、激发光为红外光对于检测者、环境均无任何危害。
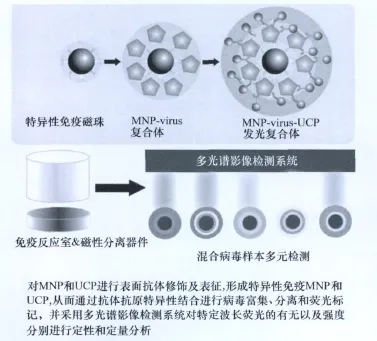
图2 纳米上转换荧光技术在植物病毒检测中的应用
3 结束语
植物病毒检测技术经历了传统生物学检测技术、血清学检测技术和分子生物学检测技术3个阶段。目前,纳米新材料、新技术的出现在病毒富集和分离、信号放大等环节为植物检验检疫带来新的突破和提高;纳米材料和现有检测技术的结合,将使整个检测体系呈现出与以往不同的特性和功能,更预示着基于新颖物理原理的植物病毒检测技术的诞生。
[1]杜琳,钟先锋,陈剑泓,等.植物病毒检测技术研究进展[J].农产品加工,2007(7):48-51.
[2]兰玉菲,郗丽君,张徳满,等.植物病毒检测技术[J].山东农业科学,2006(5):58-62.
[3]C lark MF,AdaMs A N.Characteristics of the Microplate Method of enzyMe-linked immunosorbent assay(ELISA)for the detection of plant virus[J].Jou rnalof GeneralVirology,1977,34:475-483.
[4]Hyun Ryu K,Yoon K E,W ok P.Detection by RT-PCR of Cymbid iuMmosaic virus in orchids[J].Journal of Phytopathology,1995,143:643-646.
[5]Robinson P J,Dunnill P,Lilly MD.The properties ofMagnetic suppo rts in relation to immobilized enzyme reacto rs[J].Biotechnology and Bioengineering,1973,15(3):603-606.
[6]F ranger S,Berthet P,Berthon J.ElectrocheMical synthesis of Fe3O4nanopartic les in alkaline aqueous solutions con taining coMplexing agen ts[J].Jou rnal of Solid State ElectrocheMistry,2004,8:218-223.
[7]Chastellain M,Petri A,Gupta A,et al.Superparamagnetic silica-iron oxide nanocomposites for application in hypertherMia[J].Advan ced Engineering Materials,2004,6(4):235-241.
[8]Lee K S,Lee IS.Decoration of superparamagnetic iron oxide nanoparticleswith Ni2+:agen t to bind and separate histidinetagged proteins[J].CheMical Communications,2008,14(6):709-711.
[9]Zhao X,Tapec-Dy tioco R,W ang K,et al.Collection of trace amounts of DNA/mRNA molecules using genoMagnetic nanocapturers[J].AnalyticalCheMistry,2003,75(14):3476-3483.
[10]Auzel F.Upconversion and an ti-stokes processes with f and d ions in solid s[J].CheMical Review s,2004,104(1):139-174.
[11]W ang X,Li Y.Monodisperse nanocrystals:general synthesis,assembly,and their applications[J].CheMical Communications,2007,28:2901-2910.
[12]郭海,乔艳敏.稀土纳米上转换发光材料研究进展[J].浙江师范大学学报,2007,30(4):377-382.
[13]郭海.稀土离子掺杂的纳米氧化物上转换发光与稀土氧化物功能薄膜研究[D].合肥:中国科学技术大学,2005.
[14]W ang L Y,Li Y D.G reen upconversion nanocry stals for DNA detection[J].CheMical Communications,2006,24:2557-2559.
[15]Lu H C,Yi G S,Zhao S Y,et al.Synthesisand characterization of multi-functional nanoparticles possessing magnetic,upconversion fluorescence and bio-affinity p roperties[J].Journal of Materials CheMistry,2004,14(8):1336-1341.
[16]Guo YG,DengW,Guo M,et al.The detection of bacteria on Microarrays using up-converting phospho r nanoparticlesas fluorescent labels[C].2006 1st IEEE International Conference of Nano/Micro Engineered and Molecu lar SysteMs,2006:550-555.
