山西省枣树上啤酒花矮化类病毒的检测及序列分析
2011-06-12张本利李世访
张本利, 李世访
(1.吉林农业大学农学院,长春 130000; 2.中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
类病毒是迄今为止发现的最小病原物,1971年美国研究人员Diener在研究马铃薯纺锤块茎病的过程中,提出了“类病毒”的概念[1],它是一类单链共价闭合环状的裸露RNA分子,由246~475个核苷酸组成,具有自我复制能力,是感染某些高等植物的低分子致病性因子[2]。
啤酒花矮化类病毒(Hop stuntviroid简称HSVd),属于马铃薯纺锤块茎类病毒科啤酒花矮化类病毒属。1970年,日本的Yamamoto等人首次在矮化的啤酒花上发现了啤酒花矮化类病毒[3]。该类病毒在某些寄主如葡萄和杏上呈潜伏侵染,而在某些寄主上却会造成严重病害,如啤酒花矮化病[4]、李和桃斑果病[5]、柑橘矮化和裂皮病[6-7]等。HSVd侵染寄主植物后是否有症状表现,且症状表现是否与地域、品种等有关还有待进一步的研究。1997年,Kofalvi等从李属植物上获得新的HSVd序列后,将HSV d分为 5个类型[8]:李型、啤酒花型、柑橘型、李-柑橘型和李-啤酒花-柑橘型。
1985年,日本的Sano首次在葡萄上发现了HSV d,经过15年的研究,认为HSVd的初侵染源为葡萄,在进化过程中逐渐适应了新的寄主[9]。目前国内外已报道的HSV d寄主包括黄瓜、葡萄、桃、李、扁桃、杏等草本及木本植物。中国已经在啤酒花[10]、桃[11]、李[12]、杏[13]、葡萄[14]、扁桃[15]等植物上报道了HSV d。目前为止,国外还没有在枣树上发现任何类病毒,本研究首次在国内报道了枣树上检测出的啤酒花矮化类病毒及其序列特征。
1 材料与方法
1.1 材料
1.1.1 供试材料
供试枣树叶片样品采自山西省农业科学院果树研究所国家枣种质资源圃,共计70份。
1.1.2 主要试剂
M-MLV反转录酶和 2×Taq PCR MasterMix购自北京天根生化科技有限公司,限制性内切酶Sma I购自 TaKaRa公司;T4 DNA连接酶、T7 RNA聚合酶、NTPs等购自 Promega公司;质粒小提和PCR产物回收试剂盒购于Qiagen公司;DIG RNA Labeling Kit(SP6/T7),CSPD化学发光底物,DIG Easy H yb购自Roche公司;H ybond-N+购自Amersham公司;其他化学试剂等均为市售。
1.1.3 载体及受体菌
pGEM-T Vector购自Promega公司;大肠杆菌(Escherichia coli)DH 5α购于北京天根生化科技有限公司。
1.1.4 引物
HSV d引物参考GenBank中登录的(登录号:D13764)核苷酸序列,设计了3条引物(表1),其中HSV d P1用于RT,HSVd P2和HSVd P3用于PCR,下划线的部分为SMa I酶切位点。引物由上海生工生物技术有限公司合成。

表1 HSVd的引物序列及相关信息
1.2 试验方法
1.2.1 类病毒RNA提取
参考Li等报道的方法[10],取叶片样品5 g,提取后溶于20μL dd H2O中,-20℃冰箱保存备用。
1.2.2 Northern杂交
1.2.2.1 探针制备
(1)在DMPC处理并高压灭菌的无RNase污染的微型离心管中依次加入下列反应物:线性化模板DNA 4μL(1μg),10×NTP标记混合物 2μL,10×转录缓冲液2μL,DEPC-H2O 10μL,T7 RNA聚合酶 2μL,轻轻混匀反应物,37℃保温反应至少2 h;
(2)向反应体系中加入2μL无 RNase污染的DNase I,37℃下再保温反应15 min;
(3)向反应体系中加入2μL(200 mmol/L)的EDTA终止转录反应;
(4)再向反应体系加入2.5μL(4 mol/L)LiCl和75μL冰冷100%乙醇,4℃下沉淀过夜;
(5)4℃下,12 000 r/Min离心15 min,沉淀用70%冷乙醇洗涤一次,真空干燥;
(6)沉淀按1μg/10μL的浓度重悬于DEPCH2O中,检测并分装后置于-70℃保存。
1.2.2.2 CG的致病力测定
将Hybond-N+尼龙膜平铺在凝胶上,然后铺上3张3 mMWhatman滤纸并用玻璃板夹紧过夜。小心取下转移膜,将其自然晾干后,于120℃烤膜30min或者80℃烤膜2 h。
1.2.2.3 杂交
将处理好的尼龙膜装入杂交瓶,按照10 ML/100 cm2的比例加入杂交缓冲液(DIG Easy Hyb),68℃预杂30min;68℃杂交6 h以上,弃杂交液,用2×SSC,0.1%SDS和0.5×SSC,0.1%SDS洗膜,各2次,每次15 min,1%封闭液封闭30 min,加入Anti-DIG-AP抗体37℃反应1 h后用洗涤缓冲液洗2次,每次 15 min,检测液平衡 5 Min;滴加CSPD,使CSPD在膜上扩散均匀,室温放置10min;将多余的CSPD液体挤净并封口,37℃处理10 min;在暗室曝光后取出胶片显影、定影。
1.2.3 RT-PCR扩增
1.2.3.1 反转录
取1.5 ML离心管加入3μL核酸提取液,4μL 5×M-MLV buffer,4 μL(2.5 mmol/L)dNTPs,1μL(40 U/μL)RNasin,1μL(20μMol/L)引物HSV d P1,1 μL(200 U/μL)M-MLV 反转录酶,加dd H2O至20μL,室温下放置10 min,42℃反应1 h后,快速移至冰上放置2Min后贮存于-20℃冰箱中备用。
1.2.3.2 PCR扩增
PCR体系为:2×Taq PCRMaster Mix 25μL,引物对HSV d P2、P3各 1μL(20μmol/L),反转录产物3μL,dd H 2O 20μL。PCR程序为:94℃预变性4min,94℃变性30 s,53℃退火30 s,72℃延伸30 s,35个循环,72℃延伸7Min。
1.2.4 PCR产物的回收,克隆及序列分析
1.2.4.1 PCR产物的回收
将PCR扩增产物进行琼脂糖凝胶电泳,紫外灯下切割特异性条带,分别装入1.5ML离心管中,使用Axygen PCR产物回收试剂盒进行回收。
1.2.4.2 克隆及序列分析
连接反应按照pGEM-T试剂盒操作进行,连接产物转入E.coli DH 5α感受态细胞涂平板后,37℃培养过夜。通过菌液PCR及酶切鉴定筛选阳性克隆并送北京华大基因科技有限公司测序。测序结果用DNAMAN5.2.2软件进行分析。

2 试验结果
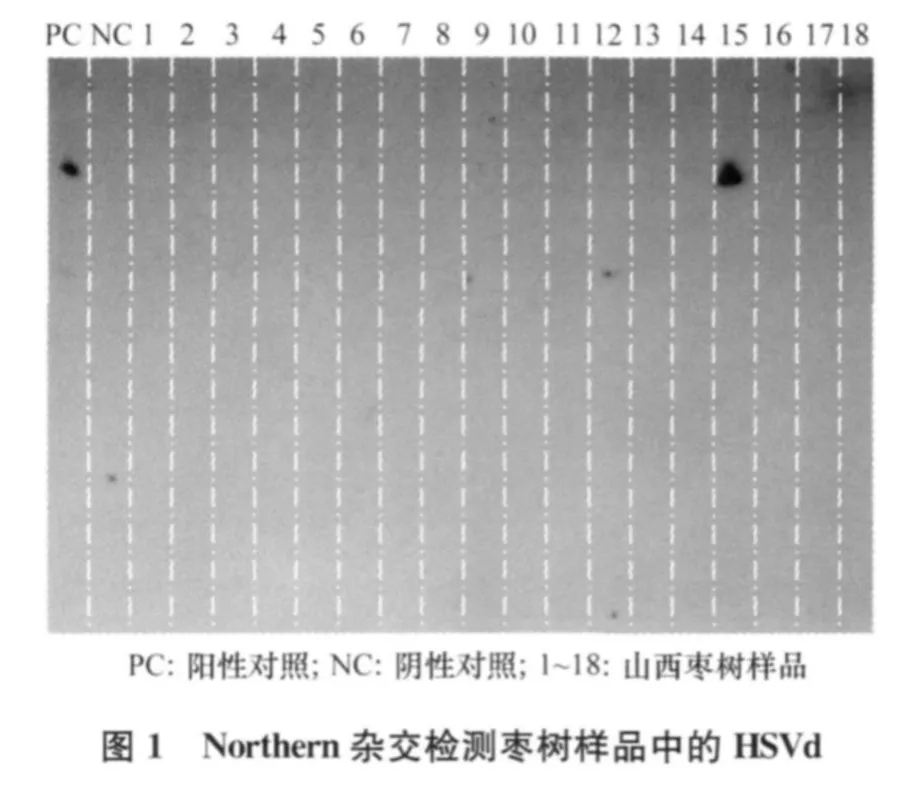
2.1 Northern杂交结果
70个枣树样品的RNA提取液,按照1.2.2所述的方法进行杂交,并以含有HSVd全长序列的重组质粒pGEM-T-HSVd为阳性对照,点样量相当于0.25 g植物组织鲜重。杂交结果显示:70个山西枣树样品中有1个样品(15号)呈HSVd阳性(图1)。
2.2 RT-PCR扩增结果
以Northern杂交检测到的阳性样品RNA为模板,使用HSVd P1为引物进行反转录,使用引物HSV d P2和HSVd P3进行PCR扩增,RT-PCR产物经1.5%琼脂糖凝胶电泳检测,在307 bp处产生特异性条带(图2)。
2.3 克隆测序及序列分析结果
将PCR产物纯化后连接到pGEM-T载体上,菌液PCR和酶切鉴定后挑取25个阳性克隆进行测序,共获得13种HSVd序列。用DNAMAN 5.2.2软件将所得序列与GenBank中首次报道的HSVd序列(X00009)进行比较分析(图3),结果显示:中国枣树上分离到的13种HSVd序列与1983年首次报道的HSV d序列(X 00009)有多达23个碱基的差异,约占整个基因组序列的8%。
3 讨论
本研究首次在国内报道了枣树上分离得到的HSV d序列。本文将得到的13条HSVd序列与GenBank中首次报道的 HSV d(X 00009)进行序列比对分析,结果表明:枣树上分离到的 13种HSV d序列与首次报道的HSVd序列之间有多达23个碱基的差异,同源性为92.6%~92.8%。这说明枣树上的HSVd序列有其自身的特点。由于目前所采样品数量较少,采样地点有限,因此HSVd在其他地区或省份枣树上类病毒的发生分布情况还需要通过扩大调查区域范围以及进一步增加样品数量来确定。本研究为类病毒的有效防控提供了参考,为研究类病毒的起源问题提供了科学数据。

图3 枣树上分离到的13条HSVd序列与首次报道的HSVd序列(X00009)比对结果
[1]Diener T O.Potato spindle tuber‘virus’ Ⅳ.A replicating,low molecular w eigh t RNA[J].V irol,1971,45:411-428.
[2]Flores R,Di-Seriof,Hernández C.Viroids:The non-coding genomes[J].SeMin Virol,1997,8:65-73.
[3]Yamamoto H,KagaMi Y,Ku rokaw a M,et al.Studies on hop stunt disease in Japan[J].Rep Res Lab K irin Brew Co Ltd,1973,16:49-62.
[4]Shikata E.New viroid s fromJapan[J].SeMin Virol,1990,1:107-115.
[5]Sano T,H ataya T,Terai Y,et al.Hop stunt v iroid strains fromdapple fruit disease of pluMand peach in Japan[J].JGen Virol,1989,70(6):1311-1319.
[6]Diener T,SMith D,Hammond R,et al.Citrus B viroid iden tified as a strain of Hop stunt v iroid[J].Plant Disease,1988,72:691-693.
[7]Semancik JS,Roistacher C N,Rivera-Bustamante R,et al.Citrus cachex ia viroid,a new viroid of citrus relationship to viroids of theexocortis disease coMplex[J].JGen V irol,1988,69:3059-3068.
[8]Kofalvi S,Marcos JF,CaÌzares MC,et al.H op stunt viroid(HSVd)sequence varian ts fromP runus species:evidence for recombination betw een HSVd isolates[J].JGen Virol,1997,78(12):3177-3186.
[9]Kawaguchi-Ito Y,Li S F,Tagaw a M,et al.Cultivatedgrapevines represent a symp toMless reservoir for the transmission of Hop stun t viroid to hop crop s:15 yearsof evolu tionary analysis[J].PlosOne,2009,4(12):e8386.
[10]Guo L H,Liu S X,Wu Z J,et al.Hop stunt viroid(HSVd)new ly reported fromhop in X injiang,China[J].Plant Pathology,2008,57:764.
[11]Zhou Ying,Guo Rui,Cheng Zhoumin,et al.First report of Hop stuntviroid frompeach(Prunus persica)with dapple fruit symptoms in China[J].Plant Pathology,2006,55(4):564.
[12]Yang Y A,W ang H Q,Cheng ZM,et al.First report of Hop stunt viroid frompluMin China[J].Plant Pathology,2007,56(2):339.
[13]Yang Y A,Guo R,Wang H Q,et al.First report of Hop stunt viroid in apricotin China[J].Plant Disease,2006,90(6):828.
[14]Li S F,Guo R,Tsuji M,et al.First reports of tw o g rapevine viroids in China and the possible detection of a third[J].Plan t Pathology,2006,55(4):564.
[15]Mu L X,W u Y H,LiS F.Identification and characterization of Hop stunt viroid infecting almond in China[J].Jou rnal Plan t Pathology,2009,91(4):102.
[16]LiS F,Onodera S,Sano T,et al.Genediagnosis of viroids:comparisons of return-PAGE and hybridization using DIG-labeled DNA and RNA probes for practicaldiagnosisofhop stunt,citrusexocortis and apple scar skin viroids in their natural host plants[J].Ann Phytopathol Soc Japan,1995,61:381-390.
