利开灵对脑出血大鼠内毒素血症炎症效应的影响
2011-06-11傅晨张允岭常富业刘雪梅王新祥郑宏陶冶闫妍黄启福
傅晨 张允岭 常富业 刘雪梅 王新祥 郑宏 陶冶 闫妍 黄启福
脑出血是一种严重危害人类健康和生命的疾病,因其起病急、进展快、病死率高而备受关注。脑出血后脑水肿可引起颅内压增高,在导致死亡和残疾的诸多因素中起着重要作用。近年来的研究证实脑出血后的炎症反应能促进脑水肿,加重神经元的损害,是脑出血后产生脑水肿的病理机制之一。而内毒素血症是脑出血引起全身感染和全身炎症反应综合征(systemic infla--mmatory response syndrome,SIRS)的重要原因之一[1]。
本课题组前期成功制作大鼠脑出血模型,结果表明,模型组大鼠出现神经功能缺损,且出血局部脑组织存在病理形态损伤;而具有开通玄府、利水解毒作用的中药复方利开灵对此有明显改善作用[2]。本研究制备的脑出血大鼠模型体内发生了内毒素血症。为深入研究利开灵拮抗脑出血后脑水肿的作用机制,本研究观察了脑出血后内毒素血症的炎症效应,并探讨利开灵对其影响。
1 材料与方法
1.1 材料
健康雄性清洁级Sprague Dawley(SD)大鼠156只,体重(250±20)g,由北京维通利华实验动物技术有限公司提供。利开灵复方(组成:泽泻30 g、石菖蒲15 g、半边莲30 g、桂枝10 g)由北京中医药大学东方医院实验中心水煎浓缩;Ⅳ型胶原酶(Collagenase Ⅳ,Sigma C5138),显色基质鲎试剂盒(厦门鲎试剂厂),大鼠血清肿瘤坏死因子-α(TNF-α) ELISA试剂盒(R&D公司),大鼠血清白细胞介素-1β(IL-1β) ELISA试剂盒(R&D公司),碘[125I]TNF-α放射免疫试剂盒(解放军总医院科技开发中心放免所),碘[125I]IL-1β放射免疫试剂盒(解放军总医院科技开发中心放免所),无热原耗材均由厦门鲎试剂厂提供。
1.2 仪器
大鼠脑立体定位仪(Stoelting Model310),微量进样器(Stoelting),湿式二氧化碳培养箱(SHELL/JB TC2323),微量振荡器(姜堰市新康医疗器械有限公司),酶标仪(BIO-TEK ELX800),免疫计数器(上海核所日环光电仪器有限公司,Sn-695B)。
1.3 方法
1.3.1 分组与给药 根据脑出血的不同时间点(12、24、48、72小时),将SD大鼠随机分为4组,每个时间点再分为3组:假手术组、模型组、利开灵组,共12组,每组13只。上述各组造模苏醒后,利开灵组立即给予利开灵浓煎剂灌胃,后每隔12小时给药一次。假手术组、模型组给药时间及给药途径同利开灵组,以等量蒸馏水代替药液。给药剂量根据人与大鼠体表面积公式换算,每公斤体重大鼠每日给利开灵生药7.7 g,再以每日给药2次,每次每只大鼠给药3 ml核算出药物浓度。
1.3.2 模型建立 采用Rosenberg法[3]改良后建立大鼠脑出血模型,同本课题组前期实验造模方法[2]。造模后,按Bederson评分法[4]进行神经功能缺损评分。评分在1~4分的大鼠为模型制作成功,纳入实验分组;将出血较多,提前死亡,取脑时发现蛛网膜下腔出血以及术后存活时间未达取材时间要求的大鼠剔除。
1.3.3 内毒素水平检测 各组大鼠不同时间点麻醉,腹主动脉取血,抗凝,离心,在超净工作台内分离血浆,放入专用无热原试管内,-80℃保存备用,集中检测内毒素脂多糖(LPS),严格按照显色基质鲎试剂盒说明书操作。
1.3.4 TNF-α、IL-1β水平检测 各组大鼠不同时间点麻醉,腹主动脉取血,离心取血清,-80℃保存备用;然后断头,迅速取大鼠患侧脑注射针孔前后各约1 mm,共约2 mm的脑组织,以灭菌锡箔纸包裹,置于液氮中冷冻后移至-80℃保存。血清TNF-α、IL-1β检测按照ELISA试剂盒说明书操作,出血局部脑组织TNF-α、IL-1β检测按照放免试剂盒说明书操作。
1.4 统计学处理
2 结果
2.1 利开灵对脑出血大鼠血浆内毒素水平的影响
模型组内毒素均明显高于相应时间点假手术组(P<0.01),呈现先升高后下降的趋势,在48 小时达高峰。利开灵组内毒素在12 小时升高(P<0.01),且与模型组无显著差异,其后其表达呈下降趋势,48 小时和72 小时均明显低于模型组(P<0.01),于72 小时为最低,且与假手术组无显著差异,见表1。
2.2 利开灵对脑出血大鼠血清TNF-α、IL-1β水平的影响
模型组大鼠TNF-α在各时间点均明显高于假手术组,在24 小时达高峰(P<0.01);利开灵组TNF-α在12 小时升高(P<0.05),24 小时仍明显高于假手术组(P<0.01),但低于模型组(P<0.01),48 小时和72 小时均低于模型组(P<0.05,P<0.01),且与假手术组无显著差异,见表2。
模型组血清IL-1β呈现先升高后下降的趋势,24 小时达高峰(P<0.01),72小时接近假手术组基础值水平;利开灵组在12 小时即有升高趋势,24 小时明显高于假手术组(P<0.05),仍低于模型组,48 小时和72 小时与假手术组比较无显著差异,见表3。
2.3 利开灵对脑出血大鼠出血局部脑组织TNF-α、IL-1β水平的影响
模型组TNF-α于12小时开始升高(P<0.05),其后均明显高于假手术组(P<0.01),呈升高趋势直至72小时;利开灵组TNF-α在12 小时即有升高趋势, 24 小时稍下降,明显低于模型组(P<0.01),48 小时再次升高,但仍低于模型组(P<0.05),72 小时达最高,仍低于模型组,与模型组、假手术组比较均有显著差异(P<0.01),见表4。
模型组IL-1β各时间点均高于假手术组,呈先升高再下降的趋势,在48 小时达最高(P<0.01);利开灵组IL-1β在12 小时即升高,24 小时下降,明显低于模型组(P<0.01),48 小时再次升高,但仍低于模型组(P<0.01),72 小时明显低于模型组(P<0.05),且与假手术组比较无显著差异,见表5。
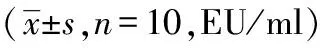
表1 脑出血不同时点大鼠血浆内毒素水平动态变化及利开灵的影响
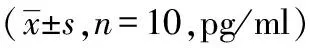
表2 脑出血不同时点大鼠血清TNF-α水平动态变化及利开灵的影响
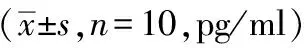
表3 脑出血不同时点大鼠血清IL-1β水平动态变化及利开灵的影响
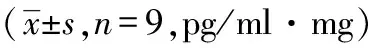
表4 大鼠出血局部脑组织不同时点TNF-α水平动态变化及利开灵的影响
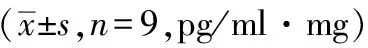
表5 大鼠出血局部脑组织不同时点IL-1β水平动态变化及利开灵的影响
3 讨论
近几年来,随着对脑出血损伤机理研究的深入,脑组织已经被证实并非完全是免疫豁免区,脑出血后脑组织同样产生炎症反应。炎症细胞产生的各种酶及炎症细胞因子,可通过加重血脑屏障的破坏和细胞膜的损伤,产生和加重血管源性及细胞毒性脑水肿[5]。Castillo等[6]发现,脑出血患者发病后3~4天内血肿周围水肿程度与出血后24小时内TNF-α水平呈显著正相关。Mayne等[7]发现,脑出血时TNF-α能促进炎性反应发生,加重脑水肿,而TNF-α特异性反义脱氧寡核苷酸(ORF4-PE)能抑制TNF-α的表达,具有神经保护作用。Kimelberg[8]发现,脑室内注入IL-1β可加重脑水肿特别是星形胶质细胞的肿胀和变形,继而释放各种神经毒性因子加重血脑屏障破坏和细胞膜的损伤,促进和加重血管源性及细胞毒性脑水肿。因此,深入认识影响脑出血后脑部炎症反应的病理因素,对防治脑出血后脑水肿有着重要意义。
在多种危重的病理过程中伴发的内毒素血症可以诱发全身炎症反应综合征[9]。内毒素血症的核心内毒素(LPS)在体内的作用错综复杂,主要通过LPS与细胞表面的受体结合后产生细胞毒作用,活化细胞内信号传导系统,促进细胞合成、释放各种细胞因子及炎性介质,包括TNF-α、白介素-1、白三烯、血小板激活因子等,从而导致体内异常的炎性反应。本研究血浆内毒素测定证实了脑出血后内毒素血症的存在,而血浆内毒素高峰时间与血清炎症因子表达高峰时间不一致,这可能的原因是:研究已发现脑出血后机体既存在促炎机制,也存在抗炎机制,二者共同调节机体的炎症反应[10],共同对炎症细胞释放TNF-α、IL-1β等细胞因子产生影响。
正常情况下,血脑屏障(blood-brain barrier,BBB)只允许某些分子量小于2000kd的物质经过血管内皮细胞间的紧密连接处入脑,而脑出血后存在BBB损伤,同时LPS刺激也可造成BBB损伤,从而导致其通透性增加[11]。本研究脑出血大鼠血浆LPS、血清TNF-α、IL-1β含量明显升高,三者可能通过受损的BBB进入脑内:一方面,LPS进入脑组织后可促进脑内炎症细胞因子的释放;另一方面,血清炎症因子可能直接激化损伤部位的脑组织炎症反应。这两个方面共同作用对脑组织TNF-α、IL-1β含量变化产生影响。本研究表明,模型组出血局部脑组织TNF-α、IL-1β均呈升高趋势直至48小时,结合血LPS、TNF-α、IL-1β的表达变化推测,出血局部脑组织TNF-α、IL-1β水平可能在脑出血后24小时内受二者共同影响,24小时后可能主要受内毒素水平影响。而出血局部脑组织TNF-α和IL-1β在48小时后表达变化趋势不一致,其可能原因是:内毒素途径可能存在着影响TNF-α、IL-1β合成、释放的不同机制,从而使二者表达高峰不一致。这需要进一步的深入研究探讨。
利开灵复方由泽泻、石菖蒲、半边莲、桂枝组成,具有开通玄府、利水解毒的作用。临床研究表明利开灵可改善脑出血患者的临床症状与体征及实验室多项指标,效果满意[12];实验研究亦发现,利开灵降低脑组织含水量,对脑出血后脑水肿有可靠的干预效应[13]。本研究采用利开灵对脑出血后大鼠进行干预,发现其降低了血浆内毒素水平,对内毒素引发的炎症因子的合成、释放起到了控制作用,并干预了脑TNF-α、IL-1β的表达水平,提示利开灵对内毒素血症炎症效应有较好的调控作用,其机制可能有以下几个方面:利开灵通过“开通玄府”调畅玄府气机,改善全身代谢状态,降低血脑屏障通透性,减少血液中内毒素、炎症因子对脑的影响;降低肠黏膜通透性,并增强胃肠道运动,使肠道积滞排出,减少了肠源性内毒素的产生和吸收;并下调炎症细胞活性,减少TNF-α、IL-1β等炎症细胞因子的产生和释放。这可能是利开灵明显改善脑出血后脑水肿的作用机制之一。
[1] 屈传强,麻琳,郭洪志,等.急性脑出血致脑源性多器官功能障碍综合征模型IL-1β的基因表达及与血清内毒素的相关性研究[J].山东大学学报(医学版),2007,45(4):353-356.
[2] 傅晨,张允岭,常富业,等. 利开灵对脑出血大鼠脑组织CD14、TLR4mRNA表达的影响[J].中华中医药杂志,2011,26(5):930-934.
[3] Rosenberg GA,Mun-Bryce S,Wesley M,et al.Collagenase-induced intracerebral hemorrhage in rats[J].Stroke,1990,21(5):801-807.
[4] Bederson JB,Pittd LH,Tsuji M,et al. Rat middle cerebral artery occlusion:evaluation of the model and development of a neurological examination[J]. Stroke,1986,17(3):472-476.
[5] 喻明. 脑出血血肿周围的炎症反应机制及其损伤作用[J]. 医学综述,2005,11(10):913-915.
[6] Castillo J,Dávalos A,Alvarez-Sabín J,et al.Molecular signatures of brain injury after intracerebral hemorrhage[J].Neurology,2002,58(4):624-629.
[7] Mayne M,Ni W,Yan HJ,et al.Antisense oligodeoxynucleotide inhibition of tumor necrosis factor2alpha expression is neuroprotective after intracerebral hemorrhage[J].Stroke,2001,32(1):240-248.
[8] Kimelberg HK.Current concepts of brain edema.Review of laboratory investi- gations[J]. J Neurosurg, 1995, 83(6):1051-1059.
[9] Doig CJ,Sutherland LR,Sandham JD,et al.Increased intestinal permeability is associated with the development of multiple organ dysfunction syndrome in critically ill ICU patients[J]. Am J Respir Crit Care Med,1998,158(2):444-451.
[10] Dziedzic T,Bartus S,Klimkowicz A,et al.Intracerebral hemorrhage triggers interleukin-6 and interleukin-10 release in blood[J].Stroke,2002,33(9):2334-2335.
[11] 彭镜,尹飞,甘娜,等.内毒素脂多糖对体外血脑屏障模型通透性的影响及其机制研究[J].中华医学杂志,2006,86(27):1924-1926.
[12] 常富业,王永炎,杨宝琴,等.利开灵治疗急性脑出血临床研究[J].中国中医急症,2005,14(5):393-394.
[13] 常富业,王永炎,高颖,等.开通玄府对大鼠实验性脑出血脑水肿的效应研究[J].中医药学刊,2005,23(10):1784-1787.
