股骨头骨缺损表面积比与股骨头塌陷预测的动物模型制备
2011-06-09苏敬阳侯勇曹斌韩永台
苏敬阳 侯勇 曹斌 韩永台
股骨头坏死(osteonecrosis of the femoral head,ONFH)是骨科一种常见病,致残率高,挽救关节的措施非常重要[1]。早期诊断并对预后进行预测以选择最佳治疗手段,是达到保存股骨头及髋关节功能的关键[2]。目前尚没有软骨下骨缺损表面积大小与股骨头软骨塌陷关系的动物模型报道。我们2005年1月至2006年5月采用环钻钻骨法造成软骨下骨缺损,通过对股骨头软骨塌陷与软骨下骨骨缺损表面面积大小的关系初步研究,探讨股骨头缺损的表面积与股骨头软骨塌陷的相关性。为临床治疗股骨头坏死Ficat分期Ⅰ、Ⅱ期的髓芯减压和(或)股骨头和颈交界处开窗游离植骨治疗提供理论依据,提高股骨头坏死早期诊断,减少坏死塌陷发生率,推迟和减少股骨头置换。
1 资料与方法
1.1 实验动物 健康中国家兔30只,雌雄并用,兔龄5个月左右,体重(2.5±0.5)kg。
1.2 动物模型制备 麻醉(3%戊巴比妥纳进行腹腔注射麻醉,剂量为25 mg/kg)生效后,取家兔右髋外侧,股骨大粗隆为一纵行棘板,为参照作小切口,暴露股骨大粗隆下部,部分凿出约5.0 mm直径的骨窗,在C型臂引导下,分别选用不同直径的环钻,经骨窗沿股骨颈向股骨头外上象限穿刺,距软骨表面2.0 mm(切勿穿透关节软骨)。再用1.0 mm的克氏针做一棉签,分别蘸取12 mol盐酸、氢氧化钠缓慢涂抹股骨头股缺损骨壁3遍,持续1 min,间隔15 min后,涂抹时严防化学物质外溢灼烧伤肌肉,观察30 min后,依次缝合深筋膜及皮肤,术后肌内注射青霉素20万U预防感染。
1.3 实验分组 随机分为A、B、C 3组,每组10只;A组,骨缺损直径4.0 mm组;B组,骨缺损直径5.0 mm组;C组,骨缺损直径6.0 mm组。右侧股骨头用于复制骨缺损模型,左侧为正常对照组。
1.4 观察指标 (1)大体观察:卡尺测量股骨头大小,观察股骨头外形,关节面色泽(重点骨缺损区软骨),光滑度,骨缺损区软骨有无塌陷,测量塌陷的深度和范围。(2)X线检查:分别对术后16周实验侧肢体摄X线。(3)组织学观察:软骨下骨新骨生成情况及关节软骨是否变性。按以下标准进行病理改变分级[3]:0级:无任何病理改变。Ⅰ级:骨髓坏死,骨小梁无坏死,有明显的细胞溶解,核破裂,脂肪细胞核及边界消失。Ⅱ级:除了Ⅱ级改变,同时有骨陷窝空陷,骨小梁及骨髓均坏死。
1.5 统计学分析 应用SPSS 10.0统计软件,采用Spearman等级相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 实验兔的基本情况 30只兔术后均存活16周,每组10只,实验侧股骨头直径 6.6 ~8.8 mm,平均(7.99±0.8)mm。股骨头截面为270°球冠,球冠面积的计算公式S=πR2(2+√2)(R为股骨头半径)求出股骨头表面积,骨缺损表面(球冠)面积计算公式S1=2πR(R-√R2-r2)(r为骨缺损半径),骨缺损坏死表面积比 =S1/S,A 组 S1/S=0.085±0.021,B组 S1/S=0.125±0.019,C 组 S1/S=0.190±0.014。见表1。
2.2 大体观察 A、B组:股骨头关节面光滑,软骨瓣及周围关节软骨色泽基本正常,颜色近于正常软骨面。仅3例软骨向修复区塌陷。C组:软骨瓣均有不同程度的塌陷,塌陷深度0.7~2.6 mm,软骨瓣及周围部分软骨色泽灰白、质软,无光泽,有细小的裂纹。
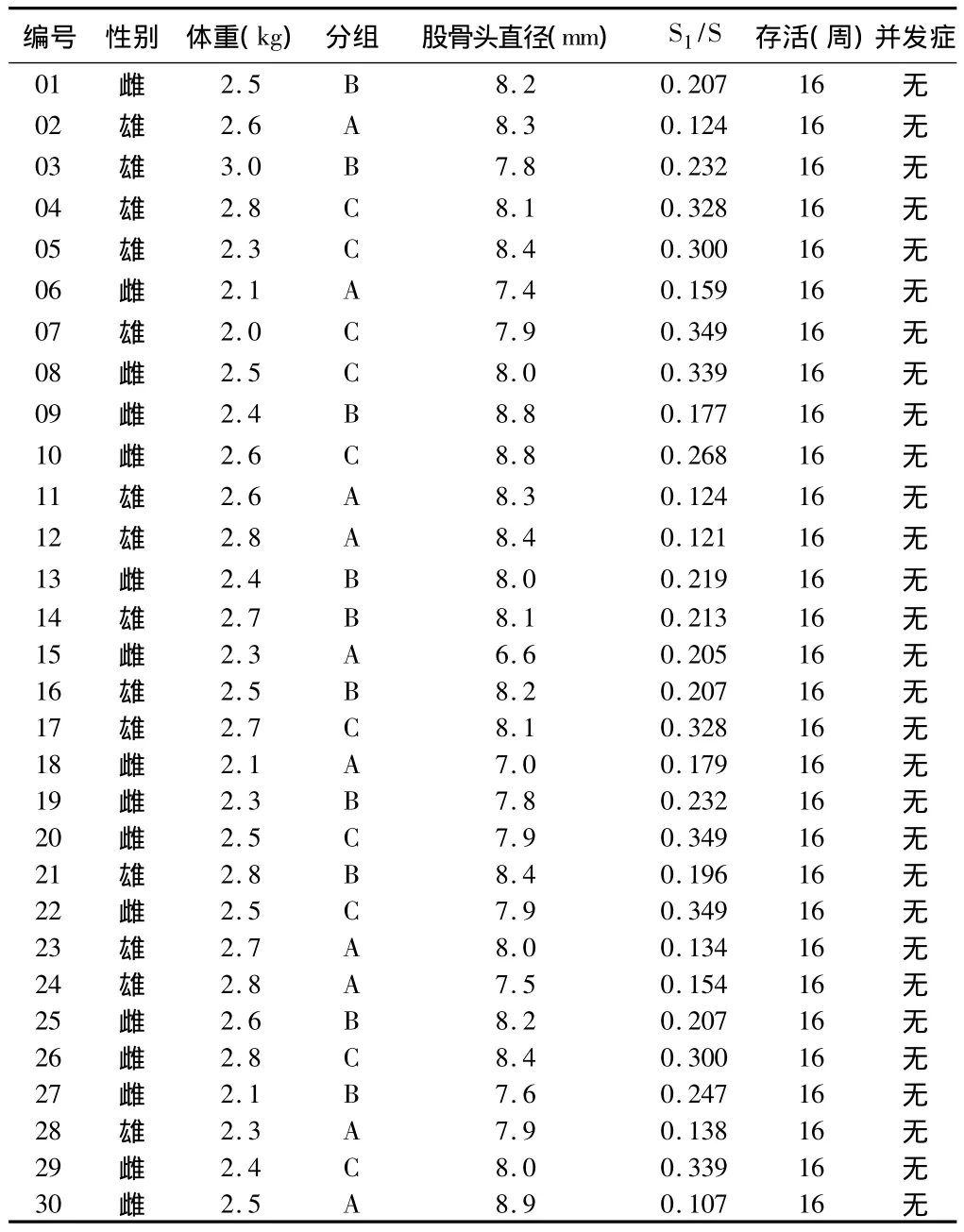
表1 实验动物一般情况
2.3 X线观察 16周时A组标本缺损区全部有生长的骨质填充,密度较均匀,未见软骨塌陷。B组标本缺损仍存在,范围已缩小。C组标本出现股骨头软骨下“新月征”改变。有骨小梁破坏,缺损区较前减少,出现股骨头部分塌陷。
2.4 病理组织学光镜检查 A组:可见不同程度和范围的血管-纤维结缔组织增生,增生的组织中含成纤维细胞,成骨细胞和破骨细胞等。有明显的新骨形成。B组:缺损区有软组织填充,软组织表面出现胶原纤维玻璃样变,软骨表面的纤维组织有部分变性坏死,无软骨样化生。骨小梁较粗,部分骨髓坏死,骨陷窝空陷存在;减压区可见大量成纤维细胞增生,部分纤维成分长入坏死小梁间隙,软骨表面的纤维组织变性坏死,未见毛细血管,骨陷窝空虚,骨小梁崩溃。C组:组织成分稀疏,骨小梁断裂。坏死骨小梁见Howship陷窝,哈氏系统结构破碎、崩裂、骨板排列紊乱。关节软骨增生区可见软骨细胞坏死。陷窝内骨细胞消失,陷窝扩大。在软骨细胞区有软骨内化骨形成,有的软骨增生肥厚,有的全层软骨细胞消失,有的全层软骨脱落骨面外露。见表2。

表2 股骨头光镜组织学病理分级结果 n=10,例
2.5 统计结果 RAB=0.241,RAC=0.757,RBC=0.692。A 组与B组差异无统计学意义(P>0.05);A组与C组,B组与C组比较差异有统计学意义(P<0.05)。分级与面积呈负相关,且分级加深则面积明显增大。
3 讨论
3.1 建立股骨头软骨下骨缺损及塌陷模型 近30年来,国内外学者为建立理想的骨坏死模型作了大量的工作[4-6]。可惜的是,没有一种动物模型的组织学和形态学改变能够完全模拟人的病理学改变。目前还缺乏一个满意的模拟人类非创伤性骨坏死的模型。Mont等[7]“活门法”建立股骨头坏死模型。选用健康成年杂交犬,切开关节囊,在股骨头颈交界处钻洞,刮除头内大部分松质骨,模拟ONFH的动物模型进行研究。这一模型适合于开窗刮除死骨和髓芯减压后植骨疗法的治疗研究。杨明亮等[8]采用12 mol/L盐酸,12 mol/L氢氧化钠依次注入家兔股骨头内灭活骨细胞,骨髓组织及破坏股骨头内的微循环,结果6周即可出现典型的骨坏死病理。因此,采用环钻钻骨法,造成不同直径大小的软骨下骨骨缺损,不直接损伤软骨及软骨下骨,克服“活门法”的不足,建立软骨下骨修复时观察软骨塌陷的动物模型,并应用化学方法使头内骨坏死,是一成功的模型。可以探讨正常活动负重状态下缺损区软骨塌陷与骨坏死表面积定量的关系。
3.2 股骨头坏死的定量测定,预测塌陷 目前诊断股骨头坏死,预测塌陷主要依靠MRI。公认的坏死指数计算法[9]是在冠状位正中和矢状位正中断面T1WI坏死边缘划线,测量坏死角,认为坏死指数33以上为塌陷危险,>66为塌陷高危。但此方法缺陷有:(1)将股骨头截面最大角度定为180°,但实际为270°左右;(2)股骨头坏死并非同心圆形坏死,多数坏死灶位于股骨头前上部,而正中层面并非是最大的坏死面;(3)测量值仍为一个截面,未能真正反映坏死灶的全貌;(4)未与标本对照,仅凭回顾性分析,准确性值得怀疑[10]。Hernigou等[11]利用连续MRI图像计算股骨头坏死的体积,虽然计算出的坏死体积与实际标本的坏死体积相符,但坏死体积大,坏死区域较深者,并没有出现塌陷。国内学者采用连续MRI图像计算坏死表面积及坏死表面积比[12],与病理标本实际测量对照,结果一致,提出该法计算是准确的。并且生物力学研究显示,股骨头是否塌陷与承重面的坏死灶表面积大小密切相关。因此,提出测定股骨头坏死表面积及坏死表面积比更有临床价值。坏死表面积比33%为塌陷临界值,>50%为塌陷高危。对坏死表面积比<33%者可采取非手术治疗或进行观察。而本实验应用兔股骨头内分别不同缺损坏死下观察关节面塌陷,发现股骨头缺损坏死表面积比<12.5%时软骨下骨有很强的修复能力,有毛细血管及成骨细胞形成。而>19.0%时,明显骨陷窝空陷存在,软骨表面无软骨样化生,发生软骨塌陷和坏死。与前者研究存在一定差别,可能与术中操作准确性有关。
3.3 股骨头坏死骨周围的应力集中是病情进展的主要原因应力集中可导致股骨头内骨折,不仅影响局部力学性能,而且可阻断坏死骨组织的修复,使负重区软骨下骨难以得到骨性修复[6]。修复能力越强,生物力学变化越明显,塌陷率越高[13]。特别是负重区软骨下骨力学性能的降低与股骨头坏死塌陷有直接的关系[14]。因此,认为判断股骨头坏死表面积<19.0%时,应密切观察病情转归,保守治疗;对>19.0%的 Ficat分期Ⅰ、Ⅱ期股骨头坏死及时进行外科干预,采用髓芯减压和(或)股骨头和颈交界处开窗游离植骨治疗,刮出头下死骨时,应以刮出囊性变部分为主,尽可能减少软骨下骨应力集中,薄弱软骨下骨的机械支撑力,并大量植骨,术后避免股骨头负重,减少压力因素。是预防头塌陷的关键。由于本实验动物物种差异,数量有限,存在个体差异,手术过程减压时造成骨缺损的位置偏移性,动物活动强度,人为造成头下骨缺损等因素,有可能影响研究结果,这一结果是否有普遍意义,有待进一步研究证实,并为临床治疗起一定指导意义。
1 Mont MA,Hungerford DS.Nontraumatic avascular necrosis of the femoral head.J Bone Joint Surg(Am),1995,77:459-474.
2 Babis GC,Soucacos PN.Effectiveness of total hip arthroplasty in the man agement of hip osteonecrosis.Orthop Clin North Am,2004,35:359-364.
3 Brown TD,Baker KJ,Brand RA.Structural consequences of subchondral bone involvement in segemental osteonecrosis of the femoral head.J Orthop Res,1992,10:79-87.
4 Plenk HJr,Gstettner M,Grosss chmidt K,et al.Magnetic resonance imaging and histology of repair in femoral head osteonecrosis.Clin Orthop,2001,386:42-53.
5 Steinberg ME,Larcom PG,Strafford B,et al.Core decompression with bone grafting for osteonecrosis of the femoral head.Clin Orthop,2001,386:71-78.
6 Brown TD,Baker KJ,Brand RA.Structural consequences of subchondral bone involvement in segemental osteonecrosis of the femoral head.J Orthop Res,1992,10:79-87.
7 Mont MA,Jones LC,Elias JJ,et al.Strut-autograft with and without osteogenic protein-1:a preliminary study of a canine femoral head defect model.J Bone Joint Surg(Am),2001,82:1013-1022.
8 杨明亮,罗先正,王正明.实验性动物股骨头坏死模型的制备及其病理生理机制.中国骨伤,2000,13:207-208.
9 Koo KH,Kim R.Quantifying the extent of osteonecrosis of the femoral head.A new method using MRI.J Bone Joint Surg(Br),1995,77:875-880.
10 卢国强,乔义岭,段琼,等.成人股骨头坏死塌陷前期的治疗现状.河北医药,2010,32:1625-1627.
11 Hernigou P,Lambotte JC.Volumetric analysis of osteonecrosis of the femur.Anatomical correlation using MRI.J Bone Joint Surg(Br),2001,83:672-675.
12 赵凤朝,李子荣,张念非,等.股骨头坏死表面积测量及在股骨头塌陷预测中的应用.中国修复重建外科杂志,2005,19:687-691.
13 徐小良,王坤正,牒军,等.实验性股骨颈骨折修复过程的生物力学研究.中国矫形外科杂志,2001,8:680-682.
14 Kim YM,Lee FY,Lee SH,et al.Morphologic and biomechanical study of avascular necrosis of the femoral head.Orthopardic,1991,24:1111-1116.
