原花青素交联牛心包材料的研究
2011-06-09万荣欣顾汉卿
万荣欣 田 聪 刘 欣 顾汉卿*
1(天津医科大学,天津 300070)
2(天津市泌尿外科研究所,天津 300211)
引言
心脏瓣膜疾病在临床上有很高的致死率,人工生物瓣膜置换术是治疗心脏瓣膜病的有效的手段之一[1]。目前,临床上应用的生物心脏瓣膜都是戊二醛(glutaraldehyde,GA)处理的猪主动脉瓣或牛心包制成的,由于易钙化、易衰败、耐久性差等问题限制其在临床上的进一步应用[2-5]。有研究表明,引起瓣膜钙化、造成瓣膜耐久性差的原因是戊二醛的应用[1]。因此,人们开始探索其他的交联剂,如多聚环氧化合物、碳化二亚胺、京尼平等理想的交联剂应具有毒性低,处理后的瓣膜具有优良力学性能、稳定性和耐久性[2]。上述交联剂还未能完全满足生物心脏瓣膜的需要。
原花青素(procyanidins,PA)是一类广泛存在于水果、蔬菜、花瓣、种子以及树皮中的植物次生代谢产物[6,7],也是红葡萄酒的重要成分,其体内代谢途径清楚[8],而且没有毒性。运用原花青素制备心脏瓣膜材料的研究文献报道还不多,因此本研究目的探讨原花青素处理的瓣膜材料的性能。按照生物型心脏瓣膜的标准以及临床需要对生物瓣膜材料进行以下几个方面的研究:交联特性、力学特性、抗酶降解性能、亲水性能、细胞毒性试验以及溶血试验等。
1 材料和方法
1.1 试剂与仪器
戊二醛(Kermel,天津)、原花青素(尖峰天然产物研究开发有限公司,天津)、Ⅰ型胶原酶(Gibco,USA)、茚三酮(Kermel,天津)、气浴恒温振荡器(苏州威尔实验用品有限公司,SHZ-82B)、EnduraTEC ELF3200生物力学测试仪(Bose公司)、Perkin-Elmer DSC-7热变性分析仪、722S型可见分光光度计(上海菁华科技仪器有限公司)。
1.2 实验方法
1.2.1 瓣膜材料的制备
取屠宰场新鲜的健康成年黄牛心包膜,置入4℃生理盐水中带回实验室,剔除外周脂肪,取无损伤、厚度均匀的前壁部分修剪为3 cm×4 cm的小片,磷酸缓冲液(PBS)溶液充分漂洗。热缺血时间控制在6 h以内。将修剪好的牛心包组织放入0.625%的戊二醛溶液和0.5%的原花青素溶液中,37℃摇床交联72 h。将对以下三组材料性能检测:新鲜牛心包组(fresh)、戊二醛组(GA)、原花青素组(PA)。
1.2.3 材料检测方法1.2.3.1 厚度
用螺旋测微器对脱细胞及交联前后的组织厚度进行测量,考察交联前后组织的大体形态学变化(n=14)。
1.2.3.2 材料的亲水性检测
含水量测试:将湿态样品夹在两层干滤纸中间,滤纸上压一重50 g的物体30 s,测得样品湿重;将样品真空冷冻干燥24 h测得干重。按式(1)计算样品的含水率。

接触角测试:接触角是表征材料表面亲水性能的重要参数之一,本实验采用 JC2000C1接触角测试仪考察样品的表面亲水性能,每个样品取五个平行样。
1.2.3.3 力学性能测试
将样品沿纤维走向剪成1 cm×4 cm的长条状,用EnduraTEC ELF3200生物力学测试仪固定两端,预留长度15 mm,按10 mm/min的加载速度对样品进行相应指标的测定。
1.2.3.4 交联指数的测定
自由氨基酸与茚三酮溶液在100℃下共热生成蓝紫色溶液,且自由氨基酸含量与蓝紫色溶液的光吸收值成正相关。具体方法如下:将0.02 g干重组织与1 mg/mL的茚三酮溶液沸水浴15 min,用牛血清白蛋白做标准曲线,722型可见分光光度计在440 nm下测定光吸收值,结合标准曲线计算组织中自由氨基酸的含量。按式(2)计算交联指数。

1.2.3.5 变性温度测定
将样品剪碎成约 1 mm×1 mm的小片,用Perkin-Elmer DSC-7热变性分析仪对样品进行DSC扫描分析,升温范围为40℃ ~130℃,升温速率为10℃ /min。
1.2.3.6 体外降解
采用添加了双抗的0.05 mg/mL的Ⅰ型胶原酶溶液作为降解液,取约0.02 g干重组织,按组织重量(mg):降解液用量(m l)=1∶0.5添加,37℃恒温震荡,冻干称重。降解率按照式(3)计算。

1.2.3.7 细胞毒性试验
按照国家标准 GB/T 16886.5-2003和 GB/T 16175-2008进行细胞毒性试验,方法如下:分别取各组材料2 g剪成1 cm×2 cm,Co60灭菌后,浸于10 mL含有血清的1640培养液中37℃静置72 h,将浓度为2×104个/ml的L929细胞悬浮液加入在24孔细胞培养板中每孔1 mL,培养24 h,培养液弃之,分别加入样品浸提液、阴性对照(1640培养液)、阳性对照(含有0.5%苯酚的培养液)各组溶液分别1 mL,并将培养板培养箱中培养 1、3、5 d,甲醛固定,结晶紫染色、SDS(十二烷基苯磺酸钠)抽提,722分光光度计测定各组吸光度值(波长为588 nm)。
根据下面式(4)计算。

表1是细胞增殖度法的分级标准,按照表1进行细胞毒性分级。

表1 细胞毒性分级标准Tab.1 The evaluation standard of cytotoxicity
1.2.3.8 溶血试验
按照国家标准GB/T 14233.2-2005进行溶血试验的方法如下:取各组样品5 g,分别加入10 mL生理盐水,阴性对照为10 mL生理盐水,阳性对照为10 mL蒸馏水,(37±1)℃保温30 min,加稀释兔血0.2 mL,37℃保温60 min。取管内液体离心1 000 r/min,10 min,在545 nm波长下测上清液的吸光度并记录结果。按式(5)计算材料的溶血率.

1.3 统计学方法
2 实验结果
2.1 厚度结果
新鲜牛心包组织经过戊二醛或原花青素处理后的厚度的变化见表2,由表2可见:牛心包材料经过戊二醛或原花青素交联固定处理后厚度都会显著增加(P<0.05),戊二醛或原花青素处理的牛心包组织的厚度未见显著性差异(P>0.05)。
2.2 亲水性结果
新鲜牛心包组织经过不同方法处理后的含水量以及表面接触角比较结果见表3,可见:牛心包组织经过戊二醛交联后,含水量未见明显变化(P>0.05);原花青素交联固定的牛心包材料含水量减少(P<0.05)。材料的表面亲、疏水性能可由材料表面接触角来说明,经过戊二醛或原花青素处理后的牛心包表面的亲水性能显著增强,接触角减小,而GA组和PA组之间未见显著性差异。

表2 GA和PA交联组织厚度变化比较(n=14)Tab.2 Thickness of group Fresh,group GA and group GP(n=14)
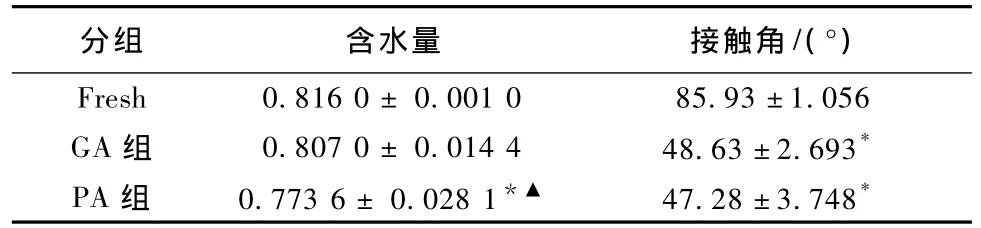
表3 各组牛心包组织含水量和接触角比较(n=5)Tab.3 The contrast of mositure content and contact angle(n=5)
2.3 力学性能检测结果
表4是牛心包材料经过不同方法处理后的力学性能的结果。由表4可见,戊二醛交联后的牛心包组织断裂强度和新鲜牛心包组织比较未见显著性差异(P>0.05),而经过原花青素交联后的牛心包组织的断裂应力明显高于GA交联组和新鲜牛心包组(P<0.05);经过戊二醛或原花青素交联固定的牛心包组织的伸长率和新鲜牛心包组未见显著性差异;但牛心包组织经过戊二醛或原花青素交联后弹性模量都明显增加(P<0.05),原花青素交联后组织弹性模量高于戊二醛交联组织(P<0.05),可见牛心包材料经过原花青素交联后质地会变硬。
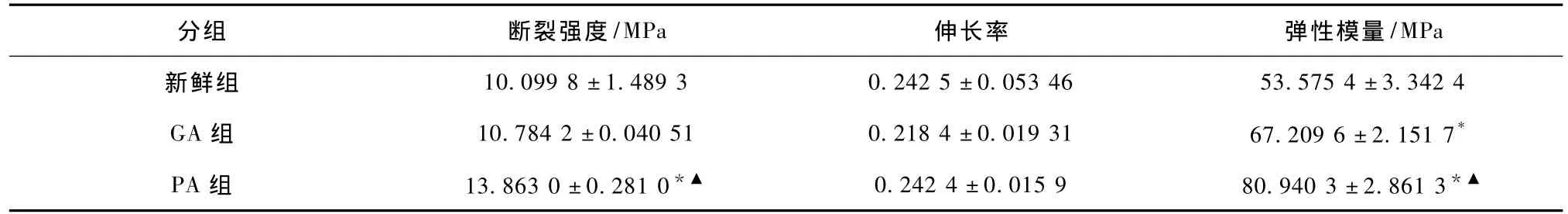
表4 各组牛心包组织力学性能检测结果(n=4)Tab.4 The contrast of fracture stress,break elongation and elastic modulus(n=4)
2.4 交联特征
经过不同方法处理后材料的交联度和变性温度结果见表5。通过茚三酮比色法测得的各组交联度结果可知:戊二醛交联组交联度较高,达到98.64%,而经过原花青素交联的组织的交联度仅为48.24%,交联度明显低于戊二醛,这可能与交联度检测时的高温加热有关。而经过戊二醛或原花青素处理后的牛心包材料的变性温度都明显提高,而GA组和PA组比较未见显著性差异(P>0.05)。

表5 新鲜组、戊二醛交联和原花青素交联牛心包交联度特性的比较(n=3)Tab.5 Crosslinking characteristics of fresh and procyanidin-and glutaraldehyde-fixed bovine pericardia(n=3)
2.5 体外降解结果
图1是新鲜牛心包组、原花青素交联组和戊二醛交联组在胶原酶溶液经过不同时间降解其失重率的变化。由图1可见,经过戊二醛或原花青素交联处理可以明显降低牛心包组织的抵抗胶原酶降解的能力,新鲜牛心包组织在胶原酶溶液中浸泡8 d后失重率达到95%以上,而经过戊二醛或原花青素的固定处理组织胶原酶溶液降解8 d失重率仅为2.87%和4.84%,两种交联剂交联的牛心包组织在各个时间点的降解失重率经统计学分析,未见显著性差异(P>0.05)。
2.7 细胞毒性试验结果
新鲜组、PA组和GA组的材料细胞毒性结果如表6所示,可见,新鲜牛心包组织经过戊二醛后,其浸提液于L929细胞共培养,L929细胞增殖率显著下降,并且随着培养时间的延长,细胞增殖率逐渐减小,按照细胞毒性评级标准均在2级和3级,细胞毒性较大;新鲜牛心包组织经过原花青素交联后,在浸提液与细胞共培养短时间内细胞增殖率较小(76.19%),但随着培养时间的延长,细胞的增殖率逐渐增加,第5 d时L929细胞相对阴性对照增值率达到100.12%,按照细胞毒性评级标准接近0级。可见经原花青素和戊二醛交联的组织经过相同时间的清洗,PA组对L929细胞株的毒性较小。
2.8 溶血试验结果
各组牛心包材料溶血试验的结果如见表7所示,可知,新鲜牛心包组织经过戊二醛或原花青素交联后,溶血率显著下降,而原花青素交联的牛心包组织的溶血率是最小的,符合溶血率小于5%的标准,原花青素交联的组织经过相同时间的清洗,溶血率远远小于戊二醛交联的组织。

表6 各组瓣膜材料浸提液对L929细胞株增殖率的影响及评级结果Tab.6 The effects of each sample extract derivatives to L929 cell

表7 各组牛心包材料溶血率的比较(n=3)Tab.7 The hemolysis rate of each group(n=3)
3 讨论和结论
原花青素是一类广泛存在于水果、蔬菜、花瓣、种子以及树皮中的植物次生代谢产物[6-7],也是红葡萄酒的重要成分,它被广泛用于天然抗氧化剂、自由基清除剂、心血管系统的保护剂等等[9-10],不仅如此,它还具有抗菌、抗病毒、抗癌、消炎等活性[11-12]。另外,原花青素未见急性和亚急性毒性反应,并且其在体内代谢途径清楚[8]。哺乳动物的心包组织是由胶原纤维组成的,Naimark等研究表明牛心包组织的胶原蛋白的含量约为80%[13]。由胶原组织制备的生物瓣膜在植入人体内之前必须进行交联处理和灭菌处理。自20世纪60年代,戊二醛交联技术作为一种被人们认可的方法广泛应用于生物医学领域,但应用中人们发现于戊二醛交联制备的生物瓣不够柔软,容易在体内工作时形成应力集中,容易钙化衰败,造成生物瓣工作寿命不长[14]。近来,Han等证实原花青素对胶原蛋白和以胶原蛋白为主要组成的组织有明显的交联作用,且皮下植入后未出现如戊二醛引起的细胞毒性、抑制胶原合成和钙化现象[15]。
本研究中的生物瓣膜材料就是采用新鲜的黄牛心包,用对心脑血管有诸多益处的天然物质原花青素为交联剂,根据人工生物瓣膜材料的临床应用和人工心脏瓣膜的国家标准GB 12779-2008对处理后的材料进行性能表征,将与传统的戊二醛固定技术作对比。
测定自由氨基官能团的减少量和固定组织的变性温度用来衡量交联度,生物组织中自由氨基基官能团的减少降低了它的抗原性[13]。本研究中发现新鲜牛心包组织经过戊二醛或原花青素交联处理后,变性温度显著提高,说明戊二醛或原花青素交联牛心包组织的胶原纤维和胶原蛋白更为稳定,因此提高了固定组织的稳定性。研究中发现经过原花青素交联的牛心包组织的交联度比较低,分析可能与交联度检测过程中的高温加热有关。
虽然戊二醛或原花青素固定组织的厚度有所增加,但固定后组织的断裂强度并未减小。所有经过原花青素处理的牛心包组织的断裂强度还显著提高,原花青素交联组织的无论断裂强度还是伸长率都优于传统交联剂戊二醛。研究结果显示经过原花青素处理的组织弹性模量较大,质地比较硬,有研究表明将原花青素处理的组织放在D-Hanks液中浸泡15 d后,其弹性模量接近新鲜组织的弹性模量[16]。
体外酶降解是人们经常用来考察交联后胶原组织稳定性的方法之一[17]。因为牛心包组织中主要成分是 I型胶原,所以选择 I型胶原酶作为酶降解实验的酶来考察材料的生物稳定性。由实验结果表明牛心包组织经过原花青素处理后,其抵抗胶原酶降解的性能显著提高,其效果和传统交联剂戊二醛比较未见统计学差异,因此认为经过戊二醛或原花青素固定可以显著提高组织的生物稳定性。
生物学评价的内容很多在ISO10993即G/BT16886系列标准中都有具体的规定,其中细胞毒性试验和溶血试验是最敏感也是最基本的试验,所以本研究中选择这两种试验对生物瓣膜材料进行初步生物学评价。运用天然交联剂原花青素或传统交联剂戊二醛制备的生物瓣膜材料经过初步生物学检测表明:经过相同时间的清洗,原花青素固定组织的溶血率远远小于传统的戊二醛固定的组织;运用细胞增殖度法进行细胞毒性试验结果表明:原花青素交联组织的浸提液在与L929细胞共培养短时间内会影响其增殖速率(76.19%),随着培养时间的延长对细胞的影响逐渐减小,在第7 d时细胞相对增值率达到100.12%。
综上所述,经过天然交联剂原花青素处理的牛心包组织的稳定性、力学特性、表面亲水性能和抗酶降解能力都显著提高,与传统交联剂戊二醛相比稳定性、力学特性、亲水性能和抗酶降解能力相当,最大断裂强度提高,固定组织的毒性也显著降低。初步研究表明原花青素作为制备人工生物心脏瓣膜材料的新方法,具有很好的研究前景。
[1]Neuenschwander S, Hoerstrup SP. Heart valve tissue engineering[J].Transpl Immunol,2004,12(3 - 4):359 - 365.
[2]Schmidt CE,Baier JM.Acellular vascular tissue:natural biomateralsfortissue repairand tissue engineering[J].Biomaterals,2000,21(22):2215 - 2231.
[3]Ellsmere JC,Khanna RA,Lee JM.Mechanical loading of bovine pericardium acceleratesenzymatic degradation[J].Biomaterials,1999,20(12):1143 -1150.
[4]Trantina-Yates AE,Human P,et al.Mitigation of bioprosthetic heart valve degeneration through biocompatibility:in vitro versus spontaneous endothelialization[J].Biomaterials 2001,22(13):1837-1846.
[5]Stock UA,Schenke-Layland K.Performance of decellularized xenogeneic tissue in heart valve replacement[J].Biomaterials,2006,27(1):1-2.
[6]Joshi SS,Kuszynski CA,Bagchi D.The cellular and molecular basis of health benefits of grape seed proanthocyanidin extract[J].Curr Pharm Biotechnol,2001,2(2):187 -200.
[7]FineAM. Oligomericproanthocyanidin complexes:history,structure,and phytopharmaceutical applications[J].Altern Med Rev,2000,5(2):144 -151.
[8]Packer L,Rimbach G,Virgili F.Antioxidant activity and biologic properties of a procyanidin-rich extract from pine(Pinus Maritima)bark,pycnogeno[J]l.Free Radic Biol Med,1999,27(5-6):704-724.
[9]Bagchi D,Bagchi M,Stohs SJ,et al.Free radicals and grape seed proanthocyanidin extract:importance in human health and disease prevention[J].Toxicology,2000,148(2 - 3):187 -197.
[10]Bagchi D,Sen CK,Ray SD,et al.Molecular mechanisms of cardioprotection by a novel grape seed proanthocyanidin extract[J].Mutat Res,2003,163(3-5):523-524
[11]Jayaprakasha GK,Selvi T,Sakariah KK.Antibacterial and antioxidant activities of grape(Vitis vinifera)seed extracts[J].Food Res Int,2003,36(2):117 -122.
[12]DongmoAB, KamanyiA, Anchang MS, etal. Antiinflammatory and analgesic properties of the stem bark extracts of Erythrophleum suaveolens(Caesalpiniaceae)[J].Guillemin&Perrottet.J Ethnopharmacol,2001,77(2 -3):137 -141.
[13]Naimark WA,Lee JM,Limeback H,et al.Correlation of structure and viscoelastic properties in the pericardia of four mammalian species[J].Heart Circ Physiol,1992,32:1095 - 1006.
[14]Zeeman R,Dijkstra PJ,van Wachem PB,et al.Successive epoxy and carbodiimide cross-linking of dermal sheep collagen[J].Biomaterials,1999,20:921 -931.
[15]Han B,Jaurequi J,Tang WB,et al.Proanthocyanidin:a natural crosslinking reagent for stabilizing collagen matrics[J].J Biomed Mater Res,2003,65A(1):118 -124.
[16]Zhai Wanyin,Chang Jiang,Lin Kaili,et al.Crosslinking of decellularized porcine heart valve matrix by procyanidins[J].Biomaterials,2006,27:3684-3690.
[17]Goo HC, HwangYS, YonRC, etal. Developmentof collagenase-resistant collagen and its interaction with adult human dermal?broblasts[J].Biomaterials,2003,4(28):5099-5013.
