榄香烯对人肝癌HepG-2细胞增殖及拓扑异构酶表达的影响
2011-06-09梁鑫淼崔晓楠
龚 敏,梁鑫淼,崔晓楠
(1.大连医科大学附属第一医院肿瘤科,辽宁 大连 116011;2.中科院大连化学物理研究所,辽宁 大连 116023)
目前化疗药物对肝癌有效率不超过20%[1]。靶向药物,如sorofenib、erlotinib等未能改变肝癌治疗现状[2]。因而探索高效低毒的抗肝癌药物历来是医学关注的热点。榄香烯(elemene,ELE)是从活血化瘀中药姜科植物温莪术中提取出的抗癌活性单体,研究表明 ELE对多种肿瘤具有抑制作用[3-5],表现出高效低毒的中药特质,尤其对肝癌显示出良好临床疗效[7]。然而,其机制有待深入研究。TOPOⅠ、TOPOⅡ是调节核酸拓扑构型的关键酶,已成为抗癌药物研究的重要靶点之一[9],目前关于ELE对TOPOⅠ、TOPOⅡ的作用机制未见报道。本研究观察了ELE对人肝癌HepG-2细胞增殖、细胞凋亡及TOPOⅠ、TOPOⅡ表达的影响。
1 材料与方法
1.1材料人肝癌细胞株HepG-2(大连医科大学附属第一医院中心实验室传代、保存);ELE(大连金港制药有限公司,批号0508031);MTT(Biosharp公司);AnnexinV试剂盒(美国Molecular Probes公司);RT-PCR试剂盒(大连宝生物工程有限公司);PCR扩增引物(由大连宝生物工程有限公司合成);碘化丙啶(Sigma公司);溴化乙锭(Amresco公司);TRIzol试剂盒(Invitrogen公司);氯仿、异丙醇、乙醇(均为国产分析纯);十二烷基硫酸钠、四甲基乙二胺、丙烯酰胺和亚甲双丙烯酰胺(美国Sigma公司);甘氨酸(上海生工生物工程技术有限公司);1 mol·L-1Tris(pH 6.8)、1.5 mol·L-1Tris(pH 8.8)和超敏ECL化学发光试剂盒(碧云天生物技术研究所);蛋白质定量试剂盒(BCA法)(凯基生物有限公司);兔抗人TOPOⅠ多克隆抗体(sc-10783),兔抗人TOPOⅡ多克隆抗体(sc-13059)(Santa Cruz公司);辣根酶标记山羊抗兔IgGⅡ抗(河北博海生物工程有限公司)。
1.2细胞培养将HepG-2细胞接种于含10%新生牛血清的低糖IMDM培养基中。孵箱的培养环境为5%CO2,37℃,饱和湿度。每两天更换1次培养基,细胞长至铺满瓶底约90%,用质量浓度为2.5 g·L-1胰蛋白酶消化传代培养。
1.3细胞形态学观察设对照组和ELE(20、40、60、80、100 mg·L-1)浓度组。细胞接种在 6 孔板上,作用72 h后,倒置光学显微镜下观察HepG-2细胞形态变化。实验重复3次。
1.4MTT法检测肿瘤细胞增殖96孔板中每孔接种5 000个细胞100 μl。分对照组、药物 ELE(20、40、60、80、100、120、140、160、180 及 200 mg·L-1)10个浓度组,培养时间分别24、48、72 h,每组8个复孔,于37℃,5%CO2条件下培养,各时间点进行MTT 试验,每孔加入 MTT 液(5 g·L-1)20 μl,继续培养4 h,小心吸去培养液,每孔加入二甲基亚砜(DMSO)150 μl,震荡 6 min,用酶标仪 570 nm 波长测定各孔吸光度(A),根据A值计算抑制率。抑制率(IR)/%=(1-试验组A值/对照组A值)×100%。以药物浓度为横轴,细胞抑制率为纵轴,根据量效曲线计算半数抑制浓度(IC50值)。实验重复3次。
1.5流式细胞仪检测细胞凋亡取对数生长期细胞按5×108个·L-1浓度接种于25 cm2培养瓶内,设立对照组和实验组(ELE浓度为20、40、60 mg·L-1),分别作用24、48 h收集细胞,用预冷的PBS洗2遍,1×Binding buffer调整细胞至1 ×109·L-1余按试剂盒说明书操作,在流式细胞仪(FCM)上对细胞凋亡及死亡进行荧光检测和分析。实验重复3次。
1.6 RT-PCR检测TOPOⅠ、TOPOⅡmRNA表达取对数生长期细胞调浓度至5×108·L-1接种于25 cm2培养瓶内,设立对照组和实验组(ELE浓度为20、40、60 mg·L-1),培养 48 h 后收集各组细胞。用TRIzol提取细胞总RNA。RT-PCR步骤按照TaKaRa RNA PCR Kit(AMV)Ver.3.0说明书进行,将RNA反转录合成cDNA,以cDNA为模板,进行PCR反应,β-actin为内参照。β-actin引物大小为404 bp,上游引物5'-GGACTTCGAGCAAGAGATGG-3';下游引物:5'-ACATCTGCTGGAAGGTGGAC-3'。TopoⅠ引物大小为565 bp:上游引物:5'-CGCTATCCTGAAGGCATCAA-3';下游引物:5'-CTGGAGGAGGAGAAGGAACC-3'。TopoⅡ引物大小为233 bp:上游引物:5'-CTTGTACTGCAGACCCACA-3';下游引物:5'-ATAATAGAATCAAGGGAATTCCCAAGTC-3'。将PCR产物在1×TAE缓冲液中1.5%琼脂糖凝胶电泳30 min,电压控制在90 V,UVP凝胶成像及分析系统观察、拍照、分析。实验重复3次。
1.7Western blot检测TOPOⅠ、TOPO II蛋白的表达取对数生长期细胞调浓度至5×108·L-1接种于25 cm2培养瓶内,设立对照组和实验组(ELE浓度为20、40、60 mg·L-1),培养 48 h 后,吸掉培养液,用预冷PBS冲洗3次,RIPA裂解液裂解细胞提取细胞内蛋白,BCA法进行蛋白质定量,用8%SDS-PAGE凝胶进行电泳分离,转PVDF膜。封闭液室温封闭1 h,按适当比例加入一抗,4℃孵育过夜,TBST洗3次,按1∶3 000的稀释倍数加入辣根酶标记的二抗,室温孵育1 h,TBST洗3次,用ECL显色并曝光于X胶片。将底片扫描,并用Image J软件的图像分析仪分析。实验重复3次。
1.8统计学方法数据以¯x+s表示,采用SPSS 11.5软件进行统计学分析。数据分析采用单因素方差检验。
2 结果
2.1ELE对人肝癌HepG-2细胞生长抑制形态学观察在倒置光学显微镜下,观察到ElE在体外可以明显抑制人肝癌HepG-2细胞的生长。培养72 h后对照组细胞为贴壁的梭形细胞,细胞排列紧密。而加入不同浓度的ELE干预的HepG-2细胞,随着浓度增加,细胞体积逐级缩小,胞膜皱折,核浆比例减小,核边聚伴有碎裂,原来堆积成团的HepG-2细胞结合力下降,松散成个体漂浮,散在分布。视野内可见细胞崩解碎片增多(Fig 1)。

Fig 1 Effect of ELE on cell morphology of human hepatocellular carcinoma HepG-2(×40)
2.2MTT法检测肿瘤细胞生长状态随着药物浓度增加,细胞增殖能力逐渐下降,表现为时间和剂量依赖性;药物作用24、48和72 h后,IC50值分别为96.13、80.84、60.95 mg·L-1(Fig 2)。
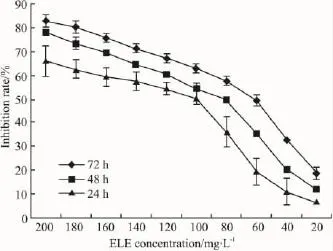
Fig 2 Inhibitory effect of ELE on proliferation of human hepatocellular carcinoma HepG-2 cells
2.3ElE对人肝癌HepG-2细胞凋亡的作用不同浓度的ELE分别作用于HepG-2细胞24、48 h,应用AnnexinV和PI染色后,FCM分析细胞凋亡。结果表明,与对照组相比,药物组凋亡细胞比例增高,表现为时间和剂量依赖性(Tab 1,Fig 3)。
Tab 1 ELE dose-dependent apoptosis rate(48 h,% ,±s,n=3)

Tab 1 ELE dose-dependent apoptosis rate(48 h,% ,±s,n=3)
ELE concentrations Late apoptosis Early apoptosis Total apoptotic ratio Necrotic ratio Negative control 0.49 ±0.17 0.58 ±0.19 1.07 ±0.35 0.44 ±0.18 60 mg·L -1 14.03 ±1.08 20.36 ±1.92 34.38 ±2.61 8.38 ±1.27 40 mg·L -1 12.23 ±0.52 14.91 ±1.38 27.14 ±0.87 6.63 ±0.78 20 mg·L -16.24 ±0.88 8.45 ±1.15 14.69 ±1.77 3.23 ±0.82

Fig 3 Effect of ELE on apoptosis of human hepatocellular carcinoma HepG-2 cells
2.4 ELE对人肝癌HepG-2细胞TOPOⅠ和TOPOⅡmRNA表达的影响ELE作用48 h后TOPOI mRNA、TOPOⅡmRNA的表达随药物浓度的升高表达降低。实验组(ELE浓度分别为20、40、60 mg·L-1),TOPOⅠmRNA 与 β-actin mRNA 光密度比值(0.84±0.08、0.68±0.01、0.58±0.04)明显低于对照组(1.10±0.06)(P<0.05);TOPOⅡmRNA与β-actin mRNA光密度比值(0.93±0.03、0.71±0.03、0.57±0.02)明显低于对照组(1.18±0.03)(P<0.05),提示ELE可抑制TOPOⅠ、TOPOⅡ转录,并呈剂量依赖性(Fig 4)。
2.5Western blot检测结果随着给药物组ELE浓度的增高,TOPOⅠ蛋白,TOPOⅡ蛋白表达降低。20、40、60 mg·L-1浓度的 ELE 作用人肝癌 HepG-2细胞48 h后,TOPOⅠ蛋白与β-actin蛋白条带的光密度比值为(0.960±0.036、0.759±0.034、0.591±0.049)明显低于对照组(1.161±0.043)(P<0.05);TOPOⅡ蛋白与β-actin蛋白条带的光密度比值(0.937±0.029、0.752±0.015、0.600±0.017)明显低于对照组(1.134±0.045)(P<0.05),提示ELE可抑制TOPOⅠ蛋白,TOPOⅡ蛋白表达,并呈剂量依赖性(Fig 5)。
3 讨论
从天然药物中筛选高效低毒的抗肿瘤药物是获取抗肿瘤药物的基本策略。ELE是祖国传统中药温莪术中提取的抗癌单体,临床抗肿瘤疗效评价良好,尤其对化疗非敏感肿瘤肝癌表现出抑癌效果[5-7]。基础研究表明ELE能够促进肿瘤细胞凋亡[8],诱导细胞周期阻滞,干扰信号传导通路,抑制肿瘤转移等多靶位抗肿瘤作用。然而有关ELE对TOPO酶的作用未见报道。
拓扑异构酶(TOPO)是一种通过调节核酸空间动态变化从而控制核酸生理功能的关键酶,分为TOPOI型和TOPOⅡ型两种类型,通过干扰TOPOⅠ和(或)TOPOⅡ诱导细胞凋亡是目前抗癌药物的重要作用机制[9]。一线抗肿瘤药物羟基喜树碱、拓扑替康和伊立替康是以TOPOⅠ为靶位;依托泊苷和替尼泊苷是以TOPOⅡ为靶位实现诱导肿瘤细胞凋亡的药效机制。在本实验中,我们发现ELE能够抑制人肝癌HepG-2细胞增殖,诱导其凋亡,呈时间与剂量依赖性。诱导凋亡是药物实现肿瘤杀伤的重要途径,抗肿瘤药物通过不同的机制诱导了细胞凋亡过程。有别于经典的抗肝癌药物,如一线抗肝癌药物顺铂通过在大分子水平上直接破坏DNA的双链;氟尿嘧啶通过在小分子水平上阻断DNA的合成,进而启动肿瘤细胞凋亡程序,我们的实验表明ELE能够下调TOPOⅠ、TOPOⅡmRNA和蛋白的表达。因此,提示ELE抑制人肝癌HepG-2细胞增殖,诱导肿瘤细胞凋亡,可能是通过下调TOPOⅠ、TOPOⅡ表达,从而实现药效机制。研究表明ELE能够影响肝癌细胞凋亡相关基因、热休克蛋白及其相关调控因子基因的表达,抑制肝癌细胞迁移、侵袭等[10-13],表现为多靶位的抗肝癌作用,然而,有关ELE对TOPO酶的影响未见报道。我们的研究首次表明干扰TOPOⅠ、TOPOⅡ表达可能为ELE抑制肝癌的作用靶位,ELE是值得关注的抗肝癌药物。

Fig 4 TOPOⅠmRNA and TOPOⅡmRNA expressions of human hepatocellular carcinoma HepG-2 cells interfered by ELE for 48 h

Fig 5 TOPOⅠprotein and TOPOⅡprotein expressions of human hepatocellular carcinoma HepG-2 cells interfered by ELE for 48 h
[1]孙 燕,石远凯.原发性肝癌.临床肿瘤内科手册[M].第5版,北京:人民卫生出版社,2007:539-49.
[1]Sun Y,Shi Y K.Primary hepatocarcinoma.Clinical tumor medical handbook[M].5th ed,Beijing:People's Medical Publishing House,2007:539 -49.
[2]Song I H.Molecular targeting for treatment of advanced hepatocellar carcinoma[J].Korean J Hepatol,2009,15(3):299 - 308.
[3]Wu X S,Xie T,Lin J,et al.An investigation of the ability of elemene to pass through the blood-brain barrier and its effect on brain carcinomas[J].J Pharm Pharmacol,2009,61(12):1653 -6.
[4]Xie C Y,Yang W,Li M,et al.Cell apoptosis induced by deltaelemene in colorectal adenocarcinoma cells via a mitochondrial-mediated pathway[J].Yakugaku Zasshi,2009,129(11):1403 -13.
[5]Li Q Q,Wang G,Huang F,et al.Antineoplastic effect of beta-elemene on prostate cancer cells and other types of solid tumour cells[J].J Pharm Pharmacol,2010,62(8):1018 -27.
[6]Hu Y H,Huang X R,Qi M X,et al.Study on proteomics of inhibitory effects of elemene on proliferation of human lens epithelial cell[J].Zhonghua Yan Ke Za Zhi,2010,46(5):427 - 31.
[7]Guo L,Shi G,Gao Z,et al.Response to hepatocarcinoma Hca-F of mice immunized with heat shock protein 70 from elemene combo tumor cell vaccine[J].Cell Mol Immunol,2006,3(4):291 - 5.
[8]王茜莎,杨 威,董金华,等.δ-榄香烯通过线粒体途径诱导人结肠癌细胞DLD-1凋亡的研究[J].中国药理学通报,2010,26(5):646-52.
[8]Wang X S,Yang W,Dong J H,et al.Cell apoptosis induced by δelemene in colorectal adenoarcinoma cells via mitochondrial-mediated pathway[J].Chin Pharmacol Bull,2010,26(5):646 - 52.
[9]孙 宇,单路娟,崔晓楠,等.华蟾素注射液对人肝癌HepG-2细胞增殖及凋亡的影响[J].中国肿瘤,2010,19(6):410 -3.
[9]Sun Y,Shan L J,Cui X N,et al.Impact of cinobufacini injection on proliferation and cell cycle of human hepatoma HepG-2 cells[J].China Cancer,2010,19(6):410 -3.
[10]高志红,郭连英,沈 杰,等.榄香烯或热休克对人肝癌细胞ItepG2 HSP70膜表达及多种HSP基因表达的影响[J].中国免疫学杂志,2009,18(11):790 -4.
[10]Gao Z H,Guo L Y,Shen J,et al.Influence of elemene of heat shock treatment upon the expression of membrane HSP70 and HSPs genes in HepG2 cells[J].Chin J Immunol,2009,18(11):790-4.
[11]孙等军,方 琴,王季石,榄香烯对人肝癌细胞7402、宫颈癌细胞Hela的凋亡诱导作用及下调Bcl-2蛋白表达[J].复旦学报(医学科学版),2001,28(5):403 -5.
[11]Sun D J,Fang Q,Wang J S.Elemene induces apoptosis and regulates expression of Bcl-2 protein in human hepatic cancer 7402 cells and cervix cancer hela cells[J].J Fudan Univ(Med Sci),2001,28(5):403 -5.
[12]任双飞,左云飞.榄香烯对小鼠肝癌腹水瘤细胞系Hca-F25/CL-16A3的视网膜母细胞瘤抑癌蛋白及腺病毒E2启动子结合因子表达的影响[J].中华实验外科杂志,2002,19(2):112-4.
[12]Ren S F,Zuo Y F.Influence of elemene on expression of pRB and E2F-1 protein in ascites hepatoma cell line Hca-F25/CL-16A3[J].Chin J Exp Surg,2002,19(2):112 -4.
[13]郑 瑾,刘 强,任凯夕,等.β-榄香烯对肝癌细胞SK-hep-1的迁移和侵袭力的影响[J].现代肿瘤医学,2009,17(11):2054-8.
[13]Zhang J,Liu Q,Ren K X,et al.Migratory and invasive ability of hepatocellular carcinoma cell line SK-hep-1 effected by β-elemene[J].Mod Oncol,2009,17(11):2054 -8.
