续随子中千金二萜烷化合物抑制人妇科肿瘤细胞增殖活性的研究
2011-06-09王思明苏晓会张嫚丽史清文
王思明,王 溪,苏晓会,张嫚丽,董 玫,史清文
(河北医科大学1.药学院天然药物化学教研室、2.基础医学院法医学系,河北省法医学重点实验室,河北 石家庄 050017)
续随子(Euphorbia lathyris)系大戟科大戟属植物,广泛分布或栽培于欧洲、北非、中亚、东亚和南北美洲,中国引种栽培已久[1]。续随子在临床上主要用于治疗水肿、痰饮、积聚、涨满和血瘀闭经等症[2],现代药理研究表明[3-4]续随子中独特的千金二萜烷成分具有P-糖蛋白抑制剂和酪氨酸酶抑制剂等多种药理活性。本文首次以续随子中纯化的三种千金二萜烷化合物为研究对象,进行了体外抑制人妇科肿瘤细胞增殖活性实验,并探讨了千金二萜烷化合物结构与抑制肿瘤细胞增殖活性之间的构-效关系。
1 材料与方法
1.1受试物3种千金二萜烷化合物:Euphorbia Factor L1(化合物1)、Euphorbia Factor L2(化合物2)和Euphorbia Factor L3(化合物3)由史清文教授从大戟科大戟属植物续随子中分离得到,均为白色针晶,经核磁共振光谱和质谱确定结构(Fig 1),纯度99%。
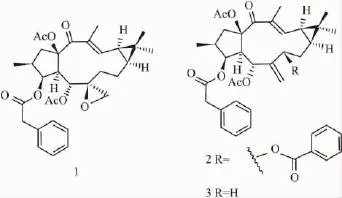
Fig 1 Chemical structures of lathyrane diterpenoids from Euphorbia lathyris
1.2药品和试剂噻唑蓝(MTT,Sigma,M-2128);RPMI 1640培养基、胰蛋白酶(Gibco);胎牛血清(杭州四季青生物工程材料有限公司);顺铂(Sigma,034k3693)。
1.3细胞系和培养条件子宫颈癌细胞 (HeLa)、子宫内膜癌细胞 (HEC-1)、人卵巢透明癌细胞(SHIN3和HOC-21)和人卵巢囊腺癌细胞(HAC-2)由日本千叶大学医学部第二生物化学实验室提供。各肿瘤细胞接种于直径为100 mm的培养皿中,加入含10%胎牛血清的RPMI 1640培养基,37℃和5%CO2培养箱中培养。
1.4方法参照文献[5]中的方法,将被试细胞悬浮接种于96孔板,每孔50 μl(含1×104个细胞),分别加入磷酸盐缓冲液(PBS)、溶剂对照(终浓度0.1%DMSO)、阳性对照顺铂和终浓度为100和1 μmol·L-1的化合物 1 ~3 各 50 μl,每组均设 3 复孔,置于饱和湿度、37℃和5%CO2培养箱中培养48 h。于培养结束前4 h,各培养孔加入5 g·L-1四氮唑盐 (MTT)10 μl,用酶联免疫检测仪测定各孔吸光度值(OD值),测定波长λ=570 nm,参考波长λ=630 nm,并计算细胞生存率,细胞生存率/%=(实验组OD值/对照组OD值)×100%。
1.5统计学处理数据用±s表示;两组间数据用t-检验,多组间数据用单因素方差分析。应用SAS612统计软件计算。
2 结果
2.1化合物1~3对体外培养的HeLa细胞增殖的抑制作用结果如Fig 2所示,阳性对照顺铂显示较强的抑制HeLa细胞增殖的活性,1、10和100 μmol·L-1顺铂处理 HeLa细胞后,肿瘤细胞生存率分别为80.87%、56.83%和33.72%;化合物1和3用相同的剂量处理HeLa细胞后,其肿瘤细胞生存率分别 为 92.41%、55.28%、24.96% 和 82.41%、41.06%、13.24%,并且与空白对照组相比较差异具有显著性,提示化合物1和3有较强的抑制HeLa细胞增殖的作用。通过肿瘤细胞生存率对被试化合物浓度的对数回归方程,得到顺铂、化合物1和3对HeLa细胞增殖抑制的半数有效浓度(EC50)分别为20.18、16.74 和 1.01 μmol·L-1。化合物 2 用 100 μmol·L-1剂量处理 HeLa细胞,细胞生存率为65.15% ,EC50大于 100 μmol·L-1。

Fig 2 Effect of three lathyrane diterpenoids on the proliferation of HeLa cells
2.2化合物1~3对子宫内膜癌、人卵巢透明癌和人卵巢囊腺癌细胞增殖的抑制作用结果如Tab 1所示,阳性对照顺铂对人卵巢囊腺癌细胞(HAC-2)的增殖显示中等程度的抑制活性,EC50为20.84 μmol·L-1,而对 HEC-1、SHIN3 和 HOC-21 细胞的增殖不显示任何抑制活性;化合物3除对HEC-1细胞的增殖不显示抑制活性外,对SHIN3、HOC-21和HAC-2细胞的增殖均显示抑制活性,其EC50分别为16.81、51.02 和 76.49 μmol·L-1;化合物 1 和 2 对4种人妇科肿瘤细胞的增殖不显示抑制活性,EC50均大于 100 μmol·L-1。

Tab 1 Effect of three lathyrane diterpenoids on the proliferation of HEC-1,SHIN3,HOC-21 and HAC-2 cells
3 讨论
癌症是威胁人类健康的一大凶手,严重地威胁人类的健康和生命,妇科肿瘤又是临床最常见的恶性肿瘤,手术和放疗是妇科肿瘤常用的治疗手段,疗效肯定,但是中、晚期患者的治疗效果迄今仍较差,5年生存率在50%左右。目前临床上应用的抗癌药物虽然种类不少,但价格昂贵,毒副作用严重,而且很多患者不能耐受,使其应用受限。因此寻找疗效确切,作用机制清楚,治愈率高,毒副作用小的抗癌药物,攻克癌症成为全世界医药工作者亟待解决的一大课题。
植物在其漫长的进化过程中合成了许多结构各异的次生代谢天然产物,这些次生代谢产物具有不同的生物活性,如丹参酮ⅡA可诱导人肺腺癌A549细胞凋亡,女贞子多糖可影响黑色素瘤细胞黏附能力等[6-7]。
续随子为大戟科大戟属植物,其含有的二萜、三萜、香豆素和挥发油等化学成分具有抗增殖、抗炎症和细胞毒性等多种重要的生理活性[8-9]。本实验选用的续随子中提取纯化的具有独特结构的3种千金二萜烷化合物 Euphorbia Factor L1(1)、Euphorbia Factor L2(2)和Euphorbia Factor L3(3)是生物体中合成多种二萜化合物的前体物[3],因此对这类化合物抑制肿瘤细胞增殖活性的探讨就显得尤为重要。本实验研究结果显示,Euphorbia Factor L3(3)对子宫颈癌细胞、卵巢透明癌和卵巢囊腺癌细胞增殖均有明显的抑制作用,而Euphorbia Factor L1(1)仅对子宫颈癌细胞的增殖显示较强的抑制活性,Euphor-bia Factor L2(2)对5种实验用人妇科肿瘤细胞的增殖均不显示任何抑制活性,试验结果推测千金二萜烷化合物抑制肿瘤细胞增殖活性与母核上的环外双键及邻位取代基有关,环外双键邻位有大的取代基时可以改变环外双键的空间取向,因而影响其生物活性[10-12]。
[1]中国科学院中国植物志编辑委员会.中国植物志[M],第7卷.北京:科学出版社,1979:44,69-71.
[1]Delectis florae republicae popularis sinicae agendae academiae sinicae.Flora Republicae Popularis Sinicae[M].Beijing:Science Press,1979:44,69-71.
[2]Liao S G,Zhang Z J,Yang S P.Lathyranoic acid A:first secolathyrane diterpenoid in nature fromEuphorbia lathyris[J].Org Lett,2005,7(7):1379 -82.
[3]Appendino G,Trom G C,Jarevang T,et al.Unnatural natural products from the transannular cyclization of lathyarae diterpenes[J].Org Lett,2001,7(11):1609 -12.
[4]Appendino G,porta C D,Conseil G,et al.A new p-glycoprotein inhibitor form the caper spurge(Euphorbia lathyris)[J].J Zat Prod,2003,66(1):140 -2.
[5]司徒镇强.细胞培养[M].北京:世界图书出版社,1996:134-8.
[5]Situ Z Q.Cell Culture[M].Beijing;World Book Publishing Company,1996:134-8.
[6]戴支凯,石京山,吴 芹,等.丹参酮ⅡA诱导人肺腺癌A549细胞凋亡[J].中国药理学通报,2010,26(11):1505-8.
[6]Dai Z K,Shi J S,Wu Q,et al.Apoptosis inducing effect of Tanshinone ⅡA on human lung adenocarcinoma A549 cells[J].Chin Pharmacol Bulle,2010,26(11):1505 -8.
[7]李 璘,邱蓉丽,程 革,等.女贞子多糖对黑色素瘤细胞黏附能力的影响[J].中国药理学通报,2009,25(10):1367-9.
[7]Li L,Qiu R L,Cheng G,et al.The adhesion effect of Ligustrum lucidum Ait polysaccharide on melanoma B16BL6in vitro[J].Chin Pharmacol Bulle,2009,25(10):1367-9.
[8]Fatope MO,Zeng L,Ohayaga J E,et al.Selectively cytotoxic diterpenes fromEuphorbia lathyris[J].J Med Chem,1996,39(4):1005-8.
[9]Lima E M,Medeiros J M,Davin L B.Pentacyclic triterpenes fromEuphorbiastygiana[J].Phytochemistry,2003,63(4):421 -5.
[10]Jassbi A R.Chemistry and biological activity of secondary metabolites in Euphorbia from Iran[J].Phytochemistry,2006,67(18):1977-84.
[11]Duarte N,Varga A,Cherepnev G,et al.Apoptosis induction and modulation of P-glycoprotein mediated multidrug resistance by new macrocyclic lathyrane - type diterpenoids[J].Bioorga Med Chem,2007,15(1):546 -54.
[12]Shi Q W,Su X H,Kiyota H.Chemical and pharmacological research of the plants in genus Euphorbia[J].Chem Rev,2008,108:4295-327.
