mTOR在记忆功能中的作用
2011-06-09随力,任杰
随 力,任 杰
(上海理工大学医疗器械与食品学院,上海 200093)
哺乳类动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是调控蛋白质翻译起始阶段的一种蛋白激酶。mTOR参与机体的一系列生理、病理过程,和衰老、肿瘤发生、表观遗传调控等都有着密切的联系[1-3],因此,mTOR 信号转导分子和相关的信号转导通路的作用引起了广泛关注。脑的学习和记忆功能中,特别是脑的长期记忆功能中,有蛋白质的翻译过程和新的蛋白质合成的参与[4],同时由于mTOR处于脑信号转导通路中的中间环节上,和脑内的许多信号转导分子有着密切的相互作用,这些又决定了mTOR作为一种蛋白激酶在脑记忆功能中起到了重要作用。本文阐述了近年来mTOR在脑记忆功能中的作用方面的研究进展。
1 mTOR的结构和组成
mTOR是分子量约250 ku(由2 549个氨基酸残基组成)的丝氨酸/苏氨酸蛋白激酶,分子结构相对复杂,内含数个各自独立且保守的结构域,类似于酵母的TOR结构[5-6]。其结构示意图如Fig 1所示。

Fig 1 Schematic of mTOR structure
mTOR分子的氨基端存在20多个串联重复序列(repeats),这些序列形成了一个大的螺旋型蛋白质的二级结构,这样的结构有利于介导mTOR蛋白家族之间的相互作用。mTOR分子的羧基端包含几种重要的蛋白结构域,其上游为FRB域(FKBPl2-rapamycin binding),为FKBPl2(FK506 binding protein 12,FK506结合蛋白 12)-雷帕霉素复合物与mTOR相互作用的区域,该区域发生突变后可以完全阻断雷帕霉素对mTOR的抑制作用。距离FRB域500个氨基酸残基处为FAT域(the focal adhesion targeting domain),其作用是与mTOR分子羧基末端的FATC域(the focal adhesion targeting domain of C-terminal)构成的空间结构共同决定了mTOR的催化功能。FATC域和NRD域(negative regulatory domain)位于mTOR分子的羧基末端,NRD域位于FATC和其他激酶催化域之间,是mTOR的负性调节域,NRD域中的苏氨酸2446位点、丝氨酸2448位点及丝氨酸2481位点的磷酸化水平都和整个mTOR的活性成正相关。
mTOR在体内功能的行使是以复合物的形式来完成的[7]。mTOR形成了两种不同的复合物,分别为mTOR复合物1(mTOR complex 1,mTORC1)和mTOR复合物2(mTOR complex 2,mTORC2)。mTORC1包含mTOR和Raptor(regulatory associated protein of mTOR),mTORC2包含 mTOR和Rictor(rapamycin-insensitive companion of mTOR)。Raptor分子结构保守,相对分子量为150 ku,mTOR分子的N端能紧密地和Raptor相结合,而C端与Raptor的结合相对较弱[8]。Raptor能和mTOR下游的效应蛋白,如S6K1(S6 kinase 1)和真核起始因子4E结合蛋白1(eukaryotic initiation factor 4E binding protein l,4E-BPl)相结合,
目前认为,Raptor是mTOR的一个调节蛋白,能够将mTOR的激酶域和底物连接起来,Raptor对于mTOR磷酸化并激活下游效应分子S6K1和4E-BPl是必需的。雷帕霉素能够破坏mTOR和Raptor之间的相互作用,使mTOR激酶的催化域失去接近并磷酸化下游靶蛋白的能力。mTOR-Raptor复合物在细胞中发挥着广泛而重要的作用,能够通过调节下游靶蛋白的活性,来影响包括蛋白质翻译、核糖体合成等一系列代谢过程。Rictor在真核生物中的保守性相对较低,其分子由1708个氨基酸残基组成,相对分子量为192 ku,mTOR-Rictor复合物的特点是对雷帕霉素不敏感[9]。体外实验研究表明,Rictor具有调节蛋白激酶 Cα(protein kinase Cα,PKCα)[10]和蛋白激酶 B(protein kinase B,PKB,又名Akt)的作用,而Akt又是mTOR-Raptor上游的效应分子,因此推断Raptor和Rictor之间可能通过Akt的沟通存在相互作用(crosstalk)。Rictor的发现晚于Raptor,其结构和功能的研究仍在进一步的深入进行中。
2 mTOR与脑信号转导通路
在中枢神经系统内,mTOR的功能受神经元膜上很多受体或通道的调控,如受到N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDA-R)、α-氨基羟甲基恶唑丙酸受体(α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptor,AMPA-R)、多巴胺能受体(Dopamine receptor,DR)及代谢性谷氨酸能受体(metabotropic glutamate receptor,mGluR)的影响。目前已经明确,mTOR处于上述受体和几种信号转导通路中,是磷酸肌醇依赖性蛋白激酶1(phosphoinositide dependent kinase 1,PDK1)、磷酸肌醇 3 激酶(phosphatidylinositol 3 kinase,P13K)、Akt和节性脑硬化综合症蛋白1和2(tuberous sclerosis complex proteins 1 and 2,TSC1/2)信号通路上的重要的分子[11-13]。简化后的mTOR在脑信号转导通路中的关系如Fig 2所示。
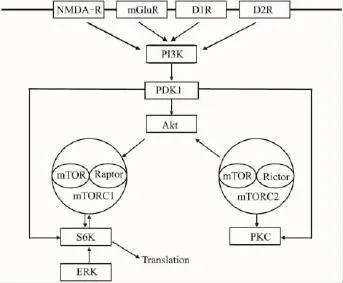
Fig 2 Schematic of mTOR signal transduction in the brain
神经元膜上的受体或通道,如NMDA-R、mGluR、多巴胺D1受体(D1R)和多巴胺D2受体(D2R)等可激活下游信号分子,进而激活mTOR-Raptor,目前尚不清楚神经系统内mTOR-Rictor是如何被激活的。mTOR-Raptor被激活后,在神经元的胞体和树突区调控和蛋白质翻译过程相关的一系列的效应分子,如S6K、4E-BP及真核延长因子2激酶(eukaryotic elongation factor-2 kinase,eEF2K)。研究发现,中枢神经系统内,mTOR-Raptor和mTOR-Rictor之间存在着相互作用(crosstalk)[14],mTOR-Rictor可直接(主要通过丝氨酸2448位点)或间接(主要通过Akt、PKC和S6K)调控mTORRaptor的活性,而mTOR-Raptor又可以通过S6K来磷酸化mTOR-Rictor。mTOR-Raptor和 mTOR-Rictor的协同作用共同调控神经系统内复杂的信号转导通路,在脑功能和脑疾病中起到了重要作用。
3 mTOR与脑的突触可塑性改变
脑的突触可塑性改变是脑记忆功能的神经生物学基础。在无脊椎动物中,如海兔(aplysia)中,长时程易化(long-term facilitation,LTF)是检测突触可塑性变化的指标;在脊椎动物中,常用长时程增强(long-term potentiation,LTP)和长时程抑制(long-term depression,LTD)来评价脑的突触可塑性改变。mTOR在脑突触可塑性和脑记忆功能中的作用多是通过mTOR的拮抗剂雷帕霉素而进行研究的,有试图通过敲除mTOR或mTOR复合体中的成分来研究mTOR在突触可塑性和脑记忆功能中的作用,但没有成功[15],究其原因,是因为mTOR在组织、细胞的发育及成长阶段起到了重要的作用,敲除了mTOR,动物存活的时间很短。
大量的通过雷帕霉素来研究mTOR和脑的突触可塑性改变之间关系的研究表明mTOR在脑突触可塑性改变中起到了重要作用。在无脊椎动物的海兔和龙虾上进行的研究表明:雷帕霉素能阻断LTF过程中eEF2的磷酸化[16]。脊椎动物上进行的研究同样表明mTOR在LTP和LTD中起到了重要作用。在脑的不同区域,如海马的CA1区[17]、齿状回(dentate gyrus,DG)区[18]、纹状体[19]等脑区的研究均表明mTOR参与了LTP维持阶段,对晚时相LTP是必不可少的。作者在脑前额叶皮层进行的研究表明[20],伴随着前额叶皮层LTP的诱导过程,mTOR的磷酸化水平升高了,并且mTOR的下游效应分子p70 S6K和4E-BP1的磷酸化水平也升高;在LTP诱导前施加mTOR的拮抗剂雷帕霉素,对前额叶皮层LTP的诱导没有影响,但抑制了LTP维持阶段LTP的幅度。所有这些研究都表明,mTOR,尤其是mTOR-Raptor,对晚时相LTP是必需的,其在突触可塑性中的作用是通过调控蛋白质的合成而进行的。LTP的诱导可以激活依赖于PI3K和胞外信号调节激酶(extracellular signal-regulated kinases,ERK)/促分裂素原活化蛋白激酶(mitogen-activated protein kinases,MAPK)[21-24]的 mTOR-Raptor,mTOR-Raptor既而激活mRNA 5'帽状结构中的核糖体蛋白和延长因子等,调控者蛋白质翻译起始阶段[25]。同时,mTOR-Raptor激活一系列在突触可塑性中起重要作用的蛋白质,如NMDA-R亚型NR1、钙/钙调素依赖性蛋白激酶Ⅱ α亚型(calcium/calmodulin-dependent protein kinaseⅡ α subunit,CamKⅡα)、突触后致密物蛋白质95(postsynaptic density-95,PSD95)和蛋白激酶 M zeta 亚型(protein kinase M zeta,PKM zeta)等[26-27]。
mTOR不仅在LTP中起到了重要作用,在LTD中也起到了重要作用。LTD作为突触可塑性的一种形式,和LTP一样,也依赖于蛋白质的合成。已有的研究表明mGluR1/5的激动剂DHPG(dihydroxyphenylglycine)可以诱导出LTD,在此过程中伴有mTOR-Raptor的激活和下游的S6K磷酸化水平的升高;阻断mTOR-Raptor上游的PI3K,降低了DHPG诱导的LTD的幅度[28]。至今尚不完全清楚为什么mTOR-Raptor的激活在NMDA-R激活状态下可诱导出LTP,而在mGluR激活条件下可诱导出LTD,这其中可能存在新合成蛋白质的特异性转运机制。
4 mTOR与脑记忆功能
脑短时记忆转变为长时记忆过程中需要新的蛋白质合成的参与,mTOR作为调控蛋白质翻译起始阶段的蛋白激酶,在脑长时记忆的形成中起到重要作用。mTOR的拮抗剂在几种记忆的行为学任务中能够干扰长时记忆的形成,依赖于海马的空间记忆[29]、依赖于杏仁体的线索条件恐惧(cued fear conditioning)记忆[30]、依赖前额叶皮层的痕迹性条件恐惧(trace fear conditioning)记忆[20]、依赖味觉皮层的味觉厌恶(taste aversion)[31]等不同的行为学任务中,雷帕霉素都损伤了长时记忆功能,对短时记忆没有影响。这些研究均是集中在mTOR-Raptor在脑记忆行为任务中的作用,至于mTORRictor在记忆行为任务中的作用,至今尚未见相关的研究报道。
抑制mTOR的活性可损伤长时记忆功能,那么,增强mTOR的活性是否能提高脑记忆功能呢?有研究表明增强mTOR-Raptor的功能能提高脑长时记忆功能[32],但是,mTOR-Raptor的过度升高不仅不能提高脑记忆功能,反而干扰了记忆功能,损害了记忆,此时应用小剂量的雷帕霉素反而可以逆转受损的记忆功能[33]。因此,目前认为 mTORRaptor的激活在脑长时记忆形成中是必须的,但失控的mTOR-Raptor的改变,无论是减低还是升高,对长时记忆都是有害的。
mTOR-Raptor不仅对正常脑的长时记忆功能的形成是必须的,而且在脑疾病状态下和脑记忆功能也有着密切的联系。在老年痴呆症(Alzheimer’s disease,AD)的转基因小鼠模型上,雷帕霉素可以提高AD所导致的记忆功能的损伤,但同等剂量的雷帕霉素对正常非转基因小鼠的记忆功能没有影响,没有干扰正常状态下长时记忆功能的形成[34]。同样,在泛自闭症(Autism spectrum disorders)[35]、帕金森病(Parkinson’s disease)[36]、亨廷顿舞蹈症(Huntington’s disease)[26]及正常脑衰老过程中,适量的雷帕霉素可以延缓这些疾病和衰老所导致的记忆功能的损伤或丧失,目前认为,雷帕霉素提高受损的脑记忆功能的机制在于雷帕霉素能阻断或减缓导致脑疾病和脑衰老过程中一些相关蛋白质的合成。
5 总结
在正常的神经元内,mTOR信号转导分子和信号转导通路对神经内、外的刺激作出神经反应,在特定的时间窗口内、特定的神经部位引起新的蛋白质的合成,在脑的突触可塑性改变和脑的长时记忆功能形成中起到了重要作用。人们在认识到mTOR,特别是mTOR-Raptor在长时记忆巩固中的重要作用的同时,也越来越认识到mTOR的活性和一些脑疾病、脑衰老密切相关。采用雷帕霉素或类似物来降低mTOR的活性对改善一些脑疾病、脑衰老所导致的脑认知功能,包括脑记忆功能的损伤都是有益的。mTOR拮抗剂作为脑疾病、脑衰老的潜在治疗药物及其相关的作用机制的研究现都处于深入、细致的研究中。对这些问题的研究有望能够全面揭示出mTOR在脑记忆功能中的作用,以及纠正mTOR的功能异常,以期在治疗脑疾病、脑衰老中发挥重要作用。
[1]张玲玲,魏 伟.BAFF/BAFF-R通过PI3K/Akt/mTOR信号转导通路调节B淋巴细胞功能在类风湿关节炎发病机制中的意义[J].中国药理学通报,2010,26(7):847-50.
[1]Zhang L L,Wei W.Implication of BAFF/BAFF-R regulating B lymphocyte function through the PI3K/Akt/mTOR signaling pathway in the pathogenesis of rheumatoid arthritis[J].Chin Pharma-col Bull,2010,26(7):847 -50.
[2]于春艳,李洪岩,钟加滕,等.维生素K3通过下调mTOR信号途径而诱导HeLa细胞自噬[J].中国药理学通报,2009,25(9):1173-6.
[2]Yu C Y,Li H Y,Zhong J T,et al.Vitamin K3induces autophagy in HeLa cells through downregulating the mammalian target of rapamycin(mTOR)pathway[J].Chin Pharmacol Bull,2009,25(9):1173-6.
[3]谢松强,李 骞,张亚宏,等.萘酰亚胺-多胺缀合物NNINspm通过PI3K/Akt信号通路诱导肝癌细胞凋亡[J].中国药理学通报,2010,26(2):169 -74.
[3]Xie S Q,Li Q,Zhang Y H,et al.NNINspm,naphthalimide-polyamine conjugate,induces hepatoma HepG2 cell apoptosis via PI3K/Akt pathways[J].Chin Pharmacol Bull,2010,26(2):169-74.
[4]Gkogkas C,Sonenberg N,Costa-Mattioli M.Translational control mechanisms in long-lasting synaptic plasticity and memory[J].J Biol Chem,2010,285(42):31913 -7.
[5]Hay N,Sonenberg N.Upstream and downstream of mTOR[J].Genes Dev,2004,18(16):1926 -45.
[6]De Virgilio C,Loewith R.The TOR signalling network from yeast to man[J].Int J Biochem Cell Biol,2006,38(9):1476 - 81.
[7]Bhagwat S V,Crew A P.Novel inhibitors of mTORC1 and mTORC2[J].Curr Opin Investig Drugs,2010,11(6):638 - 45.
[8]Yonezawa K,Tokunaga C,Oshiro N,et al.Raptor,a binding partner of target of rapamycin[J].Biochem Biophys Res Commun,2004,313(2):437 -41.
[9]Ali S M,Sabatini D M.Structure of S6 kinase 1 determines whether raptor-mTOR or rictor-mTOR phosphorylates its hydrophobic motif site[J].J Biol Chem,2005,280(20):19445 -8.
[10]李 礼,李 静,耿美玉.蛋白激酶C在肿瘤中的作用及其抑制剂研究进展[J].中国药理学通报,2009,25(6):708-11.
[10]Li L,Li J,Geng M Y.The role of protein kinase C in cancer and the progress of inhibitors targeting protein kinase C[J].Chin Pharmacol Bull,2009,25(6):708 - 11.
[11]Huang J,Manning B D.The TSC1-TSC2 complex:a molecular switchboard controlling cell growth[J].Biochem J,2008,412(2):179-90.
[12]Hwang M,Perez C A,Moretti L,et al.The mTOR signaling network:insights from its role during embryonic development[J].Curr Med Chem,2008,15(12):1192-208.
[13]Yang Q,Guan K L.Expanding mTOR signaling[J].Cell Res,2007,17(8):666 -81.
[14]Hoeffer C A,Klann E.mTOR signaling:at the crossroads of plasticity,memory and disease[J].Trends Neurosci,2010,33(2):67-75.
[15]Guertin D A,Stevens D M,Thoreen C C,et al.Ablation in mice of the mTORC components raptor,rictor,or mLST8 reveals that mTORC2 is required for signaling to Akt-FOXO and PKCalpha,but not S6K1[J].Dev Cell,2006,11(6):859 - 71.
[16]Carroll M,Warren O,Fan X,et al.5-HT stimulates eEF2 dephosphorylation in a rapamycin-sensitive manner in Aplysia neurites[J].J Neurochem,2004,90(6):1464 -76.
[17]Cammalleri M,Lütjens R,Berton F,et al.Time-restricted role for dendritic activation of the mTOR-p70S6K pathway in the induction of late-phase long-term potentiation in the CA1[J].Proc Natl Acad Sci USA,2003,100(24):14368 -73.
[18]Panja D,Dagyte G,Bidinosti M,et al.Novel translational control in Arc-dependent long term potentiation consolidationin vivo[J].J Biol Chem,2009,284(46):31498-511.
[19]Ghiglieri V,Pendolino V,Bagetta V,et al.mTOR inhibitor rapamycin suppresses striatal post-ischemic LTP[J].Exp Neurol,2010,226(2):328 -31.
[20]Sui L,Wang J,Li B M.Role of the phosphoinositide 3-kinase-Akt-mammalian target of the rapamycin signaling pathway in longterm potentiation and trace fear conditioning memory in rat medial prefrontal cortex[J].Learn Mem,2008,15(10):762 -76.
[21]张颜波,吕国蔚.丝裂原活化的蛋白激酶:一个治疗病理性痛潜在的药物新靶点[J].中国药理学通报,2009,25(7):848-51.
[21]Zhang Y B,Lü G W.Mitogen-activated proteins kinases:an emerging therapeutic target for pathological pain.[J].Chin Pharmacol Bull,2009,25(7):848 -51.
[22]王丽晖,段惠军,史永红,等.缬沙坦对高糖培养的肾小球系膜细胞p38MAPK传导通路的影响[J].中国药理学通报,2009,25(4):501-5.
[22]Wang L H,Duan H J,Shi Y H,et al.Effects of valsartan on expression of p38MAPK signal transduction pathway in glomerular mesangial cells under high concentration of glucose[J].Chin Pharmacol Bull,2009,25(4):501 - 5.
[23]石少婷,张正洋,李丙华,等.扇贝多肽在中波紫外线诱导的HaCaT细胞凋亡中对p38MAPK-HSP27通路的影响[J].中国药理学通报,2009,25(10):1318 -22.
[23]Shi S T,Zhang Z Y,Li B H,et al.Effects of polypeptide from Chlamys farreri on p38MAPK-HSP27 pathways in UVB-induced apoptosis of HaCaT cells[J].Chin Pharmacol Bull,2009,25(10):1318-22.
[24]覃肇源,刘慰华,黄河清.黄连素对高糖培养的大鼠肾小球系膜细胞FN及p38MAPK信号通路的影响[J].中国药理学通报,2009,25(9):1201 -5.
[24]Qin Z Y,Liu W H,Huang H Q.Effects of berberine on fibronectin and p38MAPK signal pathway in rat glomerular mesangial cells cultured under high glucose condition[J].Chin Pharmacol Bull,2009,25(9):1201 -5.
[25]Gobert D,Topolnik L,Azzi M,et al.Forskolin induction of late-LTP and up-regulation of 5'TOP mRNAs translation via mTOR,ERK,and PI3K in hippocampal pyramidal cells[J].J Neurochem,2008,106(3):1160-74.
[26]Garelick M G,Kennedy B K.TOR on the brain[J].Exp Gerontol,2010,16(in press):
[27]胡金凤,宁 娜,苑玉和,等.synapsinⅠ参与(-)黄皮酰胺增强齿状回突触传递功能[J].中国药理学通报,2009,25(5):580-4.
[27]Hu J F,Ning N,Yuan Y H,et al.Effect of(-)clausenamide on potentiating synaptic transmission in dentate gyrus:Role of synapsin Ⅰ[J].Chin Pharmacol Bull,2009,25(5):580 -4.
[28]Yang P C,Yang C H,Huang C C,et al.Phosphatidylinositol 3-kinase activation is required for stress protocol-induced modification of hippocampal synaptic plasticity[J].J Biol Chem,2008,283(5):2631-43.
[29]Horwood J M,Dufour F,Laroche S,et al.Signalling mechanisms mediated by the phosphoinositide 3-kinase/Akt cascade in synaptic plasticity and memory in the rat[J].Eur J Neurosci,2006,23(12):3375-84.
[30]Parsons R G,Gafford G M,Helmstetter F J.Translational control via the mammalian target of rapamycin pathway is critical for the formation and stability of long-term fear memory in amygdala neurons[J].J Neurosci,2006,26(50):12977 - 83.
[31]Belelovsky K,Kaphzan H,Elkobi A,et al.Biphasic activation of the mTOR pathway in the gustatory cortex is correlated with and necessary for taste learning[J].J Neurosci,2009,29(23):7424-31.
[32]Dash P K,Orsi S A,Moore A N.Spatial memory formation and memory-enhancing effect of glucose involves activation of the tuberous sclerosis complex-Mammalian target of rapamycin pathway[J].J Neurosci,2006,26(31):8048 -56.
[33]Ehninger D,de Vries P J,Silva A J.From mTOR to cognition:molecular and cellular mechanisms of cognitive impairments in tuberous sclerosis[J].J Intellect Disabil Res,2009,53(10):838 -51.
[34]Caccamo A,Majumder S,Richardson A,et al.Molecular interplay between mammalian target of rapamycin(mTOR),amyloidbeta,and Tau:effects on cognitive impairments[J].J Biol Chem,2010,285(17):13107 -20.
[35]Neves-Pereira M,Müller B,Massie D,et al.Deregulation of EIF4E:a novel mechanism for autism[J].J Med Genet,2009,46(11):759-65.
[36]Deguil J,Chavant F,Lafay-Chebassier C,et al.Neuroprotective effect of PACAP on translational control alteration and cognitive decline in MPTP Parkinsonian mice[J].Neurotox Res,2010,17(2):142-55.
