猪胸膜肺炎放线杆菌16S rDNA基因的克隆及序列分析
2011-06-08王喜军
沈 萍,王喜军
(1.湖南生物机电职业技术学院动科系,湖南 长沙 410127;2.长沙市动物防疫监督站,湖南 长沙 410012)
猪胸膜肺炎放线杆菌(APP)为革兰氏阴性杆菌,可引起猪传染性胸膜肺炎(porcine contagious pleuropneumoniae,PCP),该病由 Pattison 首次报道,现已在美国、墨西哥、瑞士、丹麦、澳大利亚、加拿大、泰国、韩国、日本等国家广泛流行[1-2];该病在我国也早已广泛存在,并有扩大蔓延之势。APP血清型较多,我国猪场中存在的就有 3、5、7、8、10 型,其中以3型和7型为最多[3]。发病时,病猪出现心衰和循环障碍,精神委顿,食欲废绝;晚期出现严重的体温下降和呼吸困难;临死前从嘴、鼻孔流出血性泡沫样液体。病猪于发病后24~36 h内死亡,死亡率高达80%~100%[4]。
16S rRNA为原核生物的一种核糖体RNA,在漫长的生物进化过程中,因其受到的选择压力小,基因序列变化缓慢,可以用来标记生物的亲缘关系和进化距离;在结构与功能上具有极为高度的保守性,素有“细菌化石”之称[5]。鉴于APP有很多血清型,且各血清型之间缺乏相互的交叉保护性,很大程度就是因为其不同血清型的外膜蛋白基因、功能基因存在一定差异,因此,选择APP的16S rDNA基因设计引物,对在湖南分离到的长沙(CS)株的16S rDNA基因进行了克隆和测序;并与已报道的血清3、5、7型做序列比对,进行同源性分析。为APP分子流行病学调查、亲缘性关系的研究提供资料,同时为APP的监控奠定基础。
1 试验部分
1.1 材料
1.1.1 病料来源 存于湖南生物机电职业技术学院动科系动物微生物实验室的猪胸膜肺炎放线杆菌病料。
1.2.1 引物设计 根据GenBank登录的APP的16S rDNA基因序列,利用生物软件Primer 5.0,设计1对特异性引物,扩增片段长度为827 bp,由南京金思特生物科技有限公司合成,合成后稀释为终浓度20 pmol/L,置-20℃保存。
1.2 方 法
初代接种后24 h后加有V因子的副嗜血杆菌疫苗培养基上可观察到呈圆形、中间有一灰白点、边缘整齐、表面稍隆起、从针尖大小至直径3 mm似露珠样的菌落。显微镜下,细菌呈典型的革兰氏阴性小球杆菌形态,有荚膜,呈长丝状,有的成双,有的成团。
使用DNAStar分析软件中的MegAlign程序,运用Clustal V算法对所测序列与参考序列进行比较并绘制和分析遗传进化树,同源性分析表明,分离得到的 4 株 CS1、CS2、CS3、CS4 株同源性为100%,笔者将得到4株共称为CS株,与国外学者得到的血清3、5、7型同源性为99.4%~99.6%,与丹麦株同源性为100%;与李氏放线杆菌、脲放线杆菌、马驹放线杆菌、荚膜放线杆菌同源性分别为97.8%、96.3%、97.3%、96.3%(见表1)。
1.1.2 主要试剂 蛋白酶K、Ex Taq酶、10×Mg2+、10×Buffer、dNTP、DL-2000 DNA Marker、琼脂糖、E.B(宝生物工程(大连)有限公司);普通琼脂糖凝胶DNA回收试剂盒、TIANgel Midi Purification Kit(天根公司);X-Gal、pGEM-T easy载体(Promega公司);工程菌JM109为本实验室保存;副嗜血杆菌疫苗培养基(长沙佳和生物技术有限公司)。
分离得到的4个湖南CS株均能扩增得到了约842 bp的目的DNA条带(见图1),与预期结果相符。
将扩增的目的基因纯化与克隆T载体连接,构建重组质粒pMD-T16S rDNA,转化于工程菌JM109中,取1 μL菌液作扩增模板进行PCR鉴定,均能得到约842 bp的片段(见图2)。说明目的基因已克隆到载体中。
2 试验结果
2.1 菌落及细菌形态
1.2.2 细菌的培养 采集病猪的气管、肺脏的病变组织,用生理盐水浸泡后涂布于加有V因子的副嗜血杆菌疫苗培养基,37℃烛缸法培养24 h,观察菌落形态,并取单个菌落革兰氏染色镜检观察后保存。
2.2 分离株的PCR鉴定
1.2.4 pMD18-T载体克隆与序列测定 将纯化产物按常规方法连接到pGEM-T中,转化于工程菌JM109中,取50 μL转化菌液均匀涂布于含氨节青霉素的LB平板,37℃培养16 h。培养后挑选白色的单菌落,对菌落进行PCR鉴定,阳性的克隆由南京金思瑞生物有限公司测序。应用DNAStar分析软件对测定的App 16S rRNA基因序列进行分析和同源性分析,序列比较参考株毒株名(登录号)为:AF033059、CP000569、CP000687、CP001091、M350-17、M75067、M75072、M75075。
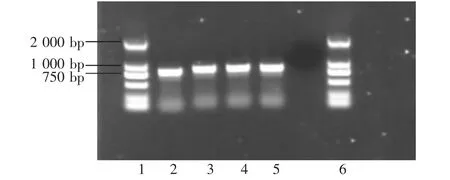
图1 16S rRNA基因的扩增
2.3 重组质粒菌落的PCR鉴定
F:5-GGAGCTTGCTTTCTTTGCCGACG-3;R:5-TAACCTTGCGGCCGTACTCCC-3。
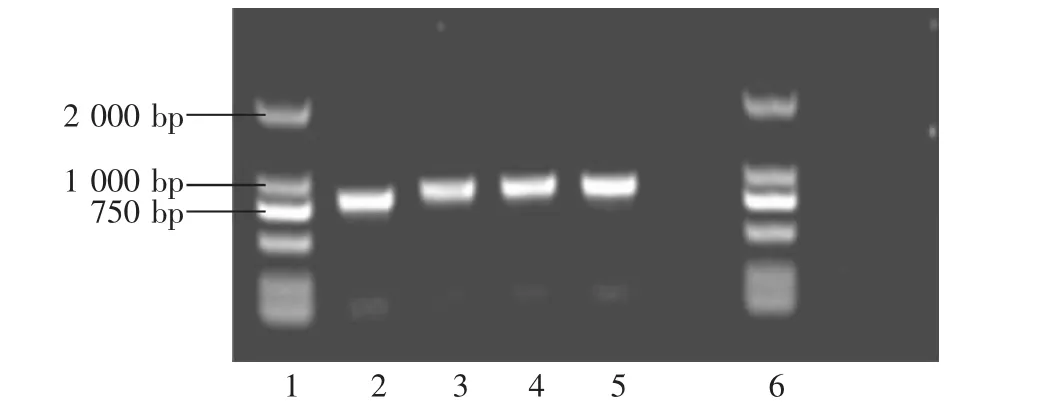
图2 阳性重组质粒的PCR鉴定
2.4 测序结果分析
依据所建立的放线杆菌系统发育树(见图3),除去外群,CS株与丹麦株(AF033059)的遗传距离最近,而且与血清3、5、7型处于一个相近的分支上。
2.5 系统进化树分析
“我把所有人都喝趴下,就为和你说句悄悄话”,“我们总是发现以前的自己有点傻”,“低质量的社交,不如高质量的独处”……这些印在江小白瓶身上的江小白语录正是当下80后、90后内心真实的情感和态度表达,借小白哥之口说出,既使品牌形象立体化,也成功地走近消费者,获得其感情认同并引发口碑传播。
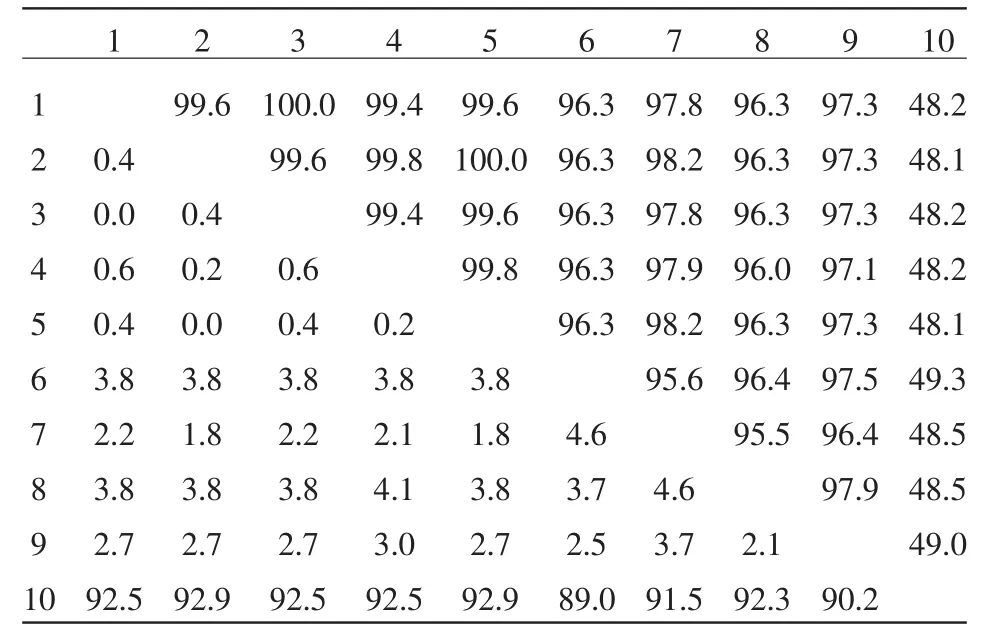
表1 核昔酸序列同源性分析

图3 系统发育树放线的基础上的16S rRNA基因核苷酸序列
3 讨论
猪传染性胸膜肺炎是侵害猪呼吸道的主要传染病之一,对养猪业危害极其巨大。该病是一种急性或慢性呼吸道疾病,以肺部纤维素性、坏死性和出血性肺炎为特征,具有高度的传染性,各种年龄的猪对该病都为易感。国内外对其4种毒素因子ApxI[6],ApxII[7],ApxIII[8]和 ApxIV[9]研究较多,主要集中于其抗原活性的研究;而本研究选取了APP的16S rDNA基因为研究对象,填补了国内APP基因分析的一个空白,因为单纯按照细菌的形态和生化指标等特征,已经难以区分比如猪胸膜肺炎放线杆菌、李氏放线杆菌、脲放线杆菌、马驹放线杆菌、荚膜放线杆菌这样的亲缘关系相近的菌株,不能保证分类的准确性和科学性。
目前,16S rDNA已被作为一个分子指标,广泛地应用于各种细菌的系统进化分析和分子差异的研究。这是因为16S rDNA普遍存在于一切细菌内,生理功能稳定,非常保守,具有良好的时钟性质,可用它比较在进化中的相互关系[10];而且大量已知细菌的16S rDNA序列都被测定并上传至Gen-Bank,使细菌鉴定和分类拥有了非常有用的参照系统。人类对自然界存在的微生物多样性的认识还远远不够,在今后相当长的时间内以16S rDNA基因为基础的群落结构研究方法仍然是揭示和明确环境微生物群落结构的主要手段。本研究获得的猪胸膜肺炎放线杆菌CS株与李氏放线杆菌、脲放线杆菌、马驹放线杆菌、荚膜放线杆菌同源性分别为97.8%、96.3%、97.3%、96.3%,都高于95%,与16S rDNA序列的相似性已成为划分属的标准,属内同源性应不低于95%这是一致的[11]。
朱小宁等[12-14]曾应用16S rDNA基因分离鉴定了副猪嗜血杆菌获得成功。本研究应用16S rDNA作为放线杆菌的一个分子指标,结果提示分离得到的A.pleuropneumoniae CS株与国内早期报道的存在A.pleuropneumoniae血清3、5、7型处于一个相近但不同的分支,提示国内存在除血清3、5、7型外的A.pleuropneumoniae病原存在。研究结果为进一步开展分子流行病学调查及相关疾病的研究提供了依据。
[1] Bosse J T,Janson H,Sheehan B J,et al.Actinobacillus pleuropneumoniae:pathobiology and pathogenesis of infection[J].Microbes Infect,2002,4(2):225-35.
[2] 徐公义,王海丽,葛长城,等.鲁西地区猪胸膜肺炎放线杆菌流行病学调查[J].安徽农业科学,2009,37(13):6002-6004.
[3] Bhatia B,Mittal K R,Frey J.Factors involved in immunity against Actinobacillus pleuropneumoniae in mice[J].Vet Microbiol,1991,29(2):147-58.
[4] Enwick W,Osbum B.Immune responses to lipopoly saccharides and capsular polysaccharides of Haemophilus pleuropneumoniaein convalescent and immunized pigs[J].Ame Soc Microb,2006,54(2):577-582.
[5] Harmsen D,Karch H.16S rDNA for diagnosing pat hogens:aliving tree[J].A SM News,2004,70:19-24.
[6] Ramjeet M,Cox A D,Hancock M A,et al.Mutation in the LPS outer core biosynthesis gene,galU,affects LPS interaction with the RTX toxins ApxI and ApxII and cytolytic activity of Actinobacillus pleuropneumoniae serotype 1[J].Mol Microbiol,2008,70(1):221-235.
[7] Shin S J,Bae J L,Cho Y W,et al.Induction of antigen-specific immune responses by oral vaccination with Saccharomyces cerevisiae expressing Actinobacillus pleuropneumoniae ApxIIA[J].FEMS Immunol Med Microbiol,2005,43(2):155-64.
[8] Vanden B P G,Zecchinon L L,Fett T,et al.Porcine CD18 mediates Actinobacillus pleuropneumoniae ApxIII species-specific toxicity[J].Vet Res,2009,40(4):33.
[9] Wang C,Wang Y,Shao M.Positive role for rApxIVN in the immune protection of pigs against infection by Actinobacillus pleuropneumoniae[J].Vaccine,2009,27(42):5816-21.
[10] Barry T,Colleran G,Glennon M,et al.The 16s/23s ribosomal spacer region as a target for DNA probes to identify eubacteria[J].Applicat,1991,1(1):51-56.
[11] Rappe M S,Giovannoni S J.The uncultured microbial majority[J].Annu Rev Micmbiol,2003,57:369-394.
[12] 朱小宁,余兴龙,李润成.副猪嗜血杆菌的分离与鉴定及其16S rRNA生物信息学分析 [J].湖南农业大学学报:自然科学版,2009,35(5):517-520.
[13] 刘俊伟,张慧辉,余 燕,等.猪瘟继发副猪嗜血杆菌病的诊断与防治[J].湖南农业科学,2010,(11):128-130,133.
[14] 万世平,王 建,葛菲菲,等.副猪嗜血杆菌上海株的分离鉴定及耐药特性的研究[J].广东农业科学,2010,37(8):201-203.
