活性污泥系统对环境pH值变化的响应
2011-06-08彭赵旭彭永臻于振波刘旭亮柴同志
彭赵旭,彭永臻,2,于振波,刘旭亮,柴同志
(1.哈尔滨工业大学城市水资源与水环境国家重点实验室,哈尔滨 150090;2.北京工业大学 环境与能源学院,北京 100022)
目前我国污水处理厂普遍采用活性污泥法,其结构简单,运行高效.该工艺的核心部分是活性污泥,它是由多种原(后)生动物种群组成的复杂微生态系统[1].活性污泥中的微生物利用污水中污染物作为底物进行新陈代谢,从而实现净化污水的目的.作为一个生物系统,它的运行稳定性会受到各种环境因子的直接影响(温度、溶解氧、pH值等).本文选择pH值作为研究对象,考察了活性污泥系统对环境pH值变化的响应,意在为污水处理厂应付pH值变化提供理论指导.
1 材料与方法
1.1 试验用水来源和水质
为便于控制反应条件,试验进水采用模拟城市生活污水的人工配水,具体配制方案详见表1,每升水中加 0.3mL 营养液[2].

表1 试验模拟废水成份及元素组成
1.2 试验装置和方法
SBR反应器由有机玻璃制成,高为700 mm,直径为200 mm,总有效容积为12 L.每周期进水体积3L,充水比为0.25,在反应器壁的垂直方向设置一排间隔为10 cm的取样口,用于取样和排水.底部设有放空管,用于放空和排泥(图1所示).以曝气砂头作为微孔曝气器,由转子流量计调节曝气量.每周期由以下5部分组成:瞬时进水,缺氧搅拌(0.5 h),好氧曝气(2 h),静止沉淀(1 h),滗水排放和闲置待机.每周期曝气末段排放100mL泥水混合液,以维持混合液悬浮固体质量浓度(MLSS)在1600~2200mg/L,污泥龄(SRT)控制在 12.5 d,水力停留时间(HRT)控制在10 h.温度由温控棒控制在(22±0.5)℃,事先配置好浓度均为1 mol/L的HCl和NaOH溶液,用于对系统进行pH值调节.
1.3 检测分析项目
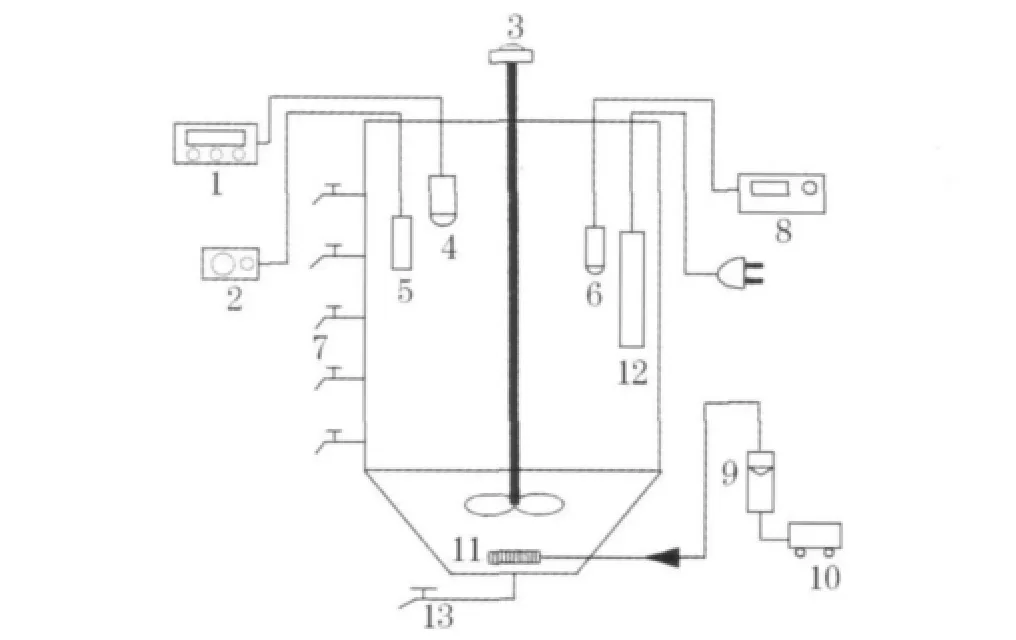
图1 试验装置
1.4 技术路线
试验污泥取自本实验室中试AAO反应器,具有良好的脱氮除磷能力,污泥容积指数 (SVI)在270mL/g左右,平均分配到4个SBR反应器内.试验共分两个阶段,第一阶段调节4个SBR反应器进水的 pH 值分别为 6、7、8、9,按照 1.2 节中制定的方式各运行60个周期;第二阶段将第一阶段的实验污泥重新混合后再平均分配,调节4个SBR反应器瞬时进水混合后的pH值分别为6、7、8、9,按照同样的方式各运行60个周期,考察不同试验阶段下各个SBR反应器的污水处理效果以及污泥沉降性的变化.
2 结果与讨论
2.1 活性污泥系统对pH值冲击的调节
在两个试验阶段中,好氧阶段的曝气量都稳定控制在28 L/h,各个反应器中典型周期的pH值和DO变化曲线如图2所示.从图2(A)中可见,虽然4个SBR的进水pH值分别为6、7、8、9,但是经过进水后的稀释作用,差异有所减小.pH值和DO曲线的变化与每周期的生化反应进程密切相关.缺氧段初期进行反硝化反应生成碱度,pH值升高,之后放磷,pH值降低.好氧段初期曝气吹脱CO2,pH值升高,之后硝化过程消耗碱度,pH值降低.硝化结束后由于CO2吹脱仍在进行,pH值出现反弹[4-7].有趣的是,经过一周期的生化反应后,各个SBR中的pH值有趋于一致的现象(均维持在7.7~8.0).在试验的第2阶段,进水完全混合后调节各SBR中初始 pH 值分别为6、7、8、9,这样虽然 pH值差异进一步加大,但是pH值仍然显现出统一的趋势.在每周期末段,各个SBR中pH值维持在7.5~8.0.由此可见,活性污泥系统对环境pH值的变化具有很好的调节作用,使其向着适合自己生长的pH值范围发展.分析其原因主要有以下2点:1)很多生化反应可以直接改变混合液中的碱度.如硝化过程消耗碱度,当pH值过低时,硝化活动受到抑制,这有效地防止了pH值的进一步降低;2)混合液中存在着许多离子的电离平衡.当溶液pH值过高时,CO2更容易以的形式存在于溶液中,从而降低了其吹脱强度,缓和了溶液pH值的升高.
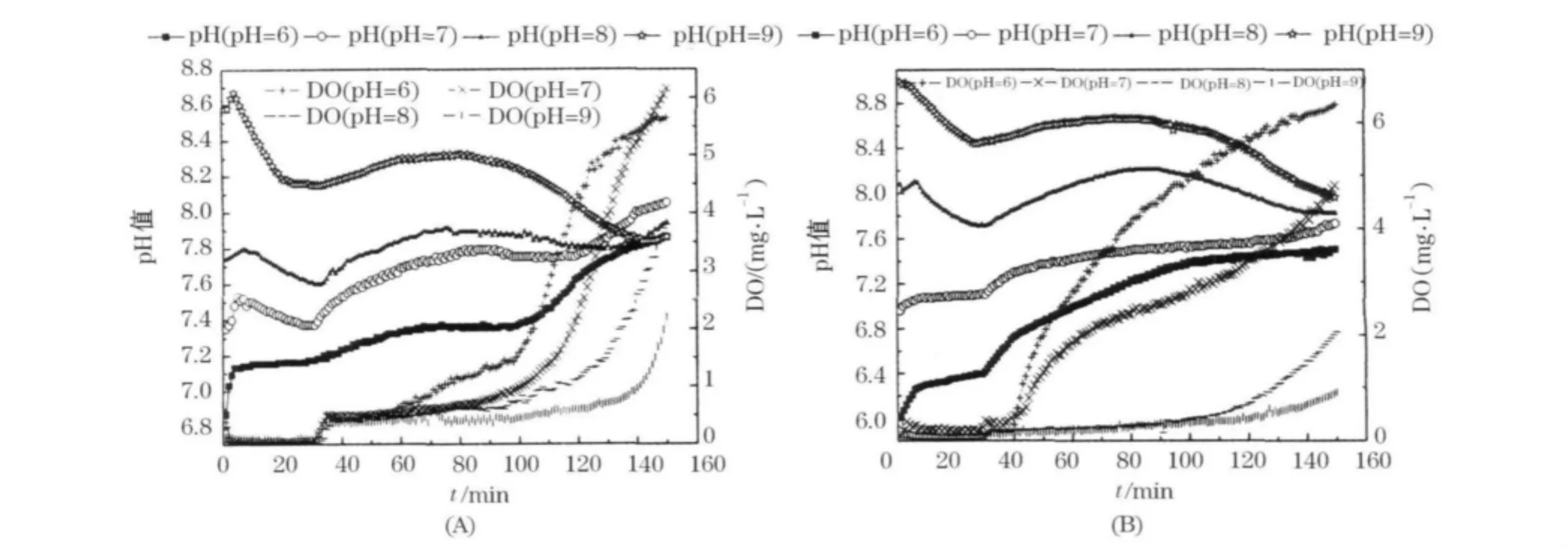
图2 典型周期内pH值和DO的变化(A)第1试验阶段;(B)第2试验阶段
好氧阶段所有反应器的曝气量都为28 L/h,但是DO质量浓度却差别很大(图2所示).总体来说,pH值的高低与好氧阶段的平均DO质量浓度大小成反比.其主要原因是硝化过程消耗溶解氧,而低pH值环境不利于硝化反应的进行,导致耗氧量减少.随着水中—N质量浓度降低,DO质量浓度缓慢升高.当硝化过程接近尾声时,DO质量浓度出现突越.在试验的第一阶段,DO突越点随着pH值的升高而逐渐延后.这是因为尽管低pH值不利于硝化反应的进行,但是较高的平均DO质量浓度弥补了这个不利因素.但是在试验的第2阶段,当pH值过低时,高DO质量浓度对硝化过程的促进不再有效,硝化过程受到严重抑制,甚至在好氧阶段pH值曲线一直上升(图2(B)所示).由此可见,当pH值在一定范围内时(7.2~8.2),DO质量浓度对硝化速率起主要作用.当pH值过低时(<7.0),硝化过程受到严重抑制,增加DO质量浓度对硝化速率影响不大.
2.2 pH值对除磷过程的影响
生物除磷分为厌氧放磷和好氧(缺氧)吸磷2个阶段.一般认为,在生物除磷过程中,聚磷菌只有在厌氧段进行充分地放磷,才能保证在后续好氧段实现充分地吸磷[8],本试验就从这两方面来考查环境pH值对除磷过程的影响.试验第1阶段,除了原水pH值为6的反应器外,其余反应器厌氧末—P量都在28~32mg/L,而在好氧末的出水中,所有反应器的—P量都在0.5mg/L以下(图3(A)所示).这主要是由于系统对外界pH值变化具有调节能力,事实上,在第1试验阶段各反应器每周期平均 pH 值分别为 7.39、7.68、7.80、8.19,差别并不明显.在第2试验阶段,各反应器每周期平均 pH 值差异变大,分别为 7.02、7.41、7.99、8.51(图 3(B)所示).Zhang等[9]研究发现,较高的pH有助于聚磷菌的生长和活性的增加,这与本试验结果相符.Filipe等[10]研究表明,由于较高的pH值会增加乙酸进入聚磷菌过程中的耗能量,因此厌氧段吸收单位乙酸的放磷量随着pH值的增加而增加.本试验发现当pH值在7~8的范围内,放磷量和吸磷量都随着pH值的升高而升高,但是当pH值进一步升高时,变化不再明显.这可能是在碱性pH值环境下产生了磷酸盐沉淀,减少了混合液中的—P量所致.
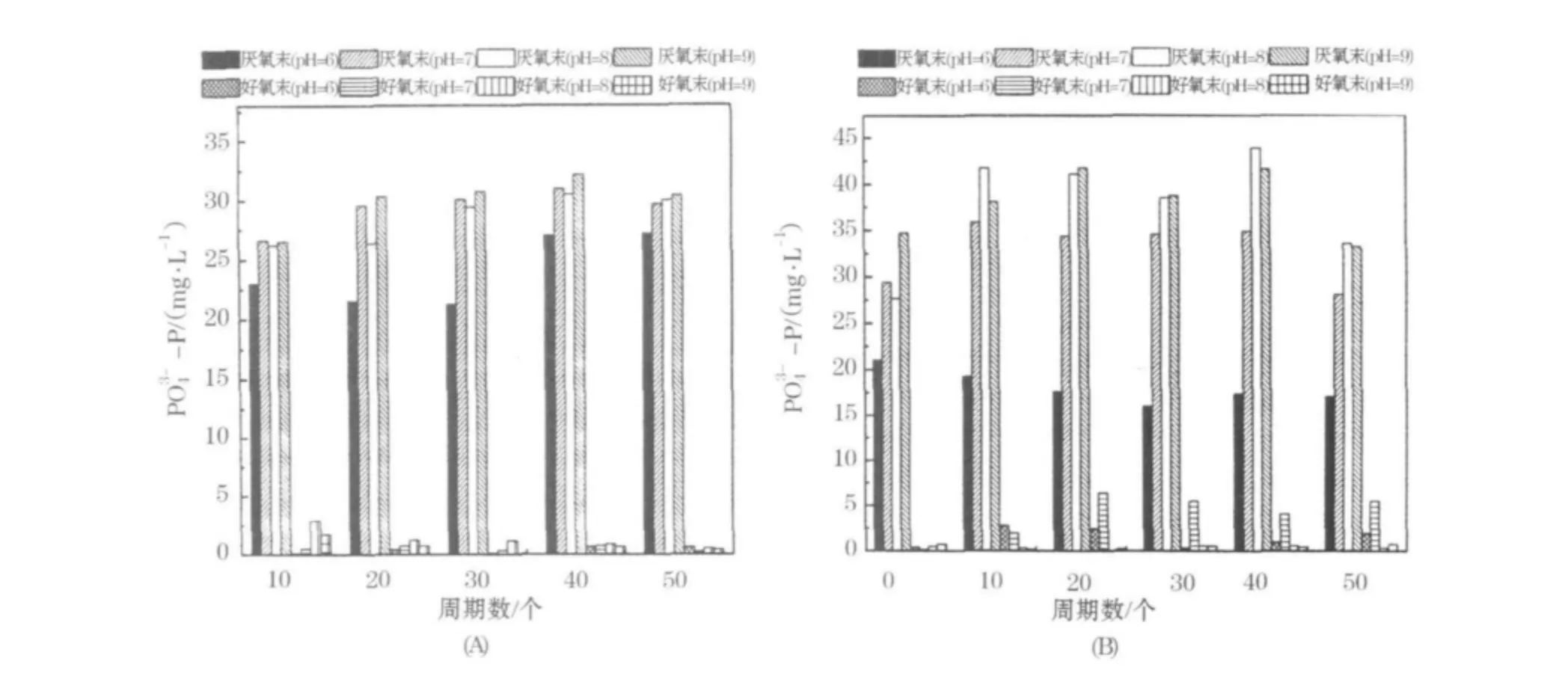
图3 试验期间除磷表现的变化(A)第1试验阶段;(B)第2试验阶段
2.3 pH值对活性污泥沉降性的影响
pH值作为一个重要的环境因子,对活性污泥系统的稳定性起着至关重要的影响.Rob[11]等研究指出,可以通过检测单位污泥中的总平均丝状菌长度、污泥容积指数和最大比耗氧速率三个指标来定量考察活性污泥系统的稳定性.其中前两个指标都和污泥沉降性直接相关,可见污泥沉降性对活性污泥系统的稳定性有着非常重要的影响.考虑到检测操作的方便性,本试验主要考察污泥容积指数(SVI)的变化,从而分析pH值对活性污泥沉降性的影响.从图4可见,初始SVI都在270mL/g,虽然污泥沉降性在运行初期出现过短期的波动,但是随着实验的进行,都逐渐趋于稳定,并没有哪个反应器出现极度恶化或者改善的趋势.如前面分析可见,由于系统对于外界pH值的酸碱冲击具有很好的缓冲调节作用,每周期中活性污泥暴露在极端酸性条件或碱性条件下的时间并不长(图2所示).实际上,在两个试验阶段中,系统的平均pH值分别为7.39、7.68、7.80、8.19 和7.02、7.41、7.99、8.51.丁峰等[12]研究发现,在中性略偏碱条件下,pH值对丝状菌与絮状菌之间的竞争关系影响不大,这与本试验的结论相似.在试验进行过程中,每10天对活性污泥微生物相进行一次镜检观察,结果发现丝状菌指数(FI)一直维持在1左右[13],丝状菌在活性污泥絮体中的比例没有发生明显的改变,这可能是造成本试验各反应器SVI相似的主要原因.

图4 试验期间污泥沉降性和污泥质量浓度的变化(A)第1试验阶段;(B)第2试验阶段
另外,pH值对活性污泥微生物的生长代谢也有重要影响,不同的微生物种群适合生长的pH值条件不同.污泥生长速率是个简单明了的衡量指标,本试验初始mLSS相同,随着试验的进行,MLSS逐渐发生变化,MLSS平均值的大小对应着污泥生长速率的快慢.第一试验阶段各反应器的平均mLSS 分别是1953、1945、1889、1995mg/L,而第2实验阶段的平均MLSS分别是1834、1972、2048、2145mg/L(图4所示).由此可见,碱性环境更有助于活性污泥生长.Chen等[14]研究发现,pH值过高时,聚磷菌吸收挥发酸(VFA)会消耗更多的能量,造成污泥产率降低,这与本试验结论矛盾.进一步分析发现,酸性条件下沉淀后的上清液比较浑浊,悬浮固体(SS)质量浓度高,每周期排水过程中排掉了大量活性污泥,造成MLSS偏小,而碱性条件下沉后上清液则十分清澈.这可能是造成两者差异的主要原因.
3 结论
考察了pH值对活性污泥系统污水处理效果以及污泥沉降性的影响,得到以下主要结论.
1)硝化、反硝化、放磷等许多生化反应过程都直接参与碱度的消耗或产生,再加上水溶液中普遍存在离子的电离平衡,使活性污泥系统对环境pH值的变化具有很好的调节作用,使其向着适合自己生长的pH值范围发展.
2)当pH值在7.2~8.2时,升高DO质量浓度对加快硝化速率效果显著.当pH值 <7.0时,硝化过程受到严重抑制,此时增加DO质量浓度难以再有效地提高硝化速率.
3)当pH值在7~8时,活性污泥放磷量和吸磷量都随着pH值的升高而升高,但是当pH值进一步升高时,变化不再明显.
4)当进水pH值在6~9变化时,活性污泥沉降性差异不大.不同的是酸性条件下污泥沉后上清液较浑浊,而碱性条件下的污泥沉后上清液十分清澈.
[1]李艳娜,周 青.丝状菌污泥膨胀的生态学解析[J].中国生态农业学报,2008,16(3):794-798.
[2]TSUNEDA S,OHNO T,SOEJIMA K,et al.Simultaneous nitrogen and phosphorus removal using denitrifying phosphate-accumulating organisms in a sequencing batch reactor[J].Biochemical Engineering Journal,2006,27(3):191-196.
[3]国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[4]BLACKBURNE R,YUAN Z G,KELLER J.Demonstration of nitrogen removal via nitrite in a sequencing reactor treating domesticwastewater[J].Water Research,2008,42(8-9):2166-2176.
[5]YANG Q,PENG Y Z,LIU X H,et al.Nitrogen Removal via Nitrite from Municipal Wastewater at low Temperatures using Real- Time Control to Optimize Nitrifying Communities[J].Environmental Science and Technology,2007,41(23):8150 ~8164.
[6]LEE Y,OLESZKIEWICZ J A.Effects of predation and ORP conditions on the performance of nitrifiers in activated sludge systems[J].Water Research,2003,37(17):4202-4210.
[7]MARSILI-LIBELLI S.Control of SBR switching by fuzzy pattern recognition[J].Water Research,2006,40(5):1095-1107.
[8]WANG L M,FILIPE C D M,PARK J K.Model-based evaluation of competition between polyphosphate-and glycogen- accumulating organisms[J].Water Research,2007,41(6):1312-1324.
[9]ZHANG C,CHEN Y,LIU Y.Effect of pH on enzyme activity involved in enhanced biological phosphorus removal system[J].Abstracts/Journal of Biotechnology,2008(9):647-677.
[10]FILIPE C,DAIGGER G,JR C.Stoichiometry and kinetics of acetate uptake under anaerobic conditions by an enriched culture of phosphorus- accumulating organisms at different pHs[J].Biotechnology and bioengineering,2001,76(1):32-43.
[11]ROB M R,VAN D B,JAN F M,et al.Assessment of activated sludge stability in lab-scale experiments[J].Journal of Biotechnology,2009,141(3-4):147-154.
[12]丁 峰,彭永臻,支霞辉,等.SBR法处理工业废水中pH值对污泥膨胀的影响[J].环境工程,2004,22(1):29-32.
[13]CHENY G,GU G W.Effect of changes of pH on the anaerobic/aerobic transformations of biological phosphorus removal in wastewater fed with a mixture of propionic and acetic acids[J].Journal of Chemical Technology and Biotechnology,2006,81(6):1021-1028.
