“白芍-当归”药对中主要成分的肠动力学及影响
2011-06-08丁振铎李文兰
丁振铎,田 明,杨 洋,李文兰
(1.黑龙江中医药大学,哈尔滨 150040;2.黑龙江生态工程职业学院,哈尔滨 1500253.哈尔滨商业大学生命科学与环境科学研究中心,哈尔滨 150076)
随着科学技术的发展,药物分析学的研究范围不断扩大,已经从对药物单一、静态的分析发展到对制药过程、药物在生物体内的处置过程的综合评价和动态分析研究.因此,为明确“白芍-当归”药对的肠吸收动力学特征.本实验采用在体循环灌流法分别考察了“白芍-当归”药对中活性成分芍药苷、阿魏酸[1-2]的吸收动力学、吸收量、吸收速率常数、吸收半衰期等参数,为中药新药设计开发提供理论基础和方法,以期提高中药制剂的质量,促进中药现代化的发展.
1 仪器、药品、试剂和动物
仪器:Waters HPLC(W2695泵、W2996DAD检测器、自动进样器、Empower化学工作站);HL-2型恒流泵(上海嘉鹏科技有限公司);水浴锅(上海一恒仪器有限公司);751型紫外分析仪(上海光谱仪器有限公司);pH酸度计(北京赛多利斯仪器系统有限公司);电子天平(美国奥好斯科技有限公司).药品与试剂:芍药苷、阿魏酸对照品(中国药品生物制品检定所,批号:110736-200320、0773-9910);所有药材白芍(Paeonia lactiflora Pall)、当归(Angelica sinensis(Oliv.)Diels)均经鉴定符合中国药典2005版规定的质量标准要求;水合氯醛;酚红;双蒸水;KB缓冲液(NaCl 6.87 g/L、KCl 0.4 g/L、NaHCO32.2 g/L、NaH2PO40.13 g/L、MgSO40.122 g/L、CaCl20.25 g/L、葡萄糖 5 g/L);甲醇(色谱纯),醋酸(分析纯).动物:雄性Wistar大鼠(225±20)g购自长春国家生物产业基地实验动物中心,批号SCXK-(吉)2008-0009.
2 方法与结果
2.1 试液的配制
空白循环液:精密称酚红50.0mg置于250mL量瓶中,以KB缓冲液定容配成0.2mg/mL空白循环液.
药对样品溶液:取白芍、当归各50 g,粉碎至80目.以10倍量的甲醇75℃水浴回流提取3次,每次1 h,过滤,合并滤液,减压回收至无醇味,回收液呈浸膏状即为药对样品.取不同量的药对样品,以空白循环液充分溶解,3000 r/min离心15min,取上清液并定容于100mL容量瓶中,配制成含芍药苷、阿魏酸不同质量浓度的药对样品溶液.
混合标准品溶液:分别精密称取芍药苷9.57mg,阿魏酸2.64mg用 KB缓冲液定容于25mL容量瓶中,配制成含芍药苷质量浓度为0.957mg/mL,阿魏酸质量浓度为0.1056mg/mL的混合标准品溶液.
2.2 循环液中酚红质量浓度的测定
2.2.1 酚红检测波长的选择
分别取上述3种溶液适量,在200~600 nm波长范围内扫描.结果表明:酚红在558 nm波长处呈现最大吸收,而在此波长条件下,芍药苷、阿魏酸、药对样品无吸收.因此,确定该波长为酚红的检测波长[3].
2.2.2 酚红标准曲线绘制
精密称酚红20.0mg置于100mL量瓶中,以KB缓冲液定容配成0.2mg/mL酚红标准储备液,分别移取 5.0、10.0、15.0、20.0、25.0mL 于 100mL量瓶中,以KB缓冲液定容配成0.01、0.02、0.03、0.04、0.05mg/mL的酚红标准溶液.各取上述酚红标准溶液 0.5mL,加入 0.2 mol/LNaOH溶液5.0mL摇匀,用UV法在558 nm处测定吸光度,以吸光度对质量浓度进行线性回归,求得酚红标准曲线方程:Y=15.19X+0.0193,r=0.9975(n=5).表明酚红在0.010~0.050mg/mL质量浓度范围内线性关系良好.
2.3 循环液中药物质量浓度测定
2.3.1 色谱条件的建立
色谱柱:Waters C18(4.6 mm ×250 mm,5 μm);流动相:甲醇-0.1%醋酸水溶液(76∶24);流速:1.0mL/min;柱温:37℃;分别提取检测波长237、320 nm的色谱图.取混合标准品溶液、药对样品溶液和空白循环液适量,分别过0.45 μm微孔滤膜,进样 10μL,见图 1.
由图1可见,空白循环液对芍药苷、阿魏酸吸收无干扰,其色谱峰峰形良好,保留时间分别为9.25min和14.26min.因此,确定以该条件测定循环液中芍药苷、阿魏酸的含量.
2.3.2 芍药苷、阿魏酸标准曲线绘制
以适量的KB缓冲液将混合标准品溶液(芍药苷质量浓度为0.957mg/mL,阿魏酸质量浓度为0.1056mg/mL)分别稀释成含芍药苷 38.28、76.56、153.12、306.24、612.48μg/mL,含阿魏酸2.07、4.13、8.26、16.51、33.02、66.05μg/mL 的溶液.将上述各质量浓度溶液过0.45 μm微孔滤膜,分别进样10μL,提取波长237nm色谱图,以峰面积对质量浓度进行线性回归,求得芍药苷标准曲线方程为:Y=11567.00X-108123.80,(r=0.9998,n=3).提取波长320 nm色谱图,以峰面积对质量浓度进行线性回归,阿魏酸标准曲线方程为:Y=28930.75X-20500.49,(r=0.9999,n=3)表明芍药苷在38.28~612.48μg/mL,阿魏酸在2.07~66.05μg/mL范围内线性关系良好.
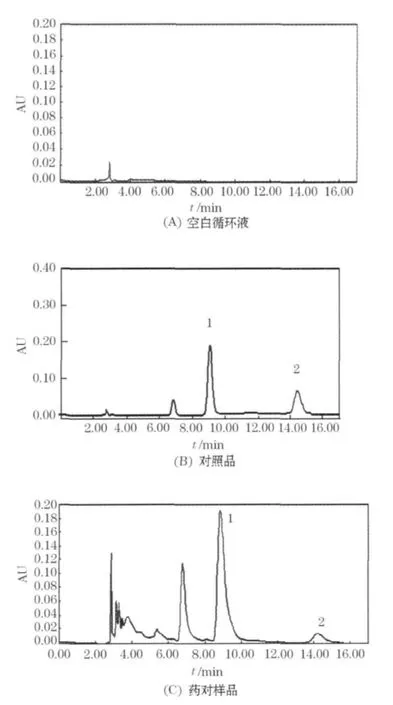
图1 HPLC图
2.4 方法学考察
2.4.1 芍药苷、阿魏酸与酚红溶液的稳定性试验
分别取混合标准品溶液和空白循环液适量,置(37 ± 0.5)℃ 恒温水浴中保温 2.5 h,于 0.5、1、1.5、2、2.5 h分别取样,另取混合标准品2.5 h样品放于0~4℃冰箱中保存24 h,分别对芍药苷、阿魏酸进行HPLC测定,对空白循环液中的酚红进行UV测定,代入各自的标准曲线方程计算质量浓度.测得芍药苷、阿魏酸及酚红的 RSD分别为0.77%、1.29%和1.24%,结果表明在各自时间范围内各溶液稳定性良好.
2.4.2 回收率与精密度试验
分别制成高、中、低3个质量浓度的芍药苷、阿魏酸与酚红供试品溶液,于1 d内重复测定5次,计算日内精密度 RSD分别为0.74%、0.38%、0.80%(n=3);每日测定1次,连续测定3 d,计算日间精密度 RSD分别为1.93%、1.10%、0.49%(n=3).在上述溶液中加入不同量芍药苷、阿魏酸与酚红对照品,使其达到样品中各物质含量的120%、100%、80%,计算平均回收率分别为98.7%、98.4%、97.7%(n=3).
2.5 肠吸收动力学实验方法
将大鼠禁食过夜(自由饮水),用10%水合氯醛腹腔注射麻醉(0.3mL/100 g)[4-5],固定,置加热器上随时调温以保持体温.沿腹腔中线打开腹腔,结扎胆总管,并分离出所需胃肠段,于切口处插管(出液口插管约3 cm),结扎.首先用适量的生理盐水将胃、小肠内容物冲洗干净,然后用预热的37℃的KB缓冲液以5mL/min的速度恒定流速平衡10min,排净空气,将伤口用浸有生理盐水的脱脂棉覆盖保湿,于红外灯下保持大鼠体温.药对样品溶液50mL保持(37±5)℃恒温,以5mL/min循环 10min后,记为 0时,后药对样品液以1mL/min的流速循环 180min.分别于 20、40、60、80、100、120min时于供试品小瓶中取2mL供试液样品,用微孔滤膜过滤后,取滤液1mL进样,测定各时间点芍药苷、阿魏酸的量;另外取0.5mL滤液测定酚红的量.同时补加2mL酚红溶液.最后将大鼠处死,取剪下被灌流肠段,测量肠内径及长度[6-8].
数据处理:1)由剩余药量可求得药物吸收量;2)以剩余药量的对数值对取样时间作线性回归,由斜率求得吸收速率常数Ka(h-1);3)由Ka可求得t1/2(h)=0.693/Ka;4)由2h剩余药量的变化值对零时间剩余药量比可求出药物的累积吸收百分率A(%).
2.5.1 肠壁物理吸附的排除
剪取清洗后的大鼠肠段约10 cm,用玻璃棒将黏膜层翻出,置50mL的药对样品液中,于(37±0.5)℃孵育3 h,取出肠段,测定孵育液中的芍药苷、阿魏酸质量浓度,得质量浓度百分比分别为原药物质量浓度的(98.14±1.34)%(n=5)、(98.07±1.31)%(n=5),可认为大鼠肠壁对药物基本无物理吸附.
2.5.2 小肠灌流液对芍药苷、阿魏酸化学降解的排除
将大鼠做全肠道插管,用空白循环液50mL循环灌流2 h后,用灌流液配制3份质量浓度相同的药对样品液,置(37±0.5)℃孵育3 h,测定孵育前后药物质量浓度,分别计算孵育后剩余百分比为(98.14±1.77)%(n=5),(99.18±0.90)%(n=5),表明芍药苷、阿魏酸在循环液中无化学降解.
2.5.3 质量浓度对芍药苷、阿魏酸吸收的影响
由于肠道平均pH值为7.4,故选择循环液pH值为7.4的生理条件下,采用整肠段循环灌流法考察不同质量浓度“白芍-当归”药对样品液(含芍药苷 的 质 量 浓 度 分 别 为 0.08、0.16、0.32、0.64mg/mL;阿魏酸的质量浓度分别为0.003、0.006、0.011、0.023mg/mL)的吸收情况.数据见表1.
表1 不同质量浓度芍药苷、阿魏酸吸收量、吸收速率常数、半衰期及累积吸收百分率(n=5 )
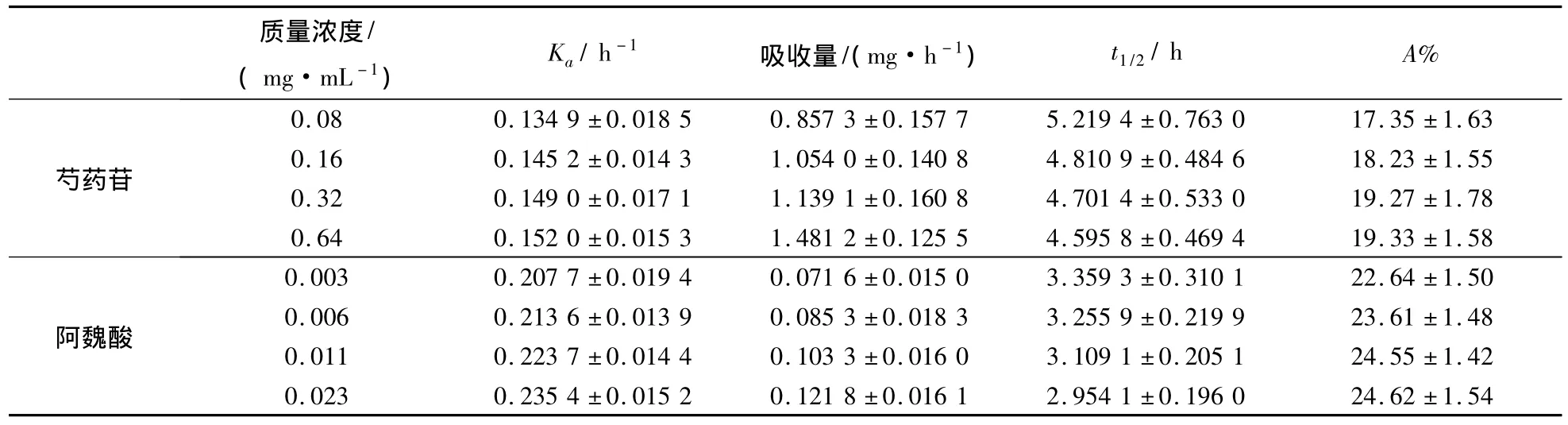
表1 不同质量浓度芍药苷、阿魏酸吸收量、吸收速率常数、半衰期及累积吸收百分率(n=5 )
质量浓度/(mg·mL-1)Ka/h-1 吸收量/(mg·h-1) t1/2/h A%0.08 0.1349 ±0.0185 0.8573 ±0.1577 5.2194 ±0.芍药苷7630 17.35 ±1.630.16 0.1452 ±0.0143 1.0540 ±0.1408 4.8109 ±0.4846 18.23 ±1.550.32 0.1490 ±0.0171 1.1391 ±0.1608 4.7014 ±0.5330 19.27 ±1.780.64 0.1520 ±0.0153 1.4812 ±0.1255 4.5958 ±0.4694 19.33 ±1.580.003 0.2077 ±0.0194 0.0716 ±0.0150 3.3593 ±0阿魏酸.3101 22.64 ±1.500.006 0.2136 ±0.0139 0.0853 ±0.0183 3.2559 ±0.2199 23.61 ±1.480.011 0.2237 ±0.0144 0.1033 ±0.0160 3.1091 ±0.2051 24.55 ±1.420.023 0.2354 ±0.0152 0.1218 ±0.0161 2.9541 ±0.1960 24.62 ±1.54
经线性回归统计,芍药苷、阿魏酸的吸收量对质量浓度的回归方程分别为:Y=1.0338X+0.8228,r=0.9830;Y=2.3996X+0.0697,r=0.9676,表明芍药苷、阿魏酸分别在0.08~0.64mg/mL和0.003~0.023mg/mL范围内,各质量浓度的吸收量与药物质量浓度呈良好线性关系.经方差分析,吸收速率常数(Ka)、累积吸收百分率(A%)和t1/2基本保持不变(P>0.05),符合一级动力学过程.提示芍药苷、阿魏酸的吸收过程均为被动扩散过程.
2.5.4 pH值对芍药苷、阿魏酸吸收的影响
肠道平均pH值为7.4,考虑到药物吸收可能受到循环液pH值的影响,故取含芍药苷、阿魏酸质量浓度分别为0.16、0.006mg/mL的药对样品液,采用整肠段循环灌流法,考察循环液在pH值6.4、7.4、8.4条件时,芍药苷、阿魏酸的吸收情况,探讨pH值对其吸收的影响.数据见表2.
表2 不同pH值条件下芍药苷、阿魏酸吸收量、吸收速率常数、t1/2及累积吸收百分率(n=5 )
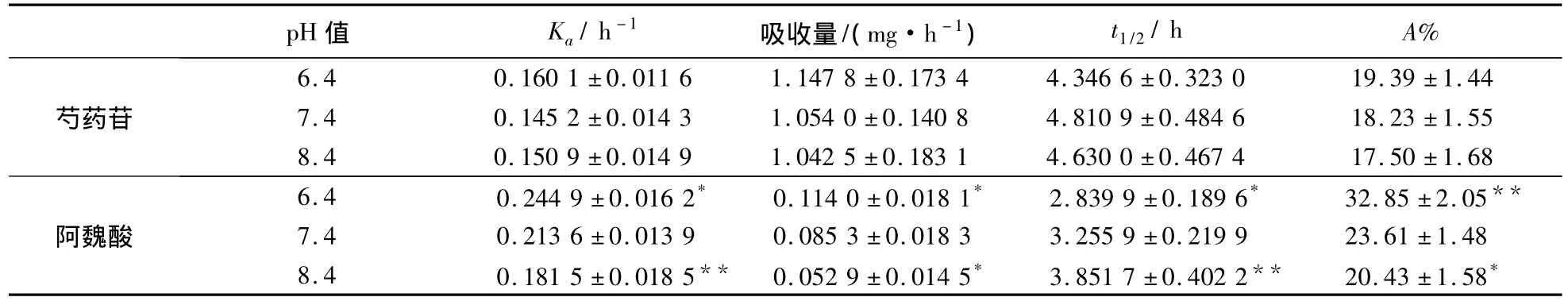
表2 不同pH值条件下芍药苷、阿魏酸吸收量、吸收速率常数、t1/2及累积吸收百分率(n=5 )
注:(阿魏酸)与pH=7.4比*P<0.05显著性差异,**P<0.01极显著性差异
经方差分析表明,循环液的pH值对芍药苷的小肠吸收在吸收量、吸收速率、累积吸收百分率及t1/2方面均无显著变化(P>0.05);阿魏酸在不同pH值条件下,随着pH值的增大,吸收量、吸收速率及累计吸收百分率减小,t1/2显著增大(P<0.5),表明阿魏酸在酸性条件下易于被吸收.
经方差分析表明:“白芍-当归”药对样品液在肠道循环灌流120min后,各个肠段循环液中芍药苷的吸收量、Ka、t1/2及A%值均无显著性差异(P>0.05),表明芍药苷在全肠段均有吸收.但胃循环液中阿魏酸的吸收量、Ka、t1/2及A%值均有显著性差异(P<0.01),表明阿魏酸在胃中更易被吸收.
3 讨论
通过在体肠循环灌流法对药对中芍药苷、阿魏酸的吸收动力学特征进行考察,结果显示,药对中芍药苷、阿魏酸的吸收量随质量浓度变化均呈现线性增长,但其各质量浓度吸收速率并无显著性变化,表明其在药对中的吸收符合一级动力学过程,推测其吸收过程为被动扩散,这也符合大多数药物的吸收特点;在环境pH值方面,芍药苷的吸收不受环境pH值影响,但由于阿魏酸属于酸类成分,因此,其吸收受环境pH值的影响,在酸性条件下更易于被吸收.
[1]高小荣,田庚元.白芍化学成分研究进展[J].中国新药杂志,2006,15(6):416-418.
[2]刘 涛,胡晋红,蔡 溱,等.阿魏酸钠对大鼠贮脂细胞株HSC-T6及胶原合成的影响[J].第二军医大学学报,2000,21(5):423.
[3]杜先华,牛 欣 ,冯前进,等.染料木素自微乳的大鼠在体肠吸收机制研究[J].中国中药杂志,2008,33(12):1406-1409.
[4]YU X Y,LIN S C,ZHOU Z W,et al.Role of P-Glycoprotein in the Intestinal Absorption of Tanshinone IIA,a Major Active Ingredient in the Root of Salvia miltiorrhiza Bunge[J].Current Drug Metabolism,2007(8):325-340.
[5]杜 秋,狄留庆,单进军,等.在体单向肠灌流模型研究瑞香素的大鼠肠吸收特性[J].药学学报,2009,44(8):992-926.
[6]赵艳红,贾晓斌,陈 彦,等.淫羊藿黄酮类化合物的大鼠在体肠吸收研究[J].中国药学杂志,2008,43(3):188-191.
[7]ZHOU P,LI L P,LUO S Q,et al.Intestinal absorption of luteolin from peanut hull extract is more efficient than that from individual pure luteolin[J].J Agric Food Chem.2008,56(1):296-300
[8]李文兰,南莉莉,季宇彬,等.人参中人参皂苷Rg1、Rb1在体肠吸收影响因素的研究[J].中国中药杂志,2009,34(20):2627-2632.
