血管紧张素转化酶Ⅱ对吉西他滨治疗胰腺癌细胞株敏感性的影响
2011-06-08张连峰李伟芳史成章
周 琳,张连峰,李伟芳,史成章
郑州大学第一附属医院消化科,河南郑州450052
由于早期诊断率低,多数胰腺癌在诊断时已处于中晚期,能够手术切除的病例不足10%[1]。近年来联合应用化学治疗和分子靶向药物治疗日益受到人们的关注。血管紧张素转化酶Ⅱ(ACE2)是近年来发现的肾素-血管紧张素系统(RAS)新成员。新近的一些研究证实ACE2的表达缺失可能与肿瘤的发生发展有关,而且初步证实ACE2可能是一个抑癌基因[2]。我们先前的研究发现胰腺癌组织中存在ACE2表达下调甚至缺失,且 ACE2可抑制胰腺癌细胞增殖,提示ACE2功能缺失参与了胰腺癌的发病过程[3]。本研究通过建立稳定高表达ACE2的胰腺癌细胞株,旨在探讨ACE2在体外对胰腺癌细胞化学治疗敏感性的影响,并初步探讨其可能的作用机制。
1 材料与方法
1.1 细胞和细胞培养 人胰腺癌细胞株SW1990购自中科院上海细胞生物研究所,培养于含10%胎牛血清的DMEM培养基(美国Gibco公司),在37℃、5%CO2饱和湿度条件下传代培养,每天换液以保证细胞浓度维持在(2~4)×105的最佳生长状态,台盼蓝检测细胞活力>90%,选用对数生长期细胞进行实验。吉西他滨(美国Lilly公司)溶解于无菌PBS中,制备为100 μmol/L储备溶液,4℃保存。
1.2 细胞转染 ACE2表达质粒(pReceiver-M02-ACE2)与空白对照质粒(pReceiver-M02-GFP)由课题组前期构建。按照Polifect转染试剂盒(美国Qiagen公司)说明书操作,具体方法:转染前一天将3×105细胞接种到6孔板中。转染时将ACE2质粒和对照质粒DNA 各 0.4 μg/孔和 10 μL Polifect转染试剂混合,加入500 μL/孔Optimen无血清培养液,孵育4 h,之后更换为完全培养液,细胞在37℃、5%CO2条件下培养。
1.3 建立稳定高表达ACE2基因细胞株 细胞转染24 h后换液,48 h后加入400 μg/mL G418的细胞培养液,筛选克隆;4周后,待稳定转染ACE2及空白对照质粒的SW1990细胞克隆形成后,挑取克隆(分别命名为SW1990/ACE2和SW1990/GFP),培养在含200 μg/mL G418的培养液中维持生长和传代。
1.4 Western印迹 细胞离心沉淀后加入裂解液(RIPA,上海申能博采),RC-DC法蛋白定量(美国Bio-Rad公司)。取30 μg蛋白进行SDS-PAGE电泳,转移至硝酸纤维膜(Bio-Rad公司),先后与特异性抗ACE2多克隆抗体(美国Santa Cruz公司)和抗β-actin单克隆抗体(美国Sigma公司)、辣根过氧化物酶连接的二抗(Santa Cruz公司)孵育,ECL(Amersham Biosciences公司)显影。
1.5 MTT法检测细胞增殖抑制率 使用CCK-8试剂盒(日本Dojindo公司),通过检测WST-8的剪切水平(OD450吸光值)观察ACE2对细胞增殖的影响,具体方法如下:取未转染组、阴性对照组及实验组的SW1990细胞进行检测。将5×103细胞接种于96孔板,每组细胞分别给予10、20、50 μmol/L浓度的吉西他滨干预24 h,每组设6个复孔,每孔加入100 μL培养液。细胞培养24 h后,每孔加入10 μL CCK-8试剂,继续孵育4 h,用酶标仪测定溶液在450 nm处的吸光度。增殖抑制率(%)=(1-处理孔A 450 nm/对照孔A 450 nm)×100%。
1.6 胰腺癌细胞的凋亡检测
1.6.1 细胞凋亡的TUNEL法检测:使用Roche公司的TUNEL试剂盒检测细胞凋亡。收集各组细胞,按5×103/孔接种于含小玻片的6孔板内,每组细胞分别给予50 μmol/L浓度的吉西他滨干预,每组设3复孔,孵育48 h,取出玻片,PBS轻洗后,按试剂盒说明书进行操作,DAB染色。凋亡细胞表现为细胞核绿色荧光。选择随机5个40×视野,凋亡率(%)=凋亡细胞数/总细胞数×100%。
1.6.2 流式细胞仪:每组细胞分别给予50 μmol/L浓度的吉西他滨处理48 h,收集细胞于1.5 mL离心管中,用加冰预冷的PBS洗2次,以少量PBS悬浮细胞,细胞浓度为1×106/mL。取100 μL细胞悬液加入5 μL膜联蛋白Ⅴ-异硫氰酸荧光素(AnnexinⅤ-FITC)、100 μg 碘化丙啶(PI,250 μg/mL,Sigma 公司)室温避光反应30 min,流式细胞仪检测细胞凋亡。
1.7 统计学处理 采用SPSS 13.0软件进行统计分析。多组间均数比较采用单因素方差分析(one-way ANOVA),多组间均值的两两比较采用SNK法。P<0.05为差异有统计学意义。
2 结果
2.1 ACE2在胰腺癌细胞中的表达 Western印迹结果显示,ACE2蛋白在SW1990和SW1990/GFP细胞中均有微弱表达,在SW1990/ACE2细胞中的表达水平明显强于阴性对照及未处理组(见图1)。取ACE2灰度/β-actin灰度比值得出ACE2相对表达强度,结果显示在蛋白水平,SW1990、SW1990/GFP和 SW1990/ACE2的 ACE2值分别为 0.231±0.041、0.216±0.033、0.865±0.162,SW1990/ACE2中 ACE2蛋白水平明显高于SW1990和SW1990/GFP(P<0.05)。上述结果证明稳定高表达ACE2的胰腺癌细胞株构建成功。
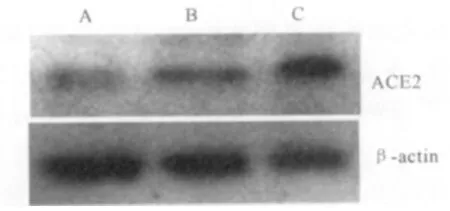
图1 不同处理组SW1990细胞中ACE2蛋白的表达 A:SW1990;B:SW1990/GFP;C:SW1990/ACE2Fig 1 Western blot analysis showing expression of ACE2 in SW1990 cells after they had been infected with an adenovirus containing
2.2 MTT法检测细胞增殖抑制率 不同浓度(10、20、50 μmol/L)吉西他滨干预3种细胞24 h,细胞增殖抑制率呈剂量依赖性增高。SW1990/ACE2分别为(19.6±2.7)%、(29.3±4.2)%和(51.2±4.8)%,SW1990/GFP分别为(11.1±1.3)%、(15.2±1.6)%和(24.2±3.3)%,SW1990细胞分别为(12.6±1.7)%、(17.7±1.4)%和(21.3±2.6)%。在各个浓度阶段,吉西他滨对SW1990/ACE2细胞抑制率均明显高于ACE2和ACE2/GFP细胞,差异有统计学意义(P<0.05)。SW1990和SW1990/GFP间细胞抑制率差异无统计学意义(P>0.05)。表明稳定过表达ACE2可增加胰腺癌细胞对吉西他滨的敏感性。
2.3 胰腺癌细胞凋亡检测
2.3.1 TUNEL法:吉西他滨(50 μmol/L)干预24 h后,SW1990/ACE2凋亡率达(17±2)%,明显高于SW1990(8±1)%和SW1990/GFP(11±3)%,差异有统计学意义(P<0.05)。统计分析表明转染ACE2表达质粒后,SW1990细胞的凋亡率升高(见图2)。
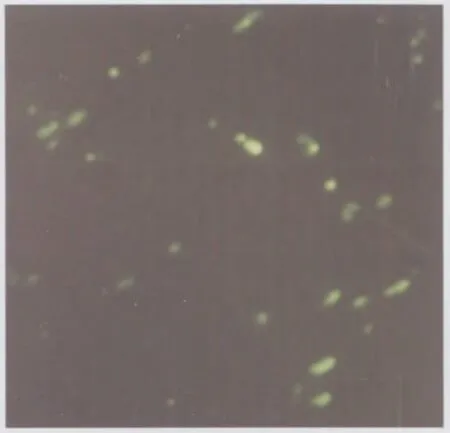
图2 TUNEL检测吉西他滨干预24 h后实验组细胞的凋亡,凋亡细胞核断端被原位特异标记(40×)Fig 2 Analysis of apoptosis using TUNEL in SW1990 pancreatic cancer cells stably expressed ACE2 after treatment with gemcitabin for 24 h.DNA fragmentation were detected by labeling the terminal end of nucleic acids(40×)
2.3.2 流式细胞仪双染法检测:吉西他滨(50 μmol/L)干预24 h后,SW1990/ACE2凋亡率达(31.2±3.8)%,与 SW1990和 SW1990/GFP比较[(17.6±2.3)%和(15.9±1.7)%]差异有统计学意义(P<0.05);SW1990和SW1990/GFP比较差异无统计学意义(P>0.05)。表明ACE2可增加吉西他滨诱导胰腺癌细胞的凋亡率。
3 讨论
尽管目前胰腺癌的治疗仍以手术为主,但由于切除率低下且预后不佳,以化学治疗为基础的综合治疗已成为中晚期胰腺癌治疗的最佳方案。吉西他滨是抗进展期胰腺癌化学治疗的一线药物,可作用于DNA合成期的肿瘤细胞,即S期细胞,在一定条件下阻止其从G1期向S期进展[4]。吉西他滨在细胞内转化成吉西他滨磷酸盐,后者可使DNA链合成停止,进而DNA断裂、细胞死亡,发挥抗癌作用。
ACE2作为肾素-血管紧张素系统(RAS)新成员,是目前发现的第一个,也是唯一一个 ACE的同工酶[5]。人类 ACE2的基因定位于 Xp22,基因全长39.98 kb,由18个外显子和20个内含子组成,蛋白分子量为92.5 KD。ACE2广泛分布于人体的各个组织,在心脏、肾脏、睾丸、胃肠道和肺脏等部位都有表达。ACE2通过水解AngⅠ羧基端脯氨酸与苯丙氨酸之间的肽键,生成Ang-(1-7),Ang-(1-7)通过其特异性Mas受体及与激肽系统的交互作用发挥其拮抗AngⅡ的作用。与ACE有所不同,ACE2具有舒张血管平滑肌的抗高血压作用。由于ACE2可削弱甚至拮抗AngⅡ促进细胞增殖的效应,近年来其在肿瘤细胞中的生物学效应日渐受到关注。Feng等将ACE2表达载体转染非小细胞肺癌细胞株A549,结果发现,ACE2可抑制血管内皮生长因子的表达(VEGF)及肺癌细胞的增殖[2]。我们已完成的研究发现:与癌旁正常胰腺组织标本的胰腺导管细胞相比,导管癌细胞中ACE2蛋白仅有微弱表达;进一步研究发现,通过小干扰RNA技术封闭胰腺癌细胞株中ACE2的表达后,胰腺癌细胞的增殖明显加强[3]。以上结果提示,ACE2在不同种类的癌细胞中均可抑制其异常增殖,胰腺癌中存在着因ACE2下调导致的功能缺失。
在吉西他滨作用下,SW1990/ACE2组细胞的生长抑制作用强于其他两组,且各组细胞对药物引起的生长抑制作用有明显的剂量依赖性。近年来的研究表明,多种抗肿瘤药物均可导致不同程度的细胞凋亡,细胞的增殖、分化、凋亡三者间的平衡失调与肿瘤的发生发展有关。国外的一些研究提示,吉西他滨可通过线粒体依赖的通路诱导肿瘤细胞凋亡[6]。在本实验中,我们通过TUNEL法和流式双染AnnexinⅤ/PI法检测到ACE2可诱导胰腺癌细胞的凋亡,且吉西他滨诱导SW1990/ACE2细胞凋亡的作用最强,提示稳定高表达ACE2的胰腺癌细胞对吉西他滨的敏感性增强,两者有联合作用。以上实验结果表明,ACE2和吉西他滨在体外联合作用于SW1990细胞,无论在抑制细胞的增殖方面,还是诱导凋亡方面,均有明显的协同作用。
综上所述,本研究显示ACE2可明显增强吉西他滨对胰腺癌细胞对化学治疗的敏感性,其机制涉及抑制细胞增殖、诱导细胞凋亡等多个方面,为基因和化学药物的联合治疗提供新的思路。ACE2有望成为胰腺癌治疗的靶点,值得进一步深入探讨。
[1]Sener SF,Fremgen A,Menck HR,et al.Pancreatic cancer:a report of treatment and survival trends for 100,313 patients diagnosed from 1985-1995,using the National Cancer Database[J].J Am Coll Surg,1999,189(1):1-7.
[2]Feng Y,Wan H,Liu J,et al.The angiotensin-converting enzyme 2 in tumor growth and tumor-associated angiogenesis in non-small cell lung cancer[J].Oncol Rep,2010,23(4):941-948.
[3]Zhou L,Zhang R,Yao W,et al.Decreased expression of angiotensinconverting enzyme 2 in pancreatic ductal adenocarcinoma is associated with tumor progression [J].Tohoku J Exp Med,2009,217(2):123-131.
[4]Campen CJ,Dragovich T,Baker AF.Management strategies in pancreatic cancer[J].Am J Health Syst Pharm,2011,68(7):573-584.
[5]Donoghue M,Hsieh F,Baronas E,et al.A novel angiotensin-converting enzyme-related carboxypeptidase(ACE2)converts angiotensin I toangiotensin1-9[J].Circ Res,2000,87(5):E1-E9.
[6]Schniewind B,Christgen M,Kurdow R,et al.Resistance of pancreatic cancer to gemcitabine treatment is dependent on mitochondria-mediated apoptosis[J].Int J Cancer,2004,109(2):182-188.
