隐孢子虫P23基因的原核表达及间接ELISA检测方法的建立
2011-06-08张国恩米荣升苏庆美胡义彬秦培兰呼高伟陈兆国
张国恩,米荣升,苏庆美,黄 燕,周 鹏,胡义彬,秦培兰,呼高伟,陈兆国
(中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室 中国农业科学院动物源性食品安全研究中心,上海 200241)
隐孢子虫病(cryptosporidiosis)是由食源性寄生原虫隐孢子虫(Cryptosporidium spp.)感染胃和肠粘膜上皮细胞引起的人兽共患寄生虫病,主要导致人和动物的自限性水样腹泻,还会引起患者慢性狭窄性小肠结肠炎(Crohn's disease)[1],对于免疫功能低下的病人特别是艾滋病(AIDS)患者会造成长期感染甚至会有生命危险。隐孢子虫之所以对人和动物造成重大危害,其原因主要有:常规消毒剂均无法完全灭活隐孢子虫卵囊;感染剂量低,一个卵囊就可能造成感染;对免疫功能低下的人和动物具有致死性;该病为人兽共患病,不仅影响人类健康,还对畜牧业的发展造成很大的危害[2]。隐孢子虫病日益受到国内外学者的重视,但至今尚无治疗或免疫预防隐孢子虫感染的有效方法[3]。目前主要通过加强管理和卫生措施、隔离患病动物,来减少疾病的传播。因此,对本病的准确诊断显得极其重要。
对隐孢子虫病的常规诊断技术是基于粪便镜检的病原学检测方法。该方法对实验条件要求简单,但检出率不高,很容易错检、漏检[4]。近年来出现的诸多分子生物学检测技术,如PCR、nested PCR、PCR-RFLP、RT-PCR和q-PCR,虽然敏感性很高、特异性也很强,但技术难度大,实验条件高,且费用较高,只能在科研单位和实验室条件下开展检测,难以在养殖现场推广应用[5-7]。隐孢子虫病的免疫学检测方法主要有血清酶联免疫吸附实验(ELISA)[8]、双抗夹心ELISA[9]和免疫荧光试验(IFT)[10]等,具有较高的特异性、敏感性和稳定性。其中ELISA法操作简便且易于掌握,适合在现场推广使用。但现有的ELISA方法中使用的抗原多为卵囊裂解物,而隐孢子虫体外培养还不成熟,无法获得大量的卵囊来满足实际的需要。
P23蛋白是隐孢子虫不同种、株间最保守的一个子孢子表面蛋白,由Perryman等[11]首先从微小隐孢子虫(Cryptosporidium parvum)子孢子cDNA文库中筛选获得,其大小为11.2 ku,主要在子孢子和裂殖子阶段参与抗体反应[12,13]。Ungar等[14]研究发现感染隐孢子虫的阳性血清92%都能识别此蛋白。本实验室在前期工作中,克隆了隐孢子虫鼠基因型(Cryptosporidium mouse genotype)、隐孢子虫猪基因型 II(Cryptosporidium pig genotype II)和兔隐孢子虫(C. cuniculus,原名Cryptosporidium rabbit genotype)P23基因,发现其具有较高的核苷酸和氨基酸同源性[15]。本研究对隐孢子虫鼠基因型P23基因进行了原核表达,利用纯化的表达产物构建了隐孢子虫病的间接ELISA诊断技术,并初步应用于现场分离血清的检测。
1 材料与方法
1.1 质粒与菌株 含隐孢子虫鼠因型P23基因的重组质粒pMD18-T-P23、表达载体pGEX-4T-1、大肠杆菌DH5α和BL21(DE3)均由本实验室保存。
1.2 主要试剂 TaKaRa LA-Taq、EcoR I、Xho I、T4 DNA 连 接 酶、DL2000TMDNA Ladder、 蛋白Marker均购自宝生物工程(大连)有限公司;DNA分子量标准Marker Ⅳ 购自天根生物(北京)有限公司;AxyPrep DNA 凝胶回收试剂盒购自Axygen公司;Jetquick离心柱质粒小抽试剂盒购自Invitrogen公司;胰蛋白胨、酵母提取物、脱脂奶粉购自英国OXOID公司;氨苄青霉素、溶菌酶购自生工生物工程(上海)有限公司;DAB、TMB购自Promega公司;IPTG购自上海浩然生物技术有限公司;过硫酸铵、丙烯酰胺、N,N'-亚甲双丙烯酰胺、TEMED、山羊抗兔IgG-HRP均购至Sigma公司;硝酸纤维素膜、FTA Classic Card DNA提取试剂盒购自Whatman公司;ELISA酶标板为Costar公司产品;其它试剂均为国产分析纯。
1.3 血清 隐孢子虫感染兔血清、隐孢子虫重组CP41蛋白(rCP41)免疫兔血清[16]、隐孢子虫重组CP15/60蛋白(rCP15/60)免疫兔血清[17]为本实验室制备与保存;隐孢子虫阴性血清来自SPF兔,经Sheather's蔗糖漂浮法镜检和nested PCR检测为阴性;伊氏锥虫(Trypanosoma evansi)感染兔血清、柔嫩艾美耳球虫(Eimeria tenella)可溶性全抗原免疫兔血清分别由上海兽医研究所寄生虫研究室周金林研究员、黄兵研究员馈赠;临床血清及相应粪便样品采自田间新西兰白兔。
1.4 重组表达质粒的构建与鉴定 用EcoRⅠ、XhoⅠ分别双酶切表达载体pGEX-4T-1和重组质粒pMD18-T-P23,回收酶切产物,连接并转化到大肠杆菌BL21(DE3)。提取质粒,用EcoRⅠ、XhoⅠ双酶切后经1%琼脂糖凝胶电泳鉴定正确后,送Invitrogen公司测序,序列正确的阳性重组质粒命名为pGEX-P23。
1.5 重组质粒的诱导表达与重组蛋白纯化 将pGEX-P23重组质粒转化菌培养至细菌对数生长期(OD600=0.6),加入终浓度为1 mmol/L 的IPTG诱导表达5 h,离心,收集菌体。加入1/10菌液体积的TNE缓冲液、1/100 TNE缓冲液体积的溶菌酶(现用现配)和1/10 TNE缓冲液体积的Triton X-100,液氮-室温反复冻融3次,冰浴超声20 min,4 ℃、10 600×g离心30 min,收集上清液并用0.45μm滤膜过滤除杂后,利用High-Affinity GST Resin亲合层析纯化重组P23蛋白(recombinant P23,rP23),进行SDS-PAGE分析纯度并用Epoch多体积分光光度计(BioTek,美国)测定蛋白浓度,于-70 ℃保存备用。
1.6 Western blot检测 按文献[18]介绍的方法,用Western blot技术对纯化rP23的免疫原性进行检测,一抗血清为隐孢子虫感染兔血清,二抗为HRP标记的山羊抗兔IgG,用DAB显色。
1.7 间接ELISA检测方法的建立
1.7.1 重组抗原最适包被浓度和血清最佳稀释度的确定 按文献[16, 19]介绍的方法,通过方阵实验确定抗原最适包被浓度和血清最佳稀释度。用0.05 mol/L碳酸钠-碳酸氢钠缓冲液(pH 9.6)将重组抗原依次稀释成8、4、2、1、0.5 μg/mL,分别包被酶标板,每孔100 μL,4 ℃过夜。PBST洗涤3次,用5%脱脂奶粉37 ℃封闭2 h。以1:400、1:800、1:1600、1:3200倍稀释的阳性和阴性血清为一抗,37 ℃作用1 h。PBST洗涤3次后,加入HRP标记的山羊抗兔IgG,37 ℃作用1 h。TMB-H2O2避光显色15 min,2 mol/L硫酸终止反应,测定OD450值,选择阳性OD450>1.0、阴性OD450<0.1、P/N值最大的组合作为重组抗原的最适包被浓度和血清最佳稀释度。
1.7.2 酶标二抗最适稀释度的确定 用重组抗原最适稀释浓度包被酶标板,阳、阴性血清按最佳浓度稀释,酶标二抗稀释成1:1000、1:2000、1:4000共3个梯度,重复4次,进行ELISA测定。P/N值最大时的酶标二抗稀释度为最适稀释度。
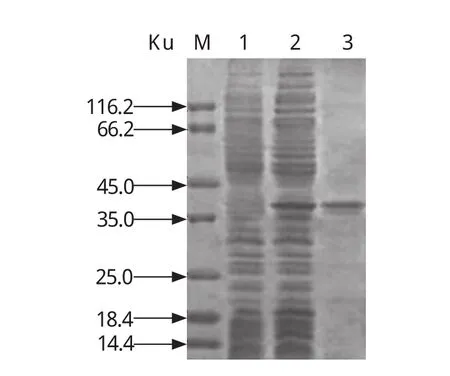
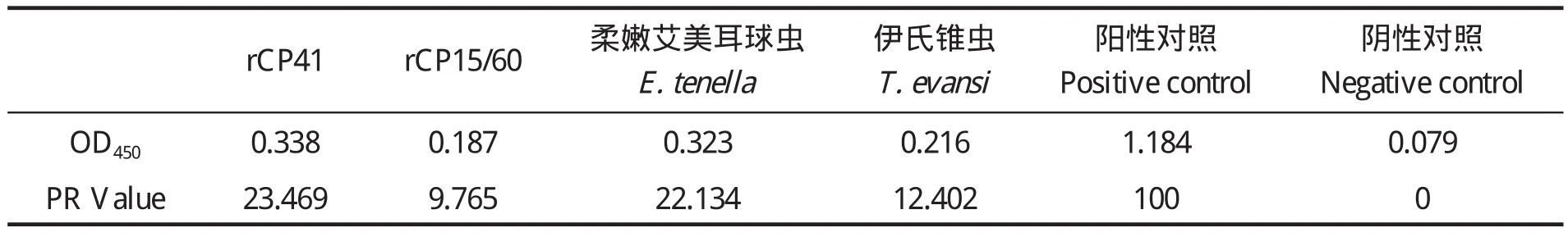
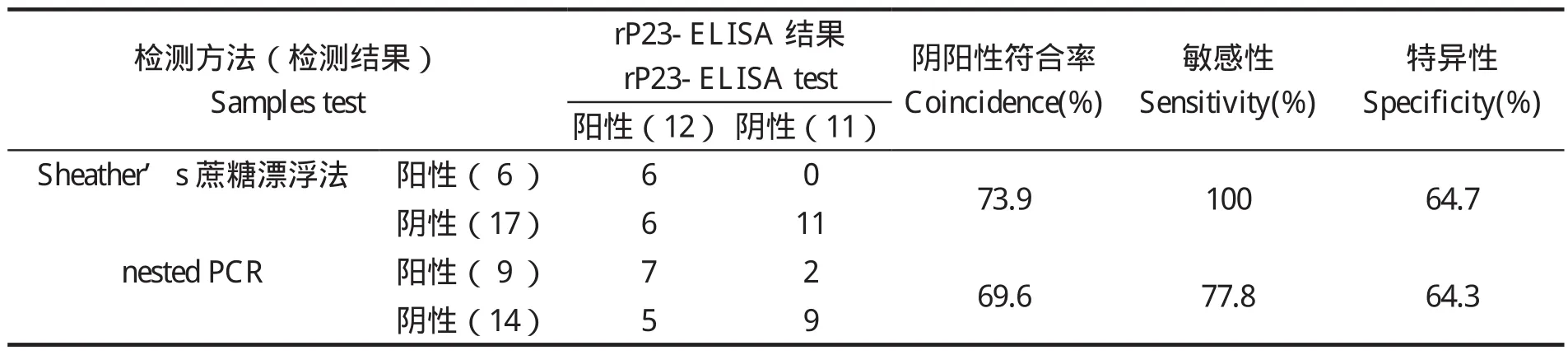
1.7.3 rP23-ELISA判定标准的确定 判定标准采用临界值法[20],随机收集60份经Sheather's蔗糖漂浮法和nested PCR法检测为阴性的兔血清样品,用建立的间接ELISA法检测,重复3次,并设阳性对照。测定OD450值后按以下公式将OD450值转化成样本百分反应活性(percent reactivity,PR):PR=[OD450(样本)- OD450(阴性对照)]/[OD450(阳性对照)-OD450(阴性对照)]×100,求出所有阴性血清样品的PR平均值(x)和标准差(SD)。以PR(样本)值x≥ +4sd时判为阳性;PR(样本)值< x +2sd时,判为阴性;当 x+2sd≤PR(样本)值< x +4sd时判为疑似,需重新检测样本,重检时PR(样本)值≥x +3sd时判为阳性,PR值 1.8 交叉反应试验 用rP23包被酶标板后,分别与1:100稀释的rCP41免疫兔血清、rCP15/60免疫兔血清、伊氏锥虫感染兔血清、柔嫩艾美耳球虫可溶性全抗原免疫兔血清,各分别取3份,每份血清平行做3个重复,按建立的rP23-ELISA方法,加入对应的HRP标记二抗,检测血清交叉反应情况。 1.9 重复性试验 1.9.1 批内重复性试验 在相同试验条件下,用rP23包被酶标板后,选取抗体效价不同的6份阳性血清和2份阴性血清,每份血清样品平行做2个重复,用建立的rP23-ELISA方法检测,并按公式PR值的变异系数(coefficient of variance,CV):CV=[样本标准差(SD)/样本平均数(x)]×100%,计算PR值的变异系数。 1.9.2 批间重复性试验 在4个不同时间,以4批不同时间纯化的重组蛋白抗原分别包被酶标板,利用建立的rP23-ELSIA技术,对抗体效价不同的6份阳性血清和2份阴性血清进行检测,每份样品重复4次,观察其变异系数(CV)。 1.10 田间样品检测及敏感性、特异性试验应用建立的rP23-ELISA技术对23份临床血清样品进行检测。同时收集对应宿主的粪便样品,用Sheather’s蔗糖漂浮法检测[21]。采用蔗糖密度梯度离心法对粪便样品进行纯化[22],利用FTA Classic Card DNA提取试剂盒提取DNA,用nested PCR法进行检测[23],观察其阴阳性符合率、敏感性、特异性[20]。 2.1 重组质粒pGEX-P23的鉴定 重组质粒pGEX-P23经EcoRⅠ、XhoⅠ双酶切后,出现2条片段,外源片段大小约为342 bp(图 1),与预计大小一致。序列测定显示没有发生序列突变。 图1 pGEX-P23重组质粒的鉴定Fig. 1 Identification of pGEX-P23 plasmid 2.2 rP23蛋白的表达与纯化 SDS-PAGE电泳分析显示,重组质粒pGEX-P23转化菌经IPTG诱导表达5 h后,出现了明显的表达条带,约为39 ku,与预计大小相同。表达产物经GST亲和树脂纯化后,得到了较纯的目的蛋白(图2),经Epoch多体积分光光度计检测显示,纯化的重组蛋白浓度为4.1 mg/mL。 图2 表达产物的SDS-PAGE电泳Fig. 2 SDS-PAGE electrophoresis of the expressed recombinant protein 2.3 重组蛋白的免疫原性分析 Western blot 结果证实,rP23与隐孢子虫感染兔血清有反应,与未感染隐孢子虫的SPF兔阴性血清不反应(图3)。 图3 表达产物的Western blot分析Fig. 3 Western blot analysis of the expressed products 2.4 间接ELISA检测方法的建立 2.4.1 重组抗原最适包被浓度、血清最佳稀释度、酶标抗体工作浓度的确定 通过方阵式,抗原包被最适被浓度为2μg/mL,一抗血清最佳稀释度为1:800,山羊抗兔IgG-HRP酶标二抗工作浓度为1:2000。 2.4.2 阴、阳性临界值的确定 60份阴性血清样本平均PR值(x)和标准差(SD)分别为14.294与4.736。样本的PR值主要分布在5~25,占阴性血清样本的96%,数据合理,可以制定判定标准。即当PR≥32.79时判为阳性;当PR<23.77时判为阴性;当PR值介于32.79~23.77(含23.77)判为疑似,对可疑样本须重新检测。重检时,PR≥28.05为阳性,PR<28.05为阴性。 2.5 交叉反应试验结果 以rP23与rCP41免疫兔血清、rCP15/60免疫兔血清、伊氏锥虫、柔嫩艾美耳球虫感染血清反应,PR值均低于23.77,显示为阴性反应,而阴性对照与阳性对照都在规定值范围之内(见表1),表明rP23抗原与其他4份血清之间没有交叉反应。 表1 交叉反应试验结果Table 1 The result of cross-reaction test 2.6 重复性试验结果 批内重复性试验的变异系数为1.91%~8.82%,均小于10%;不同批次、不同时间批间重复性试验的变异系数分别在2.30%~14.17%、1.21%~14.52%,均小于15%,说明建立的间接ELISA检测方法具有良好的重复性(见表2)。 表2 重复性试验结果Table 2 The results of repetition test 2.7 田间样品检测及敏感性、特异性试验 应用建立的rP23-ELISA技术对从田间采集的23份血清样品进行检测,检测出阳性12份,阴性11份,阳性率为52.17%。对收集的对应宿主的粪便样品分别用Sheather’s蔗糖漂浮法和nested PCR法检测,结果阳性样品分别为6份和9份,阴性样品分别为17份和14份,阳性率分别为26.08%和39.13%。rP23-ELISA技术检测阳性率高于Sheather’s蔗糖漂浮法和nested PCR法检测结果。rP23-ELISA相对于Sheather,s蔗糖漂浮法的阴阳性符合率为73.9%,敏感性为100%,特异性为64.7%;rP23-ELISA相对于nested PCR的阴阳性符合率为69.6%,敏感性为77.8%,特异性为64.3%(见表3)。 表3 田间样本检测结果比较Table 3 Comparison of detection result of field samples 本试验应用rP23建立了诊断隐孢子虫感染的间接ELISA检测方法(rP23-ELISA),可以检测隐孢子虫感染血清中的特异性抗体,不与柔嫩艾美耳球虫、伊氏锥虫等寄生虫感染血清发生交叉反应,也不与rCP41和rCP15/60等隐孢子虫自身蛋白免疫血清发生交叉反应。田间样品检测显示,rP23-ELISA技术检测阳性率高于Sheather’s蔗糖漂浮法和nested PCR法检测结果。初步可以确定rP23-ELISA敏感性较好,这为下一步建立高灵敏性rP23-ELISA试剂盒奠定了实验基础。 在本试验中,饱和蔗糖漂浮法检测阳性的样品,nested PCR和ELISA检测全为阳性,说明饱和蔗糖漂浮法的检出率比间接ELISA和nested PCR法都低,其检出率不高,容易漏检,这与严若峰等[25]报道一致。nested PCR的敏感性高,阳性符合率可达100%,阴性符合率可达99.1%[26]。本试验中建立的间接ELISA法与nested PCR法检测的符合率只有69.6%,造成这两种检测结果不一致的可能原因有:第一,兔感染隐孢子虫后3 d就可以在粪便检测到卵囊,但3 d之内机体产生的抗体水平不足以用间接ELISA检测到,这就可能产生nested PCR检测阳性而ELISA检测阴性的情况。第二,Hadfield[26]报道nested PCR法能检测到每克粪便200个卵囊,但每克粪便中卵囊量小于200个时,nested PCR法检测成阴性。本试验中部分样品nested PCR检测为阴性而ELISA检测为阳性,可能是兔感染隐孢子虫后,虽然粪便中卵囊不足以被nested PCR检测到,但血液中的抗体却能被ELISA检测到,说明rP23-ELISA敏感性比nested PCR高。第三,隐孢子虫主要感染2~3月龄的幼兔,感染率可高达78.13%,随着月龄增加阳性率逐渐下降,到6月龄以上感染率仅为50%[27,28]。本试验中部分样品nested PCR检测为阴性而ELISA检测为阳性,说明兔曾感染过隐孢子虫,虽然粪便中已经不再排出卵囊,但血液中的抗体还能被检测到,这从另一方面也反映出隐孢子虫的感染情况,在流行病学调查上有很重要的意义。第四,nested PCR与ELISA都可能存在假阳性和假阴性情况,需要重复检测确定阴、阳性,这有助于提高检测的准确率。笔者认为,在流行病学调查时,nested PCR与ELISA这两种不同检测手段可相互结合进行,这更能准确的反应隐孢子虫的感染情况,进而提出防治措施。当然,其敏感性和特异性还需要更多的田间样品来检验。此外,对其他种类动物血清中隐孢子虫抗体的检测还有待进一步研究。 本试验采用的临界值法在商品化的ELISA诊断试剂盒中得到了很好的应用,孙东波[29]也在实验中证明了该方法的可行性。本试验在此基础上又借鉴了祖立闯等关于引入样本百分反应活性(percent reactivity,PR)和“可疑区”能有效地减少假阳性和假阴性的实验结果[20],在制定rP23-ELISA的判断标准时,将临界值加减一个标准差的范围作为可疑区,减少了误判,使得结果真实可靠。在制备隐孢子虫标准阴性血清时,选择SPF级兔并通过Sheather's蔗糖漂浮法和nested PCR检测为阴性者作为样本,增加了判断标准的准确性。 隐孢子虫P23蛋白是隐孢子虫最保守的表面蛋白,Ungar等[14]研究发现感染隐孢子虫的阳性血清92%都能识别此P23蛋白。关于P23蛋白以往报道均是从微小隐孢子虫中获得。本实验室在前期工作中,利用RT-PCR技术分别对实验室保存的隐孢子虫鼠基因型、兔隐孢子虫、隐孢子虫猪基因型Ⅱ的P23基因进行了扩增,序列测定显示,隐孢子虫鼠基因型P23蛋白基因与兔隐孢子虫、微小隐孢子虫和隐孢子虫猪基因型Ⅱ相似性分别是99.4%、97.6%和99.7%;预计的氨基酸同源性分别为100%、97.3%和 99.1%[15]。本研究将隐孢子虫鼠基因型P23基因克隆到pGEX-4T-1载体,成功地实现了P23基因的高效表达,rP23蛋白以可溶的形式存在于细菌中,且带有GST标签蛋白,有利于重组蛋白的大量纯化。 本试验以隐孢子虫鼠基因型P23基因重组表达蛋白为抗原,构建了检测隐孢子虫抗体的间接ELISA方法,该方法对隐孢子虫感染兔的诊断具有较高的敏感性、特异性和重复性,可应用于临床实践,但该方法对隐孢子虫感染的其它动物的诊断效果还需进一步实验观察。 [1]Colussi O, Rouen A, Seksik P, et al. Acute cryptosporidiosis as a cause of sudden recurrence of digestive symptoms in patients with Crohn's disease [J]. J Crohns Colitis, 2010,4(6): 669-670. [2]Alum A, Rubino J R, Khalid Ijaz M, et al. Comparison of molecular markers for determining the viability and infectivity of Cryptosporidium oocysts and validation of molecular methods against animal infectivity assay [J]. Int J Infect Dis, 2010, 15(3): e197-e200. [3]Abrahamsen M S, Templeton T J, Enomoto S, et al. Complete genome sequence of the apicomplexan,Cryptosporidium parvum [J].Science, 2004, 304(5669): 441-445. [4]Hall G A, Reynolds D J, Parsons K R, et al. Pathology of calves with diarrhea in southern Britain [J]. Res Vet Sci,1988, 45(2): 240-250. [5]Jenkins M C, Trout J, Fayer R, et al. Development and application of an improved semiquantitative technique for detecting low-level Cryptosporidium parvum infections in mouse tissue using polymerase chain reaction [J]. J Parasitol, 1998, 84(1): 182-186. [6]Azami M, Moghaddam D D, Salehi R, et al. The identification of Cryptosporidium species (protozoa)in Ifsahan, Iran by PCR-RFLP analysis of the 18S rRNA gene [J]. Mol Biol(Mosk), 2007, 41(5): 934-939. [7]Higgins J A, Fayer R, Trout J M, et al. Real-time PCR for the detection of Cryptosporidium parvum [J]. J Microbiol Methods, 2001, 47(3): 323-337. [8]Wang C, He H, Duan M. Development and evaluation of a recombinant CP23 antigen-based ELISA for serodiagnosis of Cryptosporidium parvum [J]. Exp Parasitol, 2009, 121(2):157-162. [9]Anusz K Z, Mason P H, Riggs M W, et al. Detection of Cryptosporidium parvum oocysts in bovine feces by monoclonal antibody capture enzyme-linked immunosorbent assay [J]. J Clin Microbiol,1990, 28(12): 2770-2774. [10]Plutzer J, Karanis P, Domokos K, et al. Detection and characterisation of Giardia and Cryptosporidium in Hungarian raw,surface and sewage water samples by IFT,PCR and sequence analysis of the SSUrRNA and GDH genes [J].Int J Hyg Environ Health, 2008, 211(5 6): 524-533. [11]Perryman L E, Jasmer D P, Riggs M W, et al. A cloned gene of Cryptosporidium parvum encodes neutralizationsensitive epitopes [J]. Mol Biochem Parasitol, 1996,80(2): 137-147. [12]Reperdnt J M, Naciri M, Iochmann S, et al.Major antigens of Cryptosporidium parvum recognized by serum antibodies from different infected animal species and man [J]. Vet Parasitol, 1994, 55(1 2):1-13. [13]Ehigiator H N, Romagnoli P, Priest J W, et al. Induction of murine immune responses by DNA encoding a 23 kDa antigen of Cryptosporidium parvum [J]. Parasitol Res,2007, 101(4): 943-950. [14]Ungar B L, Nash T E. Quantification of specific antibody response to Cryptosporidium antigens by laser densitometry[J]. Infect Immun, 1986, 53(1): 124-128. [15]胡义彬, 米荣升, 陈兆国. 隐孢子虫不同基因型P23基因的克隆及序列比较[J]. 动物医学进展, 2010, 31(12):14-18. [16]于慧珠, 岳城, 陈兆国, 等. 隐孢子虫鼠基因型卵囊壁蛋白CP41基因的原核表达及抗血清的制备[J].中国预防兽医学报, 2010, 32(8): 622-626. [17]于慧珠, 陈兆国, 岳城, 等. 微小隐孢子虫子孢子表面抗原CP15/60基因的克隆与原核表达[J]. 中国兽医科学, 2008, 38(8): 670-675. [18]萨姆布鲁克J, 拉塞尔 D W. 分子克隆实验指南[M]. 金冬雁, 黎孟枫, 侯云德, 等译. 3版. 北京: 科学出版社,2002. [19]米荣升. 上海地区不同动物源隐孢子虫种型鉴定及微小隐孢子虫CP15和P23基因的克隆和表达[D]. 新疆:新疆农业大学, 2007. [20]祖立闯, 朱远茂, 王延辉, 等. 牛传染性鼻气管炎病毒重组gD蛋白间接ELISA方法的建立及应用[J]. 中国预防兽医学报, 2008, 30(7): 537-543. [21]陈兆国, 吴薛忠, 史天卫, 等. 几种检查鸡隐孢子虫病的实验室方法比较研究[J]. 上海畜牧兽医通讯, 1994,(4): 4-5. [22]Arrowood M J, Sterling C R. Isolation of Cryptosporidium oocysts and sporozoites using discontinuous sucrose and isopycnic Percoll gradients [J]. J Parasitol, 1987, 73(2):314-319. [23]Xiao L, Escalante L, Yang C F, et al. Phylogenetic analysis of Cryptosporidium parasites based on the Small-Subunit rRNA gene locus [J]. Appl Environ Microbiol, 1999, 65(4): 1578-1583. [24]张西臣. 隐孢子虫病[M]. 吉林: 吉林大学出版社,2004, 169-177. [25]严若峰, 周金林, 李培英. 4种方法检测牛奶等样品中微量隐孢子虫卵囊的比较[J]. 中国寄生虫病防治杂志,2004, 17(4): 206-208. [26]Hadfield S J, Robinson G, Elwin K, et al. Detection and differentiation of Cryptosporidium spp. in human clinical samples using real-time PCR [J]. J Clin Microbiol, 2010,49(3): 918-924. [27]陈永忠, 孙英, 王海连. 湟中县长毛兔隐孢子虫感染调查[J]. 青海畜牧兽医杂志, 2001, 31(5): 24. [28]李海峰, 张守发, 许应天, 等. 延边地区兔隐孢子虫感染情况调查[J]. 黑龙江畜牧兽医, 2005, (9): 39-40. [29]孙东波, 冯力, 时洪艳, 等. 猪传染性胃肠炎病毒重组N蛋白抗原间接ELISA抗体检测方法的建立[J]. 中国预防兽医学报, 2006, 28(5): 572-576.2 结果



3 讨论
