深黄被孢霉固态发酵生产油脂的工艺参数及发酵前后底物组成变化规律的研究
2011-06-06孙若芸毛湘冰陈代文
孙若芸 余 冰 毛湘冰 毛 倩 陈 洪 陈代文
(四川农业大学动物营养研究所,动物抗病营养教育部重点实验室,雅安 625014)
1 材料与方法
1.1 菌种与培养基
深黄被孢霉(Mortierella isabellina As 3.3410)购自中国科学院微生物研究所;葡萄糖、琼脂粉、磷酸二氢钾、七水硫酸镁、酵母膏、硫酸铵和柠檬酸钠等化学试剂均为分析纯;马铃薯、麸皮、玉米淀粉和复合蛋白质饲料(粗纤维、粗蛋白质和粗脂肪含量分别为3.2%、18.3%和4.9%)均为市购,其中粉料已过40目筛。
斜面培养基:马铃薯200 g(去皮,切成小块煮沸 30 min,纱布过滤)、葡萄糖 20.0 g、琼脂粉15.0 g、磷酸二氢钾3.0 g、七水硫酸镁1.5 g、蒸馏水1 000 mL,调 pH 至6.0,112 ℃灭菌20 min。
种子培养基:葡萄糖10.00 g、磷酸二氢钾0.10 g、七水硫酸镁0.03 g、酵母膏0.20 g、硫酸铵0.20 g、蒸馏水 100 mL,调 pH 至 6.0,112 ℃ 灭菌20 min。
基础固态发酵培养基:一定量的发酵底物、柠檬酸钠0.20%、磷酸二氢钾0.20%、七水硫酸镁0.05%,加蒸馏水使含水量达到50%,自然pH,不灭菌。
1.2 试验方法
1.2.1 种子液的准备
将斜面培养7 d的深黄被孢霉接种到种子培养基中,28℃、180 r/min摇床培养2 d,待用。
由表5可知,传热系数K的试验测量值与理论计算值相吻合,平均误差为0.442%,设备精度为99.558%,符合国家标准[5-6].
1.2.2 发酵底物的筛选
采用单因素试验设计,分别以玉米淀粉和麸皮(1∶1)的混合物,玉米淀粉、复合蛋白质饲料和麸皮(1∶1∶2)的混合物以及复合蛋白质饲料和麸皮(1∶1)的混合物作为发酵底物配制基础固态发酵培养基,每500 mL装料量为50 g,含水量50%,按20%的接种量接种培养2 d的种子液,调节初始pH为6.0,采用双温度培养,连续发酵7 d(前2天培养温度为28℃,后5天培养温度为26℃),每24 h摇动1次三角瓶。每个处理设5个重复,结果以平均值表示。
1.2.3 发酵条件的优化
在确定发酵底物为玉米淀粉和麸皮的混合物的基础上,采用正交试验设计优化发酵条件,主要考察底物配比即玉米淀粉∶麸皮(A)、含水量(B)、接种量(C)和装料量(D)这4个因素,每个因素设3个水平,按照L9(34)正交表安排试验,详见表1。每个处理设3个重复,结果以平均值表示。
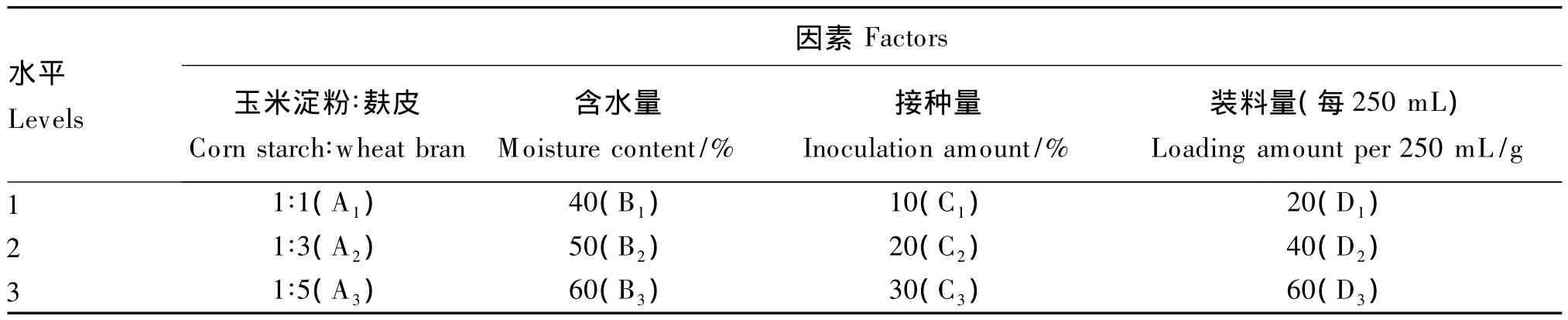
表1 发酵条件的正交试验设计Table 1 Orthogonal test design for fermentation conditions
1.2.4 验证试验
以玉米淀粉和麸皮(1∶3)的混合物作为发酵底物,每250 mL装料量60 g,含水量60%,按30%的接种量接种发酵2 d的种子液,调节初始pH为6.0,采用双温度培养连续发酵7 d,每24 h摇动1次三角瓶。该处理设5个重复,结果以平均值表示。
1.2.5 发酵前后底物理化性质分析
分别测定验证试验中发酵前后底物的还原糖、蛋白质浓度以及中性洗涤纤维(NDF)、酸性洗涤木质素(ADL)、总淀粉和直链淀粉含量,并对发酵前后底物做扫描电镜(SEM)分析及X射线衍射(XRD)分析。
1.2.6 样品采集与指标测定
将发酵后的产物在65℃下烘干至恒重,过40目筛,-20℃保存待测。
油脂、纤维(NDF和ADL)含量及总能的测定参照张丽英[7]的方法;脂肪酸组成及含量的测定参照 Ruiz-Rodriguez等[8]的方法;还原糖、蛋白质浓度的测定参照杨金龙等[9]的方法;总淀粉含量的测定采用酶水解法[10];直链淀粉含量的测定参照王平[11]的方法;SEM和XRD分析参照闵伟红等[12]的方法。
1.3 数据统计与分析
单因素试验结果采用SAS 12.0中ANOVA过程对数据进行方差分析,在方差分析显著的情况下,采用Duncan氏法进行多重比较;正交试验数据用Excel软件计算,并进行多指标评分及有重复数的方差分析。
2 结果与分析
2.1 发酵底物的确定
经测定,发酵前每100 g玉米淀粉和麸皮的混合物,玉米淀粉、复合蛋白质饲料和麸皮的混合物以及复合蛋白质饲料和麸皮的混合物的油脂含量分别为 2.06、2.93和 4.33 g(干物质基础)。从图1可以看出,采用玉米淀粉和麸皮的混合物,玉米淀粉、复合蛋白质饲料和麸皮的混合物以及复合蛋白质饲料和麸皮的混合物作为发酵底物,每100 g发酵产物最终获得的油脂量分别为15.28、9.18和5.74 g(干物质基础),各处理间差异极显著(P<0.01)。经过7 d连续发酵,以玉米淀粉和麸皮的混合物或玉米淀粉、复合蛋白质饲料和麸皮的混合物作为底物进行发酵,极大地提高了油脂产量,油脂含量分别是发酵前的7.4和3.1倍;以复合蛋白质饲料和麸皮的混合物作为发酵底物,油脂产量提高较少,其油脂含量仅比发酵前提高了32.6%。因此,本试验筛选出的适宜的发酵底物为玉米淀粉和麸皮的混合物。
2.2 发酵条件的确定
发酵条件的优化结果见表2和表3。根据表2中极值R可知,影响油脂产量的因素由主到次依次为含水量、装料量、底物配比(玉米淀粉∶麸皮)和接种量,由表3中Fj值可知,含水量和装料量对油脂产量影响极显著(P<0.01)。根据表2中K值大小,筛选出最佳发酵条件为A2B3C3D3,即发酵底物中玉米淀粉∶麸皮为1∶3、含水量60%、接种量30%、每250 mL装料量60 g。
2.3 验证试验结果
利用筛选出的最适发酵底物,在优化后的发酵条件下生产出的发酵产物的油脂含量为102 g/kg DM,在置信度为99%的置信区间(77.1 ~102.9 g/kg DM)范围内;总能从发酵前的15.81 MJ/kg DM 提高到了20.44 MJ/kg DM。如表4所示,发酵对油脂中的PUFAs有提高趋势,如C18∶3(GLA)由 3.17% 提高到 4.03%,C22∶6[二十二碳六烯酸(DHA)]由0.18%提高到1.70%。
2.4 发酵前后底物理化性质分析结果
2.4.1 化学分析结果
发酵前后底物的化学组成见表5。经过发酵,底物中的NDF、ADL、总淀粉和直链淀粉含量有不同程度下降,其中直链淀粉含量甚至可忽略不计,然而,底物中还原糖和蛋白质浓度有所升高。

图1 不同发酵底物对深黄被孢霉产油脂量的影响Fig.1 Effects of different fermentation substrates on the lipid production by Mortierella isabellina
2.4.2 SEM 和XRD分析结果
图2为不同放大倍数下发酵前后玉米淀粉的SEM图,进行比较后发现,发酵后玉米淀粉的颗粒被腐蚀,小颗粒淀粉增多,玉米淀粉颗粒由光滑近球形变为粗糙的不规则形。图3为发酵前后玉米淀粉的XRD图,经对比可知,通过发酵,玉米淀粉的特征峰消失,变为典型的“馒头状”峰形,即玉米淀粉晶型结构消失。
3 讨论
Peng等[6]接种红树林内生真菌(Microsphaeropsis sp.)孢子悬液固态发酵小麦秸秆和小麦麸的混合物,28℃连续发酵11 d,发酵产物油脂含量为42 g/kg DM;在添加纤维素酶和优化发酵条件后,油脂含量提高到80 g/kg DM。Conti等[5]也采用固态发酵,接种绮丽小克银汉霉(Cunninghamella elegans CCF 1318)孢子悬液发酵谷物,通过添加花生油和优化发酵条件,28℃发酵10 d后,发酵产物中油脂含量为91 g/kg DM。以上这些研究所采用的发酵时间均长于本研究,但其发酵产物中油脂含量要低于本研究最终获得的油脂含量(102 g/kg DM),出现这种结果可能存在以下几点原因:一是菌种产油脂能力的不同。本试验选用的菌种是深黄被孢霉,产油脂的量通常能达到其细胞干重的40%~50%。二是发酵底物的不同。玉米淀粉较之小麦秸秆等是更为理想的碳源,玉米淀粉中的无氮浸出物(NFE)含量高达85%,已有研究报道高碳氮比培养基更有利于油脂的大量蓄积[13-14]。另外,黄忠建等[15]在液态培养基上进行的研究发现,深黄被孢霉产油脂最适的碳源为葡萄糖,而玉米淀粉易被水解为葡萄糖。三是本研究采用双温度培养。Shinmen等[16]研究表明,低温更利于油脂的蓄积。四是接种方式不同。本研究选用接种菌丝体,陈波等[17]的研究确定了接种菌丝体较接种孢子是更为合理的接种方式。

表2 不同发酵条件对深黄被孢霉产油脂量的影响Table 2 Effects of different fermentation conditions on the lipid production by Mortierella isabellina
通过筛选发酵底物和优化发酵条件,提高了发酵产物中油脂的含量,并对油脂中PUFAs含量有提高趋势,但要低于液态发酵相关试验结果。如余龙江等[18]通过向深黄被孢霉培养基中添加0.8 g/L的谷氨酸,使花生四烯酸(ARA)的产量提高到了1.41 g/L;而使用不同的深黄被孢霉突变株进行液态发酵,研究结果表明可显著提高培养基中 GLA 的含量[17,19-20]。本试验中 PUFAs 含量低于前人研究结果的原因可能包括以下2点:一是本试验采用的菌种是未经物理化学等诱变的原始菌株,产油脂能力,特别是产PUFAs能力有限;二是采用的发酵方式为固态发酵,国内外已有研究结果[6,21-22]和本研究的正交试验结果均表明含水量对油脂产量影响极显著,含水量高更有利于油脂的蓄积。因此,固态发酵方式在影响油脂生成的同时,可能也影响了PUFAs的合成。

表3 深黄被孢霉产油脂量发酵条件的方差分析Table 3 Variance analysis of fermentation conditions for the lipid production by Mortierella isabellina

表4 发酵前后油脂中脂肪酸组成Table 4 Fatty acid composition of lipid before and after fermentation %
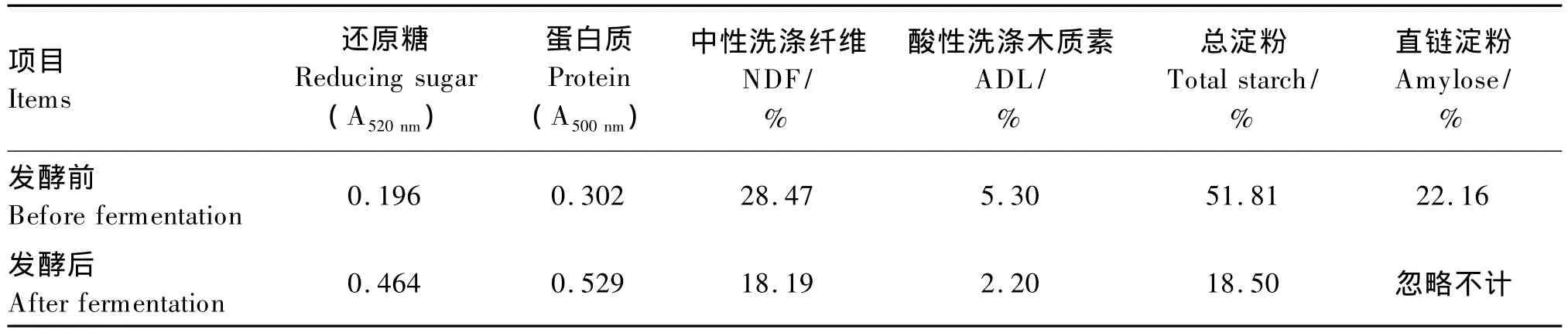
表5 发酵前后底物的化学组成Table 5 Chemical composition of substrate before and after fermentation

图2 不同放大倍数下发酵前后玉米淀粉的SEM图Fig.2 SEM images of corn starch before and after fermentation at different magnification scales
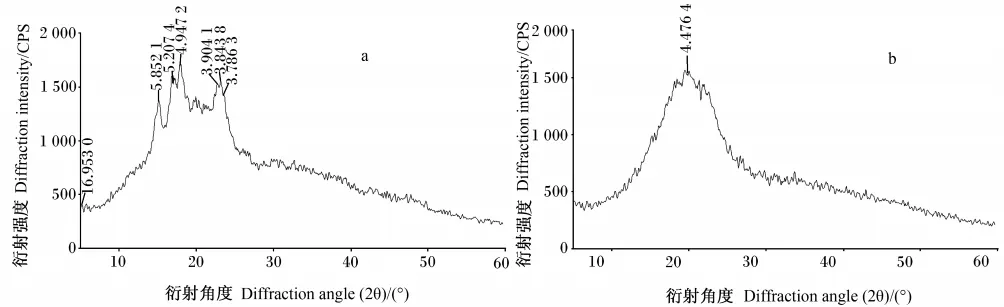
图3 发酵前后玉米淀粉的XRD图Fig.3 XRD images of corn starch before and after fermentation
此外,本研究中优化后的油脂产量低于优化前,可能是由于单因素试验所选用的发酵容器为500 mL的三角瓶,正交试验和验证试验所选用的发酵容器为250 mL三角瓶,导致通气量不同所致。正交试验方差分析结果表明装料量对油脂产量影响极显著,即通气量将影响油脂产量。
通过分析发酵前后玉米淀粉物理结构发现,固态发酵使得玉米淀粉颗粒被腐蚀,小颗粒淀粉增多,且晶型结构消失。闵伟红等[12]研究表明,淀粉结构的改变会相应地引起淀粉化学性质的改变。对发酵前后的底物进行化学分析,结果证实发酵降低了底物中总淀粉和直链淀粉的含量,同时底物中NDF和ADL含量也降低,但还原糖和蛋白质浓度升高。据此推测,深黄被孢霉可能通过水解玉米淀粉和降解麸皮中NDF和ADL使得还原糖浓度升高,同时,还与底物中的含氮物一起合成菌体蛋白,因此蛋白质浓度亦升高。
4 结论
①利用深黄被孢霉固态发酵生产油脂,最适的发酵底物为玉米淀粉和麸皮的混合物;获得的最佳发酵条件为 A2B3C3D3,即玉米淀粉∶麸皮为1∶3、含水量 60%、接种量 30%、250 mL 装料量60 g,其中含水量和装料量对油脂产量影响极显著。
②本研究所获得的发酵产物中油脂含量达到了102 g/kg DM,总能从发酵前的15.81 MJ/kg DM提高到了20.44 MJ/kg DM,并对 PUFAs有提高趋势。
[1]XIAN M,NIE J,MENG Q,et al.Production of γlinolenic acid by disrupted mycelia of Mortierella isabellina[J].Letters in Applied Microbiology,2003,36(3):182-185.
[2]EROSHIN V,SATROUTDINOV A,DEDYUKHINA E,et al.Arachidonic acid production by Mortierella alpina with growth-coupled lipid synthesis[J].Process Biochemistry,2000,35(10):1171 -1175.
[3]BAJPAI P,BAJPAI P,WARD O.Eicosapentaenoic acid(EPA)formation:comparative studies with Mortierella strains and production by Mortierella elongata[J].Mycological Research,1991,95(11):1294-1298.
[4]ECONOMOU C,MAKRI A,AGGELIS G,et al.Semi-solid state fermentation of sweet sorghum for the biotechnological production of single cell oil[J].Bioresource Technology,2009,101(4):1385 -1388.
[5]CONTI E,STREDANSKY M,STREDANSKA S,et al.γ-linolenic acid production by solid-state fermentation of Mucorales strains on cereals[J].Bioresource Technology,2001,76(3):283-286.
[6]PENG X,CHEN H.Single cell oil production in solid-state fermentation by Microsphaeropsis sp.from steam-exploded wheat straw mixed with wheat bran[J].Bioresource Technology,2008,99(9):3885-3889.
[7]张丽英.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,2007:61-63.
[8]RUIZ-RODRIGUEZ A,REGLERO G,IBAEZ E.Recent trends in the advanced analysis of bioactive fatty acids[J].Journal of Pharmaceutical and Biomedical Analysis,2009,51(2):305 -326.
[9]杨金龙,潘康成,张均利,等.分光光度法测定瘤胃厌氧真菌对统糠、麸皮的发酵转化实验[J].饲料工业,2005,26(17):43 -44.
[10]黄晓钰.食品化学综合实验[M].北京:中国农业大学出版社,2002:152-153.
[11]王平.不同乳酸菌发酵对玉米淀粉中的直链淀粉含量的影响[J].粮油加工与食品机械,2006(2):86-89.
[12]闵伟红,李里特,王朝辉.乳酸菌发酵对大米淀粉物理化学性质的影响[J].食品科学,2004,25(12):73-76.
[13]RATLEDGE C.Regulation of lipid accumulation in oleaginous micro-organisms[J].Biochemical Society Transactions,2002,30:1047-1050.
[14]PAPANIKOLAOU S,KOMAITIS M,AGGELIS G.Single cell oil(SCO)production by Mortierella isabellina grown on high-sugar content media[J].Bioresource Technology,2004,95(3):287-291.
[15]黄建忠,施巧琴.深黄被孢霉高产脂变株的选育及其发酵的研究[J].微生物学通报,1998,25(4):187-191.
[16]SHINMEN Y,SHIMIZU S,AKIMOTO K,et al.Production of arachidonic acid by Mortierella fungi[J]. Applied Microbiology and Biotechnology,1989,31:11-16.
[17]陈波,王熙.过量积累γ-亚麻酸的深黄被孢霉突变株MI-33的发酵研究[J].食品科技,2007,32(8):63-66.
[18]余龙江,秦文敏.谷氨酸对花生四烯酸产生菌被孢霉发酵的影响[J].生命科学研究,2002,6(1):51 -54.
[19]孟晓敏,郝丽,韩建飞,等.深黄被孢霉H3,3410-5γ-亚麻酸发酵的实验研究[J].大连轻工业学院学报,2006,25(3):168-171.
[20]汤世华,陈明锴,杨建斌,等.深黄被孢霉高产多不饱和脂肪酸优化培养的研究[J].中国油脂,2008,33(5):37-39.
[21]GEMA H,KAVADIA A,DIMOU D,et al.Production of γ-linolenic acid by Cunninghamella echinulata cultivated on glucose and orange peel[J].Applied Microbiology and Biotechnology,2002,58(3):303-307.
[22]FAKAS S,MAKRI A,MAVROMATI M,et al.Fatty acid composition in lipid fractions lengthwise the mycelium of Mortierella isabellina and lipid production by solid state fermentation[J].Bioresource Technology,2009,100(23):6118-6120.
