NF-κB抑制剂PDTC对小鼠肝癌细胞生长的影响
2011-06-01何顺亮周海华余文娟宋瑞祥施广霞郭连英
何顺亮,司 敏,周海华,余文娟,宋瑞祥,施广霞,郭连英,郝 冰
(大连医科大学 1.临床医学七年制2006级,2.临床医学2007级,3.病理生理教研室,辽宁 大连 116044)
核转录因子NF-κB是首先由Sen、Baltimore、Mercurio等,在1986年从成熟B 淋巴细胞和浆细胞核的抽提物中发现的核蛋白因子,因能与免疫球蛋白的κ轻链基因内含增强子的特异性序列(即κB序列,10bP : 5’-GGGACTTTCC-3’)特异结合并促进κ链基因表达而被称为核因子κB ( nuclear factor - κB,NF -κB)[1,2],该因子是一个由复杂的多肽亚单位组成的蛋白家族,包括Rel ( c - Rel) ,RelA(p65) ,RelB,NF -κB1 (p50)和NF -κB2 (p52、p49、p50B)。NF -κB是真核生物中广泛存在的一种多向性、多功能的核转录因子,可调控细胞凋亡、增殖的相关基因,在细胞癌变过程中发挥重要作用。抗氧化剂吡咯烷二硫代氨基甲酸盐 (Pyrro1idine dithiocarbamate ,PDTC) 是NF-κB的特异性抑制剂,PDTC可抑制淋巴瘤、乳腺癌和卵巢癌等肿瘤细胞的增殖,促进细胞凋亡,抑制促炎性因子的分泌[3-5]。本实验用体外细胞培养和体内抑瘤实验研究PDTC 对小鼠腹水型肝癌Hca-F的抗肿瘤作用。
1 材料和方法
1.1 动 物
Balb/c小鼠,无特定病原体, 雌雄各半,共20只,体重雌鼠18~32 g,雄鼠27~39 g。
1.2 药品、试剂与器材
PDTC购于sigma公司; MTT购于Amresco公司,生产批号:0793;DMSO购于天津市光复精细化工研究所,生产批号:060831,丙二醛(Maleic Dialdehyde MDA)试剂盒购于南京建成生物工程研究所。低温高速离心机(EVOLUTION TMKC,美国),酶标仪(BIO-RADmodel550,日本)。
1.3 肿瘤细胞株
小鼠Hca-F细胞株为源自小鼠肝癌细胞H22的高淋巴道转移亚系,常规传代保种。
1.4 体外实验
1.4.1 实验方法[6]:(1) 标本处理:无菌条件下取小鼠腹水0.1 mL加于预盛有PBS缓冲液3 mL的离心管中,离心弃上清,用PBS缓冲液2 mL冲洗后离心3遍,加含有10%胎牛血清的RPMI1640培养基(1640全培基,下同)吹打成细胞悬液,计数并调浓度至1×106细胞/mL。(2)细胞培养:细胞悬液加入96孔培养板中(200 μL /孔),设空白对照组(1640全培基)、细胞对照组(肿瘤细胞+1640全培基)、实验组(肿瘤细胞+含PDTC全培基)。每组设3个复孔,对照孔不加药物。PDTC 用药组分别加入4种不同的浓度的PDTC,从低到高依次为12.5 μg/mL、 25 μg/mL、50 μg/mL、100 μg/mL。37℃,5%CO2下培养培养24 h或8 h,每孔加入20 μL 5%MTT,继续培养4 h,离心去上清,加入DMSO 150 μL/孔,于微量振荡器上振荡10 min,使蓝紫色结晶完全溶解,最后放入酶标仪上以570 nm波长检测吸光度值(absorbance,A)。重复3遍。
1.4.2 计算抑制率:按照实体瘤体外敏感标准[7],抑制率>30%为敏感,<30%为耐药。以抑制率≥70% 为体外高度敏感,50% ≤抑制率<70% 为中度敏感,30% ≤ 抑制率<50%为低度敏感。抑制率=[(细胞对照组平均A值-实验组平均A值)/(细胞对照组平均A值-空白对照组平均A值)]×100% 。
1.5 体内实验
(1)动物分组:20只小鼠,雌雄各半,每只鼠右侧腋下皮下接种Hca-F癌细胞1×106/0.2 mL·只,随机分为攻击对照组、PDTC治疗组。(2)给药方法:PDTC治疗组腹腔注射0.25 g/mL PDTC溶液0.2 mL,攻击对照组腹腔注射生理盐水 0.1 mL/25 g。(3)指标观察:给药后每日测量肿瘤体积和体重,用药结束后处死小鼠后取小鼠的肿瘤并记录体重和瘤重。(4)去除肿瘤中的脂肪和纤维组织,采取10倍稀释制备肿瘤组织匀浆,按照丙二醛(malondialchehyche,MDA)试剂盒说明书操作测定MDA含量,采用放射免疫法检测肿瘤坏死因子α(tumor necrosis factor α,TNF-α)含量。
1.6 统计学方法
2 结 果
2.1 PDTC对肝癌细胞的体外增殖影响
用含有PDTC的完全培养基培养Hca-F细胞24 h或8 h后用MTT法检测细胞的增殖活性,结果显示PDTC对Hca-F细胞的增殖有抑制作用,浓度为25 μg/mL对Hca-F细胞的抑制作用较强, PDTC浓度作用曲线见图1。
2.2 PDTC治疗对小鼠肿瘤体积和瘤重的影响
PDTC治疗接种肿瘤的小鼠10 d,每天测量肿瘤体积,活杀小鼠测瘤重,结果表明PDTC对肿瘤生长没有明显的抑制作用,与对照组比较差异无显著性意义,结果见图2和3。
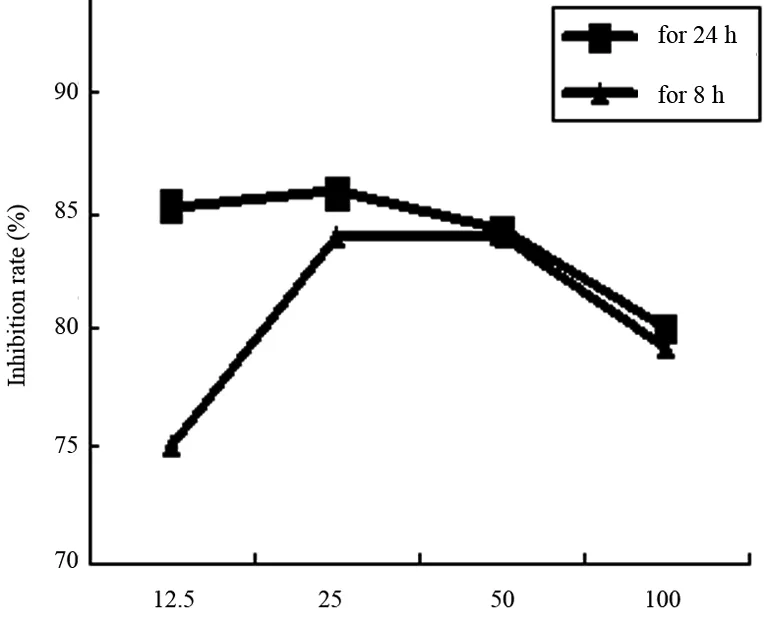
图1 PDTC 对Hca-F细胞增殖的抑制作用
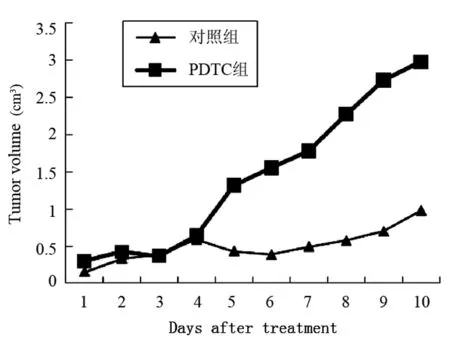
图2 PDTC治疗后Hca-F瘤体积的变化
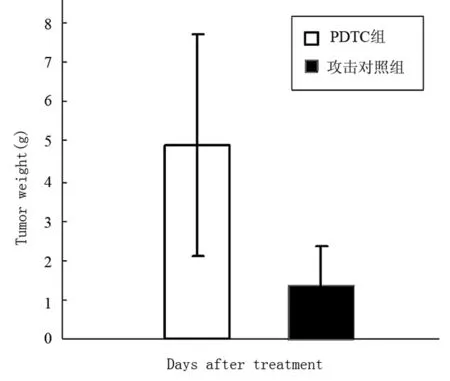
图3 PDTC治疗后Hca-F瘤重的变化
2.3 MDA检测结果
取小鼠肿瘤组织进行MDA试剂盒检测,PDTC组小鼠肿瘤组织匀浆MDA含量为(0.041889±0.00219)μmol/g,攻击对照组为(0.039111±0.00388)μmol/g,两组之间的差异无显著性意义(P>0.05)。
2.4 TNF-α放射免疫检测结果
注射PDTC组的小鼠肿瘤组织匀浆中TNF-α的含量(1.809±2.315) ng/mL低于生理盐水的小鼠肿瘤组织(2.233±2.561)ng/mL,但两组间比较,差异无显著性意义(P>0.05)。
3 讨 论
一些体内外的实验研究表明,抑制肿瘤细胞NF-κB的活性将引起肿瘤细胞的凋亡,从而抑制肿瘤的生长,增加肿瘤细胞对放疗和化疗的敏感性,促进肿瘤细胞凋亡[8]。作为NF-κB的抑制剂PDTC如能应用于临床的肿瘤治疗,则能减少化疗药物的严重毒副作用和化疗耐药的发生率,延长化疗耐药产生时间从而进一步提高化疗效果[9,10]。而本实验为探索NF-κB的抑制剂PDTC对于某些肿瘤细胞是否的确存在抑制作用,其作用的体内外差异是否存在,这些问题对于未来的肿瘤化疗有着重要的意义。
体外MTT法发现PDTC对于Hca-F的增殖有明显的抑制作用,在浓度为25 μg/mL时抑制率明显较高。而体内实验以小鼠为模型,观察瘤重及其体积可发现药物对肿瘤并无明显的抑制作用,反而大部分注射PDTC个体的瘤体积有增大的趋势。MDA是细胞脂质过氧化的产物,可以反映氧化损伤的程度[11],本实验中作为药物疗效的指标,TNF-α是NF-κB的靶基因之一,检测肿瘤组织匀浆中TNF-α水平以反映NF-κB活化情况,在本实验中PDTC治疗组和攻击对照组之间的差异无统计学意义,不能排除药物剂量低的可能性,也可能因为肿瘤组织的氧化应激水平不明显。体内抗肿瘤实验与体外细胞毒实验的结果差别很大,还可能与NF-κB的多功能和PDTC作用机制有关,因为PDTC是通过抗氧化作用抑制氧化应激诱导的NF-κB活化,对其他因素引起的NF-κB活化的抑制作用可能有限。NF-κB活化有其抑制肿瘤细胞凋亡和促进增殖的作用,抑制其活化与功能在体外环境中可能有抗肿瘤作用,但NF-κB活化可促进多种具有抗肿瘤作用的细胞因子产生,从而增强机体的抗肿瘤免疫,抑制NF-κB的功能对抗肿瘤免疫不利。确切机制有待深入研究。
参考文献:
[1] Shinohara T,Miki T,Nishimura N,et al.Nuclear factor-κB-dependent expression of metastasis suppressor KAI1/CD82 gene in lung cancer cell lines expressing mutant p53[J].Cancer Res,2001,61 (2): 673-678.
[2] Bours V,Bentires-Alj M,Hellin AC,et al.Nuclear factor-κB,cancer and apoptosis[J].Biochem pharmacol,2000,60(8):1085-1090.
[3] Nuutinen U,Simelius N,Ropponen A,et al.PDTC enables type I TRAIL signaling in type II follicular lymphoma cells[J].Leukemia Res,2009,33(6):829-836.
[4] 杨春蓉,张徽,黃伟,等.PDTC联合紫杉醇降低MDA-MB-231细胞增殖侵袭能力[J].第三军医大学学报,2010,32:570-579.
[5] Liu GH,Wang SR,Wang B,et al.Inhibition of nuclear factor-κB by an antioxidant enhances paclitaxel sensitivity in ovarian carcinoma cell line[J].Int J Gynecol Cancer,2006,16(5):1777-1782.
[6] 晏马成,林厚文,沈阳,等.噻唑蓝法检测5种抗癌药物对人癌细胞的体外抑制作用[J].中药材,2001,24(6):418-419.
[7] 辛华雯,陈肖嘉,杜光祖,等.十种抗癌药物敏感性试验方法与临床相关性研究[J].中国医院药学杂志,1994,14(12):548-550,576.
[8] Karin M,Cao Y,Greten FR,et al.NF-κB in cancer: from innocent bystander to major culprit[J].Nature Rev,2002,2301-2310.
[9] Liu SF,Ye X,Malik AB.Inhibition of NF-κB activation by pyrrolidine dithiocarbamate prevents in vivo expression of proinflammatory genes[J].Circulation,1999,21(7):1330-1337.
[10] Rodriguez FH,Nelson S,Kolls JK.Cytokine therapeutics for infectious diseases[J].Curr Pharm Des,2000,6(6): 665-680.
[11] Wang Q,Zou L,Liu W,et al.Inhibiting NF-κB activation and ROS production are involved in the mechanism of silibinin′s protection against D-galactose-induced senescence[J].Pharm Biochem Behav,2011,98:140-149.
