乌苏里藜芦生物碱单体计米丁的抗动脉血栓作用
2011-06-01韩国柱赵伟杰王世盛陆文婷
吕 莉,潘 平,韩国柱,周 琴,赵伟杰,王世盛,陆文婷
(1.大连医科大学 药理教研室,辽宁 大连 116044;2.大连理工大学 精细化工国家重点实验室,辽宁 大连 116012;3.大连友谊医院 药剂科,辽宁 大连 116001)
藜芦(Veratrumnigrum) 系百合科多年生草本植物,《神农本草经》及《本草纲目》等均有记载。《中药大词典》等称“藜芦可用于治疗中风失语、黄疸、疥疮”等[1],由此提示藜芦可能具有抗血栓等方面的作用。本研究组一直致力于研究乌苏里藜芦的有效成分及其药理作用,既往研究表明从藜芦中提得的总碱具有降压[2]、改善血流动力学[3,4 ]、中枢抑制作用[5],并首次发现了藜芦总碱具有强大的抗动、静脉血栓作用[6]。本工作组对其生物总碱进行了一系列的化学成分研究,迄今已分离出11种酯型异甾体生物碱[7-9],其中的一种单体经用现代分析技术鉴定为计米丁(germidine)[10,11],其化学结构如图1所示。本文旨在研究计米丁的抗动脉血栓作用,从而确定乌苏里藜芦生物碱的抗血栓活性成分。
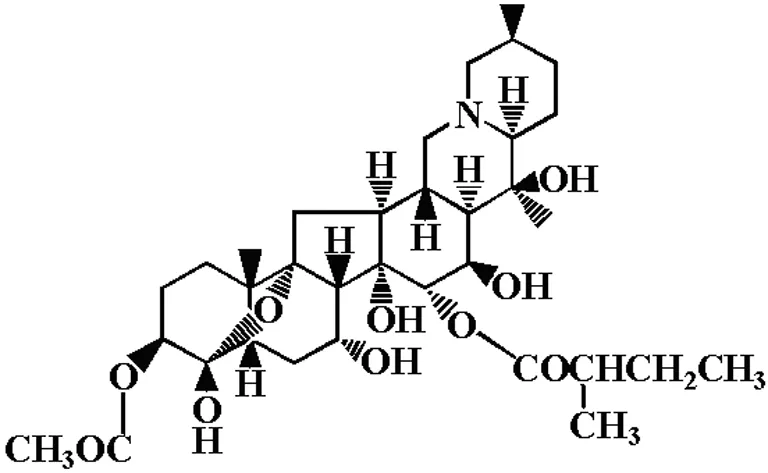
图1 计米丁的化学结构
1 材料和方法
1.1 药物及试剂
盐酸计米丁注射液(500 μg·mL-1)由大连理工大学化学制药系提供;赖氨匹林(Aspirin-DL-Lysine,LAS),安徽安宝药厂产品;ADP,美国Sigma公司产品。
1.2 动 物
SD大鼠,雄性,180~220 g,清洁级,大连医科大学实验动物中心提供,合格证号SCXK(辽)2008-0002。
1.3 仪 器
LBY-NJ2型普利生血液凝聚仪,北京普利生仪器公司产品;BT87-3型体内血栓形成测定仪,包头医学院心血管研究室产品。
1.4 方 法
1.4.1 血流阻塞时间(OT)的测定
大鼠70只,随机分为7组:生理盐水(NS)组,计米丁1.3 μg·kg-1、2.5 μg·kg-1、5.0 μg·kg-1、10.0 μg·kg-1和20.0 μg·kg-1组,以及阳性对照药物赖氨匹林(LAS)18.0 mg·kg-1(相当于阿司匹林10.0 mg·kg-1)组。大鼠腹腔注射乌拉坦1 g·kg-1麻醉,分离一侧颈总动脉,将体内血栓形成仪的刺激电极置于颈总动脉近心端,远心端置一温度传感器,大鼠舌下静脉注射受试药物后20 min以强度为1.6 mA直流电连续刺激颈总动脉7 min,引起血管内膜损伤,从而形成血栓。记录从电刺激开始到温度骤降所需时间,即血流阻塞时间(Occlusion Time,OT)[6,12]。以NS组为基准,计算不同给药组OT延长百分率。
1.4.2 体内血小板聚集率的测定
大鼠60只,随机分为6组:NS组,计米丁2.5 μg·kg-1、5.0 μg·kg-1、10.0 μg·kg-1和20.0 μg·kg-1组,以及阳性对照药物 LAS 18.0 mg·kg-1组。大鼠自尾静脉注射受试药物后20 min于麻醉状态下自腹主动脉取血,以3.8 %枸橼酸钠抗凝(血与抗凝剂体积比为9∶1),以800 r/min离心10 min,取上清即获得富血小板血浆(PRP),剩余血浆经3000 r/min离心10 min,制备贫血小板血浆(PPP)。用PPP调PRP使其含血小板数为3×108·mL-1,以终浓度3 μmol·L-1的ADP为诱导剂,按Born法[13]于血液凝聚仪中测定血小板5 min最大聚集率。以NS组为基准,计算不同给药组血小板聚集抑制百分率。
1.4.3 体外血小板聚集率的测定
大鼠60只,按1.4.2项取血,制备PRP和PPP。用PPP调PRP血小板数至3×108·mL-1,于PRP中分别加入不同浓度受试药物,使其终浓度分别为计米丁6.3 μg·L-1、12.5 μg·L-1、25.0 μg·L-1和50.0 μg·L-1,阳性对照药LAS 40.0 mg·L-1,NS组加入等容量NS。再按1.4.2操作测定血小板5 min最大聚集率。以NS组为基准,计算不同给药组血小板聚集抑制率,并计算计米丁体外抑制血小板聚集的半数抑制浓度IC50。
1.5 统计学方法
2 结 果
2.1 计米丁对大鼠电刺激颈动脉血栓形成的影响
如表1所示,随着计米丁给药剂量的逐渐增大,OT值逐渐延长,且呈良好的量效关系。
表1 静脉注射计米丁对大鼠动脉血栓形成的影响
Tab 1 Effect of germidine (iv) on carotid artery thrombosis in rats
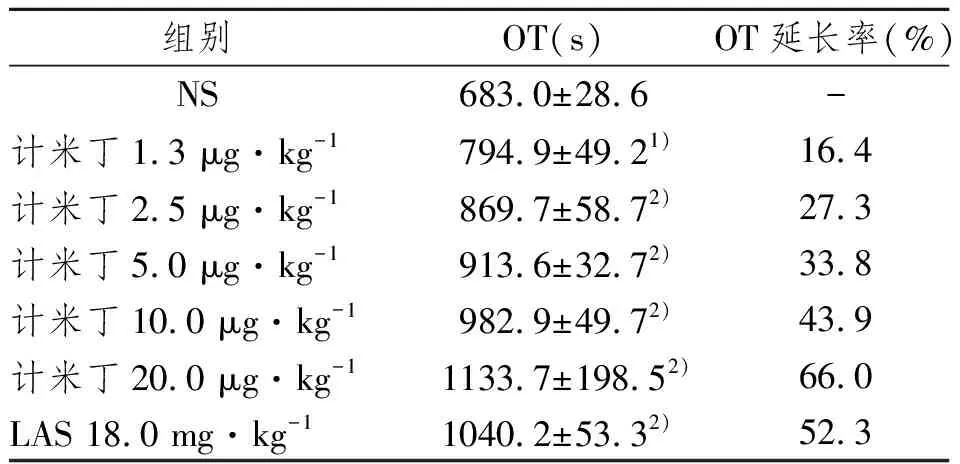
表1 静脉注射计米丁对大鼠动脉血栓形成的影响
1)与NS组相比,P<0.05;2)与NS组相比,P<0.01
组别OT(s)OT延长率(%)NS683.0±28.6-计米丁1.3 μg·kg-1794.9±49.21)16.4计米丁2.5 μg·kg-1869.7±58.72)27.3计米丁5.0 μg·kg-1913.6±32.72)33.8计米丁10.0 μg·kg-1982.9±49.72)43.9计米丁20.0 μg·kg-11133.7±198.52)66.0LAS 18.0 mg·kg-11040.2±53.32)52.3
2.2 计米丁对大鼠体内、外血小板聚集率的影响
如图2所示,NS组、计米丁2.5 μg·kg-1、5.0 μg·kg-1、10.0 μg·kg-1、20.0 μg·kg-1组和LAS 18.0 mg·kg-1组大鼠5 min内血小板最大聚集率分别为(69.9±3.3)%、(54.0±5.4)%、(42.0±5.7)%、(36.7±4.2)%、(25.9±5.1)%和(36.9±4.3)%。与NS组相比,计米丁从小到大剂量组血小板聚集抑制率分别为22.7%、39.9%、47.4%、62.9%(P<0.01),LAS阳性对照药LAS组血小板聚集抑制率为47.2%(P<0.01)。
如表2所示,随着计米丁终浓度的增大,ADP诱导的大鼠5 min内血小板最大聚集率值逐渐降低,与NS组相比,呈剂量依赖性地抑制ADP诱导的大鼠体外血小板聚集。计米丁终浓度25.0 μg·L-1与LAS 40.0 mg·L-1的作用强度相当。以血小板聚集抑制率的概率单位(Y)对计米丁终浓度的对数(X)作图,得线性回归方程Y=1.26X+3.15(r=0.9980),计算得计米丁在体外抑制血小板聚集的半数抑制浓度IC50=29.3 μg·L-1。
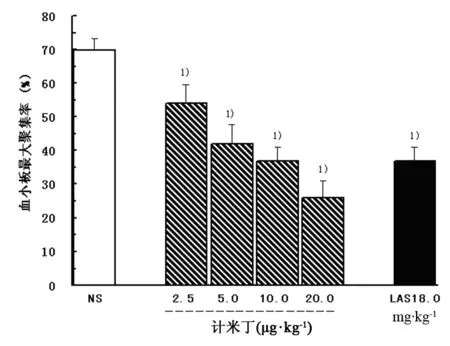
图2 静脉注射计米丁对大鼠体内血小板聚集的影响
表2 计米丁对大鼠体外血小板聚集的影响
Tab 2 Effect of germidine on ADP induced platelet aggregation in vitro rats
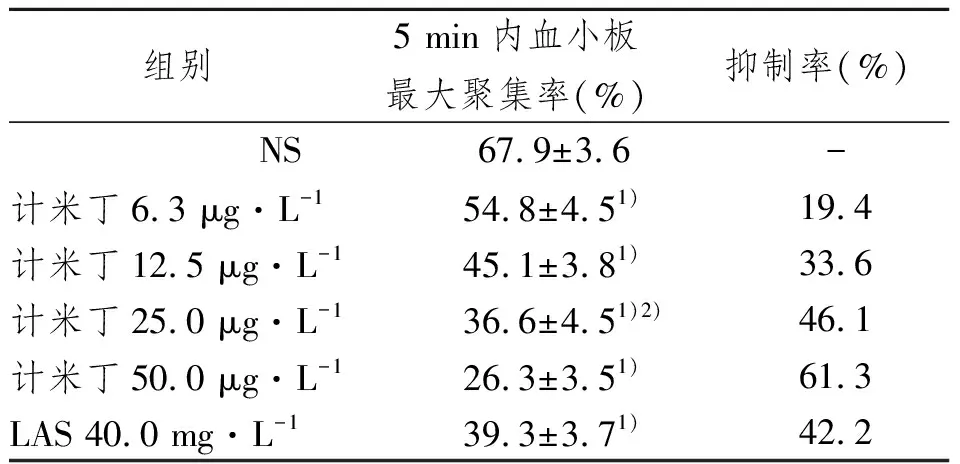
表2 计米丁对大鼠体外血小板聚集的影响
1)与NS组相比,P<0.01;2)与LAS组相比,P>0.05
组别5 min内血小板最大聚集率(%)抑制率(%)NS67.9±3.6-计米丁6.3 μg·L-154.8±4.51)19.4计米丁12.5 μg·L-145.1±3.81)33.6计米丁25.0 μg·L-136.6±4.51)2)46.1计米丁50.0 μg·L-126.3±3.51)61.3LAS 40.0 mg·L-139.3±3.71)42.2
3 讨 论
本实验采用经典的整体动脉血栓形成模型,首次研究了计米丁对实验性动脉血栓形成的影响,并通过体内、外血小板聚集率的测定初步探讨计米丁的抗动脉血栓作用机制。结果表明,大鼠静脉注射计米丁后呈剂量依赖性延长OT,说明计米丁具有抑制动脉血栓形成的作用。
本研究组曾报道,乌苏里藜芦总碱在7.2~42.9 μg·kg-1剂量范围内,其OT延长百分率为9.2%~95.8%;而计米丁在1.3~20.0 μg·kg-1剂量范围内,其OT延长百分率为16.4%~66.0%,提示计米丁可能是总碱中抗动脉血栓形成的一种主要有效成分[6]。
本实验还表明计米丁具有一定的体内、外血小板聚集抑制活性,且呈良好的量效关系。血小板聚集在动脉血栓形成过程中起重要作用,计米丁具有显著的抗血小板聚集的作用,提示可能与其抗动脉血栓形成作用有关。
计米丁为自乌苏里藜芦总碱中提得的一种酯型甾体生物碱,有关其药理作用,未见文献报道。作为一种新型的天然药物,在抗动脉血栓、抗血小板方面,显示了强大的作用,其有效剂量低至μg级水平,计米丁是乌苏里藜芦生物碱中一种重要的抗血栓活性成分,本研究为其作为高效能抗栓药物的开发提供了广阔的前景。其分子药理学作用机制,有待进一步研究。
参考文献:
[1] 江苏新医学院.中药大词典[M].上海:上海人民出版社,1977.5652.
[2] Li Hua,Gao GY,Li SY,et al.Effects of Veratrum nigrum alaloids on centralcatecholaminergic neurons of renal hypertensive rats [J].APS,2000,21(1):23-28.
[3] 李淑媛,李卫平,李传勋,等.盐酸乌苏里藜芦碱对麻醉犬血流动力学的影响[J].中国药学杂志,1997,32(7):25-27.
[4] 杨静娴,戴淑芳,韩国柱,等.乌苏里藜芦碱对家兔和大鼠血液流变学及小鼠出血时间的影响[J].中药药理与临床,1998,14(6):22-24.
[5] 戴淑芳,高广猷.乌苏里藜芦碱对中枢神经系统的抑制作用[J].大连医科大学学报,1997,19 (1):13-15.
[6] Han GZ,Li XY,Lv L,et al.Antithrombotic effects of Veratrum nigrum var.Vssuriense alkaloids[J].Chin Tradit Herb Drugs,2003,34(12):1107-1110.
[7] Zhao WJ,Chen J,Guo YT,et al.Chemical research on the alkaloids from Veratrum nigrun L.var.ussuriense Nakai [J].Bull of Chin Mat Med,1987,12(1):34-35.
[8] Tezuka Y,Kikuchi T,Zhao WJ,et al.(+)-Venssurine ,a new steroidal alkaloid from the roots and rhizoma Veratrum nigrum var.ussuriense and structure revision of (+)- verabenzoamine[J].J Nat Prod,1998,61(11) :1397-1399.
[9] Zhao Wj,Guo YT,Tezuka Y,et al.Isolation and structure determination of Echinuline in the Alkaloids from Veratrum nigrum L.var.ussuriense Nakai[J].Chin J Chin Mater Med,1991,16(7):425-426.
[10] 赵伟杰,孟庆伟,王世盛.乌苏里藜芦的化学成分研究[J].中国中药杂志,2003,28(9):94-95.
[11] Zhao WJ,Tezuka Y,Kikuchi T,et al.Studies on the constituents of Veratrum nigrum L.var.ussureinse.(1) Structure and1H - and13C - Nuclear magnetic resonance spectra of a new alkaloid ,Verussurinine ,and related alkaloids[J].Chem Pharm Bull,1991,39(3): 549-554.
[12] Hladovec J.Experimental arterial thrombosis in rats with continous registration[J].Throm Diath Hemorrhage,1971,26: 407-412.
[13] Born GVR.Aggregation of blood platelets by adenosine diphosphate and its reversal[J].Nature,1962,194:927-929.
