绝经期前后妇女血浆脂联素、纤维蛋白原水平研究
2011-06-01于红玖
于红玖,常 虹,秦 宇,吕 田
(大连医科大学 附属第一医院 特需医疗部,辽宁 大连 116011)
流行病学研究表明,绝经后妇女心血管病、糖尿病等代谢相关疾病发病率较绝经前增高,推测这些疾病的发生可能与绝经后妇女体内激素水平的变化有关。近年来,大量国内外研究证实脂联素(adiponectin,APN)与代谢综合征(Metabolic syndrome,MS),冠心病(Coronary heart disease,CHD)的发病密切相关。有学者推测APN参与绝经后妇女疾病的发生、发展过程,APN水平的升高对机体是一种保护作用,推测绝经后妇女APN水平下降,从而导致疾病的发生;但也有学者提出相反的观点。
本研究对大连医科大学附属第一医院体检中心86名年龄在40~65岁的绝经期前后妇女的血浆APN、纤维蛋白原(fibrinogen,Fig)水平进行测定,探讨APN、Fig在绝经期前后妇女水平的表达及二者关系,为今后的研究及临床工作提供参考依据。
1 资料与方法
1.1 一般资料
研究人群选自 2009年10~11月于大连医科大学附属第一医院体检中心体检者。年龄40~65岁,女性,汉族,详细的月经史,可合并轻度高血压(收缩压SBP<160 mmHg和/或舒张压DBP<100 mmHg) )和/或高血脂。排除患有女性生殖系统疾病、冠心病、糖尿病、肝肾功能不全、血液系统疾病、严重感染性疾病、恶性肿瘤、中风、垂体瘤及甲状腺疾病者。将研究对象按绝经与否分为两组:绝经期前妇女组42例,年龄(44.12±3.28)岁;绝经期后妇女组44例,年龄(56.67±4.35)岁。入选者均签署知情同意书。
1.2 研究方法
1.2.1 体重指数(BMI)计算:受检者空腹、免冠、脱鞋,仅穿单衣,测量净身高(m)、体重(kg),从而计算体重指数(BMI)=体重(kg)/身高(m)2。
1.2.2 Fig、生化指标测定:所有入选者于体检当日,抽空腹外周静脉血实验室化验血常规;Fig检测采用Clouse法。同时以日立7170S自动生化仪采用酶联免疫吸附法测定空腹血糖(FPG)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、尿素氮(Ure)、肌酐(Cre)、尿酸(UA)水平。
1.2.3 血浆APN测定:所有入选者在抽取上述空腹静脉血标本同时,留取2 mL静脉血,以2%EDTA抗凝后离心3000 r/min 15 min,留取上清液血浆0.5 mL,放置-80℃冰箱保存,保存时间<3个月。采用美国Linco公司的放射免疫试剂盒,应用放射免疫法测定。
1.3 统计学方法
2 结 果
2.1 绝经前后两组间临床资料的比较
86例体检者身高、HDL-C、AST、ALT、Cre、UA、FPG、WBC方面,绝经前组与绝经后组比较,差异均无显著性意义。而年龄、体重、WC、BMI、SBP、DBP、TC、TG、LDL-C、Ure、HB、APN、Fig两组相比,差异有显著性意义(P<0.05)。其中,绝经前组血浆APN水平为(7.67±3.47)ng/mL,绝经后组为(11.24±4.59)ng/mL,两组差异有非常显著性意义(P<0.01)。绝经前组血浆Fig水平为(3.07±0.86)g/L,绝经后组为(3.91±0.85)g/L,绝经前组明显低于绝经后组,差异也有非常显著性意义(P<0.01)。见表1。
2.2 绝经前后是否合并高血压分组比较结果
2.2.1 血浆APN按绝经前后是否合并高血压进行分组比较:绝经前未患高血压者(n=31) APN水平为(8.44±3.46) ng/mL;绝经前患高血压者(n=11) APN水平为(4.23±2.31) ng/mL;绝经后未患高血压者(n=30) APN水平为(11.06±5.08)ng/mL;绝经后患高血压者(n=14) APN水平为(8.53±3.63) ng/mL;绝经前、后患高血压者APN水平均分别低于绝经前、后未患高血压患者,差异有显著性意义(P<0.05);绝经前未患高血压者APN水平低于绝经后未患高血压患者,差异也有显著性意义(P<0.01)。同时,绝经前患高血压者APN水平低于绝经后患高血压者,差异有显著性意义(P<0.05)。但是,绝经前未患高血压者APN水平与绝经后患高血压者差异无显著性意义(P=1.1)。见图1。

表1 绝经前后两组临床及实验室资料
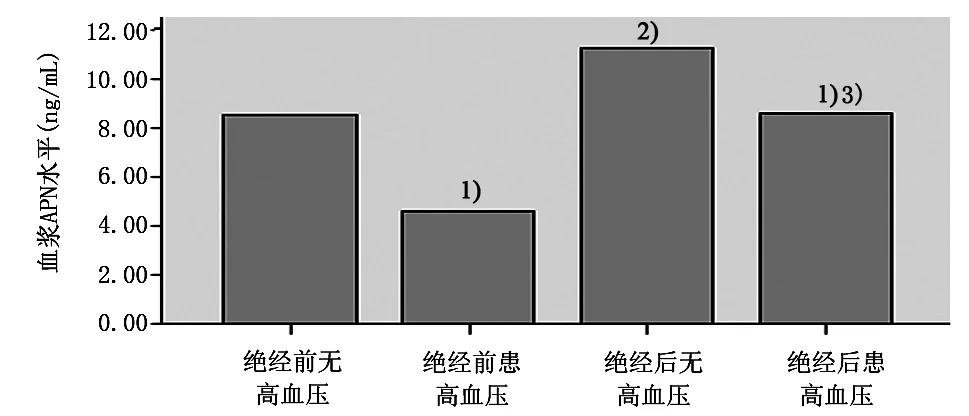
图1 绝经前后按有无高血压分组比较血浆APN水平
1)与无高血压组比较,P<0.05;2)与绝经前无高血压组比较,P<0.01;3)与绝经前患高血压组比较,P<0.05
2.2.2 Fig按绝经前后是否合并高血压进行分组比较:绝经前未患高血压者(n=31) Fig水平为2.87±0.68 g/L;绝经前患高血压者(n=11) Fig水平为(3.18±0.96) g/L;绝经后未患高血压者(n=30) Fig水平为(3.79±0.74) g/L;绝经后患高血压者(n=14) Fig水平为(3.91±0.99) g/L;绝经前未患高血压Fig水平低于绝经后患高血压者及未患高血压者,差异有显著性意义(P<0.01),同时绝经前患高血压者Fig水平低于绝经后患高血压者及未患高血压者,差异有显著性意义(P<0.05),绝经后患与未患高血压者比较差异无显著性意义(P=0.97)。
2.3 Pearson相关分析
2.3.1 APN与各检测指标的相关分析:以APN为因变量,多种检测指标如:年龄、身高、体重、WC、BMI、SBP、DBP、TC、TG、LDL-C、HDL-C、AST、ALT等为自变量,进行Pearson相关分析。本研究显示血浆APN水平与身高、SBP、DBP、AST、ALT、Ure、Cre、UA、HB无明显相关性(P>0.05),与体重、WC、BMI、TC、TG、LDL-C、FPG、WBC呈负相关(P<0.05),与Fig呈正相关(P<0.01),与年龄、HDL-C呈正相关(P<0.05)。见表2。
2.3.2 Fig与各检测指标的相关分析:以Fig为因变量,多种检测指标如:年龄、身高、体重、WC、BMI、SBP、DBP、TC、TG、LDL-C、HDL-C、AST、ALT等为自变量,进行Pearson相关分析。结果显示Fig水平与年龄、身高、SBP、DBP、AST、ALT、TC、TG、HDL-C、LDL-C、Ure、Cre、UA、FPG、WBC、HB无明显相关性(P>0.05),与APN、体重、WC、BMI呈正相关(P<0.01)。见表3。
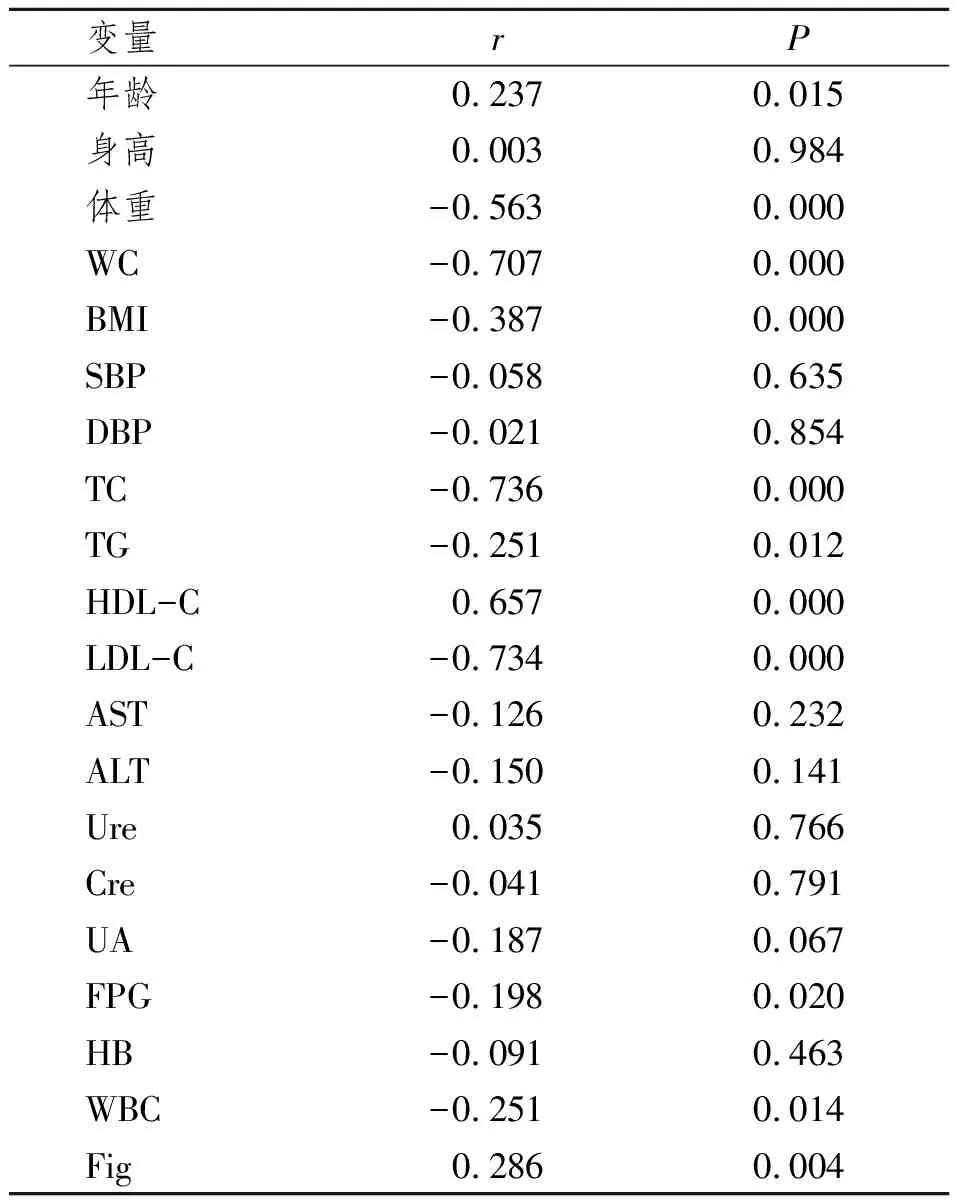
表2 APN与各变量的Pearson相关分析
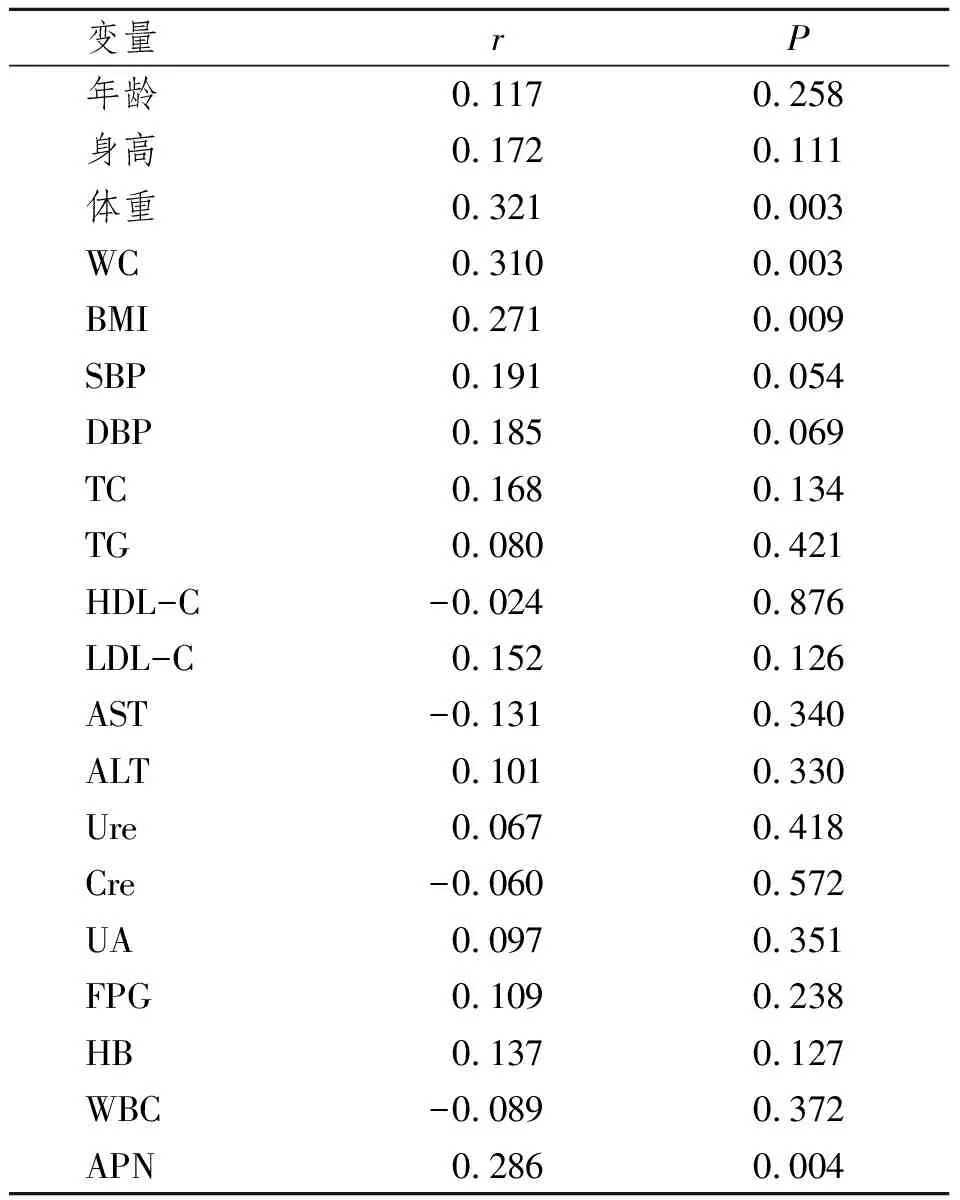
表3 血浆Fig与各变量的Pearson 相关分析
2.4 多元逐步回归分析
2.4.1 APN与各变量的多元逐步回归分析:以APN为因变量,年龄、身高、体重、WC、BMI、SBP、DBP、TG、TC、HDL-C、LDL-C、FPG、AST、ALT、Ure、Cre、UA、WBC、HB、Fig为自变量进行多元逐步回归分析显示,年龄、TG、FPG进入APN的回归方程,是影响血浆APN 的独立因素。见表4。
2.4.2 Fig与各变量的多元逐步回归分析:以Fig为因变量,年龄、身高、体重、APN、WC、BMI、SBP、DBP、TG、TC、HDL-C、LDL-C 、FPG、AST、ALT、Ure、Cre、UA、WBC、HB为自变量,进行多元逐步回归分析显示,身高、BMI、HDL-C、LDL -C进入Fig方程,是影响血浆Fig的独立因素。见表5。

表4 APN与各变量的多元逐步回归分析

表5 Fig与各变量的多元逐步回归分析
3 讨 论
APN是一种脂肪细胞分泌的特有细胞因子,1995年由Scherer等[1]在小鼠3T3脂肪细胞中首次发现 ;Nakano等[2]提纯出人血浆中的APN蛋白。自此人类APN的结构特点、生理功能被广泛研究。目前研究发现,APN在血液中大量存在,分泌无明显的昼夜节律,不受进餐的影响,一般男性APN水平低于女性。APN具有多种重要的生理功能:①增强游离脂肪酸氧化,增加葡萄糖摄取,抑制糖原分解[3];②通过多种途径抗动脉粥样硬化、抗炎[4];③参与多种肿瘤发生、发展[5,6]。
绝经后妇女作为特殊群体,其MS、糖尿病、CHD、肥胖症、癌症等发病率均增高,是否与APN相关;APN是否参与绝经后妇女疾病的发生、发展过程; APN水平的测定,能否为疾病的及早诊治提供一种有效途径;仍是目前亟待解决的问题。Chu等[7]在绝经后MS妇女的IR及APN、廋素、抵抗素及生长素的测定研究中,发现与绝经前对照组相比,绝经后组妇女APN和生长素降低,而廋素和抵抗素升高。Jaak和Toivo[8]对150名女性,按年龄分组,研究APN浓度在健康绝经期前后妇女水平的表达,发现中年和老年绝经后妇女高于中年绝经期前妇女,差异有显著性意义,中年和老年绝经后妇女之间APN水平差异无显著性意义。Gavrila A等[9]对121名妇女进行研究,也得出结论,绝经后妇女APN水平显著升高,差异有显著性意义。本研究对86名女性,按绝经期分组,结果发现,绝经前组APN水平低于绝经后组APN水平,差异有显著性意义(P<0.01)。该结论与多数国外学者研究一致。绝经后妇女APN水平不下降反而升高,其升高的具体机制尚不清楚,但APN水平的升高对机体有一定的保护作用,APN是否在某种程度上延缓并相对降低了绝经后期患病率,还有待于进一步研究证实。
血浆APN的高低与高血压的相关性一直是众多学者的研究热点,一直存有争议。现多数研究支持原发性高血压(Essential hypertension,EH)患者APN水平减低的论点。Adamczak等[10]首次报道了APN与EH之间的关系,发现EH患者APN水平明显低于对照组,而且APN水平与收缩压、舒张压及平均动脉压呈负相关,认为APN可能在EH的发病中起一定作用。而Mallamaci等[11]的研究认为,高血压患者APN水平并不降低,反而升高。本研究结果表明:绝经前后合并高血压者血浆APN水平均低于绝经前后未患高血压者,差异有显著性意义(P均<0.05),而绝经前未患高血压者低于绝经后未患高血压者,差异有显著性意义(P<0.01)。同时,绝经前患高血压者低于绝经后患高血压者,差异有显著性意义(P<0.05),但是绝经前未患高血压者与绝经后患高血压者之间差异无显著性意义(P=1.1)。虽然按绝经前后妇女是否合并高血压分组,产生了有统计学意义的P值,但Pearson相关分析显示,血清APN水平与收缩压、舒张压无直线相关性,绝经期前后妇女是较为特殊的一个群体,这一时期体内多种激素水平发生变化,对血压的影响因素也多种多样,且入选者大多血压控制稳定,相对结果受到影响。本实验结果尚不能说明APN与高血压之间无相关性。针对绝经前后合并高血压与APN水平的分析,需要进一步排除其他影响因素,扩大样本研究。
本研究显示年龄是影响APN水平的独立危险因素。APN与年龄呈正相关,这一结果与国外众多学者研究相一致。Daimon M等[12]研究发现,血清脂联素水平与年龄呈正相关(r=0.312,P<0.001)Jaak和Toivo[8]及Gavrila A等[9]针对绝经期前后妇女APN水平研究中,也证实了年龄与APN水平呈正相关。本研究发现绝经前血浆APN水平低于绝经后APN水平,绝经后高APN水平可能是机体一种自我保护机制,为今后APN临床应用进一步拓宽思路。
Fig是由肝细胞合成和分泌的重要凝血因子。血浆Fig含量、纤维蛋白单体聚合速率以及Fig分子活性增加均可引起血液流变学改变,从而导致动脉粥样硬化及心、脑血管疾病[13,14]。本研究发现绝经前血浆Fig水平低于绝经后,血浆APN与Fig呈正相关。绝经前后合并高血压者血浆APN、Fig水平均低于未患高血压者,无论是APN还是Fig均与SBP、DBP无明显相关性。BMI、HDL-C、LDL-C是影响血清Fig的独立因素,可能与Fig一并参与绝经后妇女代谢性疾病的发生、发展。Fig可作为此类疾病的预测因子。
本文的研究也有很多局限,主要有以下几个方面:(1)样本数量相对少,可能影响结果的判断。(2)未检测雌、孕激素、雄激素水平,未能分析血浆APN及Fig与绝经期前后妇女体内激素水平的相关性。今后将进一步进行该方面的深入研究。
参考文献:
[1] Scherer PE,Williams S,Fogliano M,et al.A novel serum protein similar to C1q, produced exclusively in adipocytes[J].J Biol Chem,1995,270(45):26746-26749.
[2] Nakano Y,Tobe T,ChoMiiura NH,et al. Isolation and characterization of GBP28,a novel gelatin-binding protein purified from human plasma[J].J Biochem,1996,120 (4):803-812.
[3] Yoon YS,Ryu D,Lee MW,et al.Adiponectin and thiazolidinedione targets CRTC2 to regulate hepatic gluconeogenesis[J].Exp Mol Med,2009,4l(8):577-583.
[4] Cai XJ,Chen L,Li L,et al.Adiponectin inhibits lipopolysaccaride-induced adventitial fibroblast migration and transition to myofibroblasts via AdipoRl-AMPK-iNOS pathway[J].Mol Endocrinol,2010,24(1):218-228.
[5] Petridou ET,Mitsiades N, Gialamas S,et al.Circulating adiponectin levels and expression of adiponectin receptors in relation to lung cancer:two case-control studies[J]. Oncology,2007,73(3-4):261-269.
[6] Dos Santos E,Benaitreau D,Dieudonne MN,et al.Adiponectin mediated an antiproliferative response in human MDA-MB 231 breast cancer cells[J]. Oncol Rep,2008,20(4):971-977.
[7] Chu MC,Cosper P, Orio F,et al.Insulin resistance in postmenopausal women with metabolic syndrome and the measurments of adiponectin,leptin, resistin, and ghrelin[J]. Am J Obstet Gynecol,2006,194(1):100-104.
[8] Jaak Jürimäe, Toivo jürimäe.Plasma adiponectin concentration in healthy pre-and post menopausal women:relationship with body composition,bone mineral,and metabolic variables[J].Am J Physiol Endocrinol Metab, 2007,293(1):E42- E47.
[9] Gavrila A,Chan JL,Yiannakouris N,et al. Serum adiponectin levels are inversely associated with overall and central fat distribution but are not directly regulated by acute fasting or leptin administration in humans: cross-sectional and interventional studies[J].J Clin Endocrinol Metab,2003,88(10):4823-4831.
[10] Adamczak M,Wiecek A,Funahashi T,et al.Decreased plasma adiponectin concentration in patients with essential hypertension[J].Am J Hypertens,2003, 16(1):72-75.
[11] Mallamaci F,Zoccali C,Cuzzola F,et al. Adiponectin in essential hypertension[J].J Nephrol,2002,15(5):507-511.
[12] Daimon M,Oizumi T,Saitoh T, et al.Decreased serum levels of adiponectin are a risk factor for the progression to type 2 diabetes in the Japanese Population: the Funagata study[J].Diabetes Care,2003,26(7):2015-2020.
[13] Gao Jie, Zhao Feng-zhen,Zhang Jun-ling,et al.Relationship between Simple Obesity and Fibrinogen,Bβ448 G/A Gene Polymorphism in Children [J].J Appl Clin Pediatr,2008,23(19):1491-1493.
[14] Keller MA, Martinez J,Baradet TC,et al.Fibrinogen Philadelphia, a hypodysfibrinogenemia characterized by abnormal polymerization and fibrinogen hypercatabolism due to gamma S378P mutation [J].Blood,2005,105(8):3162-3168.
