H9N2亚型禽流感病毒在MDCK细胞中增殖最佳条件研究*
2011-05-31史爱华张建伟姜北宇章振华景小冬
史爱华,张建伟,沈 佳,姜北宇,章振华,李 林,景小冬
(北京市农林科学院畜牧兽医研究所,北京 100097)
禽流感病毒(Avian influenza virus,AIV)是严重危害家禽和野禽的一种烈性传染性病原,其中H9N2亚型低致病力禽流感(LPAI)病毒虽致病力较低,但依然是威胁我国养禽业的最重要疫病之一[1]。姜北宇等[2]对禽流感 H9亚型流行毒株进行了交叉保护试验。近几年来H9N2亚型禽流感在免疫鸡群中时有发生[3],严重制约着我国养禽业的发展。叶柱德等[4]对H9N2禽流感疫苗的研究进行了综述。常规的禽流感疫苗生产过程中,鸡胚是禽流感病毒最为常用的一种培养基质,但用鸡胚尿囊液制备抗原过程中禽流感病毒易引起抗原性变异;大规模生产时还存在鸡胚数量不足和潜在外源病毒污染的问题[5]。以哺乳动物细胞为基质制备疫苗具有无外源因子污染、易于规模化生产、可以较好的维持病毒抗原稳定等优点。许多学者[6-10]利用 MDCK细胞制备人流感疫苗做了大量研究,制备的疫苗可产生与鸡胚苗同样的免疫效果。在利用生物反应器进行病毒增殖时,不同病毒株、病毒接种剂量均非常重要,而且无法进行病毒接种后的预吸附过程。本研究通过对不同病毒株、不同接种剂量以及病毒与细胞的吸附处理分别进行筛选和优化,以期获得H9N2亚型禽流感病毒在MDCK细胞中增殖的最佳条件,为将来利用传代细胞系在生物反应器中大规模制备禽流感疫苗提供技术支持。
1 材料与方法
1.1 材料
1.1.1 毒株 禽流感病毒H9N2亚型地方分离毒株:A/Chicken/Hebei/WD/98(H9N2)株 (简 称WD98株),由北京市农林科学院畜牧兽医研究所免疫预防研究室1998年从河北省望都分离;A/Chicken/Henan/QX/04(H9N2)株(简称 HN04株),由河南农业大学王泽霖教授惠赠;A/Chicken/Hebei/ZD/04(H9N2)株(简称ZD04株),由北京市农林科学院畜牧兽医研究所免疫预防研究室2004年从河北省正定分离。
1.1.2 细胞 MDCK细胞购自中国兽医药品监察所,在北京市农林科学院畜牧兽医研究所免疫预防研究室传代培养至77代。
1.1.3 细胞培养液 生长液为含100mL/L胎牛血清和100单位/mL青霉素-链霉素的DMEM;维持液为含10μg/mL胰蛋白酶的DMEM。
1.1.4 鸡红细胞悬液 10mL/L鸡红细胞悬液由北京市农林科学院畜牧兽医研究所免疫预防研究室采集成年公鸡血液制备。
1.1.5 主要试剂 DMEM培养基为 HyClone公司产品;胰酶为DIFCO公司产品;胎牛血清为GIB-CO公司产品;细胞培养瓶、培养板为COSTAR公司产品。
1.2 方法
1.2.1 MDCK细胞复苏及传代 自液氮中取出冻存的MDCK细胞,37℃温水速溶,3 000r/min离心3min,弃上清,用含100mL/L胎牛血清的DMEM悬浮细胞团块,加入T25培养瓶中,置37℃、体积分数为5%CO2温箱培养。经48h~72h后MDCK细胞长成单层,弃上清用1mL EDTA-胰蛋白酶清洗细胞表面,然后加入0.5mL胰蛋白酶37℃消化2 min~5min,吹打分散细胞,分装于细胞培养板或瓶中传代,置37℃、体积分数为5% 的CO2温箱培养。1.2.2 病毒稀释 取无菌试管5支,每支加入4.5 mL DMEM,第1管加入0.5mL病毒原液混匀,吸取0.5mL稀释的病毒液加入到第2管混匀,再吸取0.5mL稀释的病毒液加入到第3管,以此类推至第5管。各试管中病毒液稀释倍数分别为101、102、103、104、105。
1.2.3 病毒吸附试验 取长成单层MDCK细胞的12孔细胞培养板,弃去生长液,用DMEM冲洗一次,逐孔加入不同稀释度的病毒悬液,每个稀释度接种3孔,每孔接种0.2mL。非吸附组接种病毒后每孔立即加入1.8mL含有10μg/mL胰蛋白酶的DMEM维持液;吸附组接种病毒后置37℃温箱吸附1h,然后每孔加入1.8mL含有10μg/mL胰蛋白酶的维持液。将两组培养板置37℃、体积分数为5%CO2细胞培养箱中培养。每隔24h测定细胞上清液中病毒HA滴度,直至细胞脱落。
1.2.4 红细胞凝集试验 分别取病毒接种细胞后24、48、72、96、96h后收获细胞并冻融1次的细胞培养上清液,采用常规方法进行红细胞凝集试验,即在96孔V型板中加入50μL生理盐水,与50μL待检细胞培养上清混匀后进行倍比稀释,并设阳性、阴性和空白对照孔。每孔中加入50μL 10mL/L鸡红细胞悬液,混匀后静置室温15min~20min,观察记录结果。测定结果取以log2为底的倍数。
2 结果
2.1HN04株接种MDCK单层后培养液上清的HA滴度
病毒不论吸附与否,感染后24h病毒滴度均为0,48h后病毒滴度显著升高,72h达到高峰;病毒稀释倍数为103和104时病毒滴度较高。细胞冻融后病毒滴度较冻融前明显升高(表1)。
2.2 WD株接种MDCK单层后培养液上清的HA滴度
WD株在接种后96h的HA滴度达到最高为5.3log2,病毒液经103稀释后吸附组与未吸附组的病毒滴度无显著差异,而104稀释接种后吸附组较未吸附组的病毒滴度稍高(表2)。
2.3 ZD04株接种 MDCK单层后培养液上清的HA滴度
ZD04株接种MDCK细胞后病毒滴度测定结果较其他2株明显较低,最高HA滴度为4log2,提示不同分离株在MDCK细胞中的增值能力存在差异。吸附组与非吸附组的病毒滴度无显著差异。冻融前后HA滴度也未出现显著差异。

表1 H9N2禽流感病毒HN04株接种MDCK后培养液上清的HA滴度(log2)Table 1 HA titer of the supernatant of MDCK cells with inoculation of H9N2avian influenza virus isolate HN04
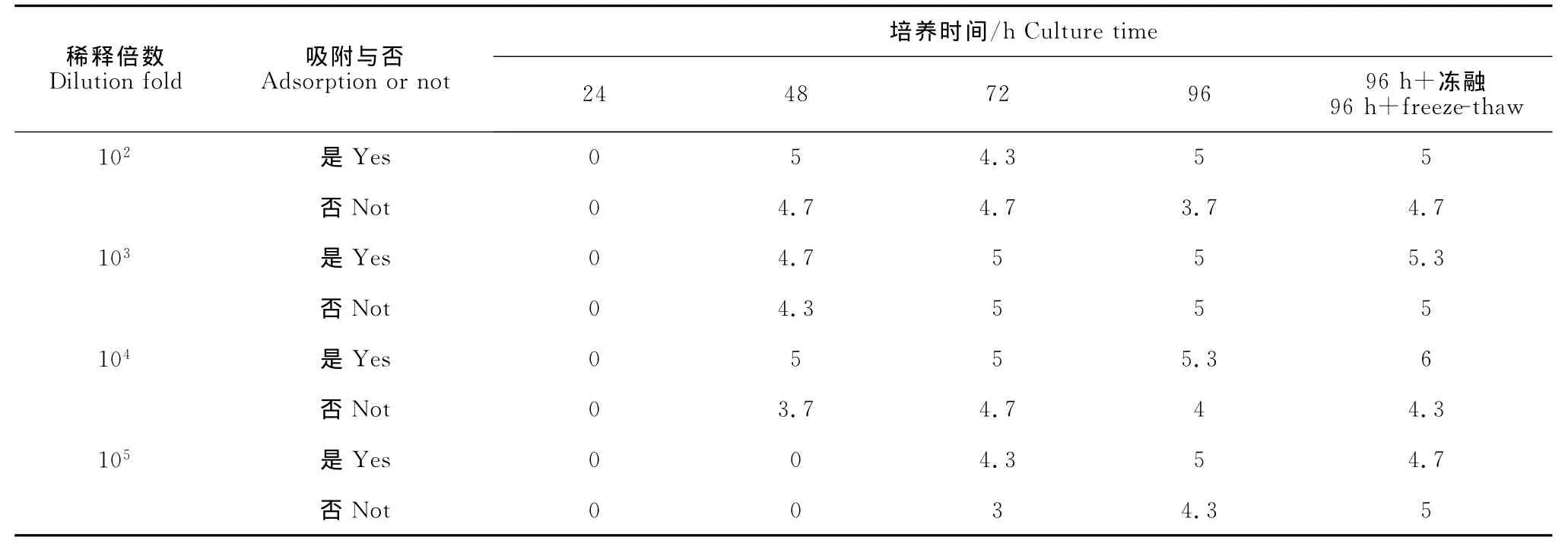
表2 WD株接种MDCK后培养液上清的HA滴度((log2)Table 2 HA titer of the supernatant of MDCK cells with inoculation of H9N2avian influenza virus isolate WD

表3 ZD04株接种MDCK后培养液上清的HA滴度((log2)Table 3 HA titer of the supernatant of MDCK cells with inoculation of H9N2avian influenza virus isolate ZD04
3 讨论
H9N2亚型禽流感病毒的最佳接种浓度,试验中选用了3个低致病力的H9N2亚型禽流感病毒株,均以103~104倍稀释的病毒液接种滴度最高,这种结果与鸡胚培养病毒的接种后的病毒滴度类似,毒力较强的ZD04株经过冻融后病毒培养液HA滴度较低为3log2~4log2(1∶8~1∶16),毒力较弱的HN04和WD株的HA滴度为4.3log2~6log2(1∶19.7~1∶64),这可能与病毒的毒力强致使细胞受到损害较快,而不能增殖病毒有关。李春艳等[11]在利用微载体规模化培养 MDCK细胞增殖H9N2亚型禽流感病毒的研究中,接毒剂量为MOI=0.025,培养液pH7.4时,H9N2亚型禽流感病毒HA滴度可达到9log2(1∶512),我们认为这与利用微载体培养时细胞密度较高从而使得病毒浓度较高有关,高密度培养可以大大提高病毒的滴度。
吸附与否对HA影响,刘丽玲等[12]在进行禽流感病毒接种时进行吸附,吸附时间为1h,H9N2亚型病毒的滴度为7log2,杨琴等[13]利用鸡胚成纤维细胞、VERO细胞和MDCK细胞对禽流感病毒进行了增殖研究,结果显示病毒接种后吸附90min的HA滴度最高,可达到9log2。赵斌秀等[14]研究MDCK细胞接种流感病毒并吸附2h,维持液中含有10μg/mL胰蛋白酶时,上清的HA滴度可达到7 log2。本试验结果为3株H9N2亚型病毒株病毒液上清HA最高滴度为6log2,病毒滴度稍低,可能是接种的病毒毒株差异或者是培养条件差异造成。为了将来在生物反应器中更为方便的接种,本研究进行了不吸附试验,通过试验证明通过接种前对细胞单层进行洗涤后,再接种流感病毒,不进行吸附与进行吸附都可以使HA达到较高的滴度,二者没有显著区别。
HA滴度出现的时间,将稀释的病毒接种长成单层的MDCK细胞,不经吸附,加入含有不同胰蛋白酶浓度的MDCK作为维持液,测定接种病毒后不同时间培养液上清中的HA滴度,在72h达到最高值;戚凤春等[15]报道流感病毒接种 MDCK细胞后HA峰值时间为60h~72h,刘丽玲等[12]报道,将鸡胚毒H9N2病毒接种MDCK细胞,吸附1h,维持液胰蛋白酶含量为1‰,72hHA 滴度达到峰值7 log2,以后随着时间的延长而略有下降,病毒滴度下降可能是病毒致使细胞病变脱落后病毒不能增殖造成。造成HA滴度出现不同的原因可能有以下几个方面,一是选用的毒株不同,不同毒株对MDCK细胞的致病作用不同;二是本研究采用了MDCK适应2代后的流感病毒,而刘丽玲等使用的是鸡胚毒。
综上所述,低致病力禽流感病毒可以在MDCK细胞上大量增殖,病毒的最佳接种浓度为103~104倍稀释病毒。细胞单层经过清洗后,接种病毒吸附与不吸附均可以产生良好病变和HA滴度。病毒的最佳收获时间为72h~96h。
[1]毕英佐.H9N2亚型禽流感的流行现状和防制措施[J].中国家禽,2009,31(11):33-34.
[2]姜北宇 章振华 李 林,等.禽流感H9亚型流行毒株交叉免疫保护试验[J].动物医学进展,2009,30(8):29-33.
[3]周 蛟.世界主要禽病流行现状[J].中国家禽,2007,29(4):1-4.
[4]叶柱德,胡江锋.H9N2亚型禽流感病毒疫苗研究进展[J].动物医学进展,2008,29(2):89-92.
[5]Kistner O,Barrett P N,Mundt W,el al.Development of a mammalian cell(Vero)derived candidate influenza virus vaccine[J].Vaccine,1998,16(9-10):960-968.
[6]Makizumi K,Kimachi K,Fukada K,et al.Timely production of A/Fujian-like influenza vaccine matching the 2003-2004epidemic strain may have been possible using Madin-Darby canine kidney cells[J].Vaccine,2008,26:6852-6858.
[7]Lohr V,Genzel Y,Behrendt I,et al.A new MDCK suspension line cultivated in a fully defined medium in stirred-tank and wave bioreactor[J].Vaccine,2010,28:62560-6264.
[8]Youil R,Su Q,Toner T J,et al.Comparative study of influenza virus replication in Vero and MDCK cell lines[J].J Virol Meth,2004,120(1):23-31.
[9]Halperin S.A,Smith B,Mabrouk T,et al.Safety and immunogenicity of a trivalent,inactivated,mammalian cell culture derived influenza vaccine in healthy adults,seniors,and children[J].Vaccine,2002,20(7-8):1240-1247.
[10]Liu J,Shi X,Schwartz R,et al.Use of MDCK cells for production of live attenuated influenza vaccine[J].Vaccine,2009(27):6460-6463.
[11]李春艳,肖 晶,李 曦,等.微载体规模化培养 MDCK细胞增殖H9N2亚型禽流感病毒的研究[J].中国人兽共患病学报,2009,25(12):11491153.
[12]刘丽玲,王秀荣,陈化兰,等.不同亚型禽流感病毒在MDCK细胞上的生长特性[J].中国兽医杂志,2006,42(10):18-20.
[13]杨 琴,张兴晓,杨灵芝.3种细胞培养流感病毒的比较[J].动物医学进展,2009,30(11):76-79.
[14]赵斌秀 李 炎 何维英,等.流感病毒对两种细胞敏感性的比较[J].中国消毒学杂志,2008,25(5):463-465.
[15]戚凤春,汪春义,张雪梅,等.两种细胞培养流感病毒的滴度比较[J].中国生物制品学杂志,2006,19(3):291-292,318.
