小鼠骨髓抑制模型的建立
2011-05-31许晶晶刘奂弟朱依纯
许晶晶,刘奂弟,朱依纯
(1.郑州大学第一附属医院病理科,河南郑州 450052;2.复旦大学上海医学院生理与病理生理学系,上海 200032)
骨髓抑制是临床上常见的造血系统疾病,它的诱发因素很多,包括各系统肿瘤性疾病的放射治疗或化学治疗;电离辐射引起的放射损伤;病毒性肝炎、艾滋病病毒[1-3]等感染因素;药物[4](如氯霉素、苯、磺胺、抗癫痫药、镇静剂、抗甲状腺药、抗糖尿病药、抗疟疾、安眠药等等)。骨髓抑制可引起骨髓微环境、造血干细胞、造血细胞生长因子等的损伤,骨髓抑制引起的粒细胞缺乏会导致严重感染,红细胞明显减少会引起严重贫血,血小板明显下降可以导致严重出血,甚至导致死亡[3-4]。建立骨髓抑制动物模型对临床病人骨髓抑制的病理情况进行模拟,既而研究促进动物模型中骨髓抑制恢复的药物的作用和影响,这一系列都对临床治疗骨髓抑制起着重大的指导作用,有现实的应用意义。
1 材料与方法
1.1主要仪器及试剂仪器:GK06-100 6MV直线加速器;symmex KX-21全自动血液分析系统;精密电子天平;TS-1型脱色摇床;微量移液器;DHG系列电热恒温鼓风干燥箱;pH测量仪;倒置相差显微镜。
试剂:卡铂注射液购自齐鲁制药有限公司;EDTA-2Na,肝素钠注射液,水合氯醛,伊红,氨水,无水乙醇,二甲苯,石炭酸,低熔点石蜡,多聚甲醛均由校试剂科提供。
1.2动物模型的建立8~10周的♀ BALB/c小鼠,购自上海西普尔-斯必凯动物中心。体质量约20~22 g。每只小鼠腹腔注射1 mg的卡铂注射液后立即行6 MV直线加速器照射,照射剂量为每只2 Gy,从而产生骨髓抑制。灭菌饮食喂养4周。
1.3观察的指标及检测方法
1.3.1血常规检测分别于 d 2、d 7、d 14、d 21、d 28 从每个实验组取出相应数量的小鼠,麻醉后摘除眼球采集外周血,用sysmex KX-21全自动血液分析系统对小鼠外周血进行血细胞、血红蛋白及血小板计数。
1.3.2骨髓涂片分别于 d 2、d 7、d 14、d 21、d 28 从每个实验组取出相应数量的小鼠,麻醉后取下肢股骨。利用针管将骨髓吹出骨管,由于骨髓液的纤维蛋白原含量较高,易于凝固,快速推片并迅速使之干燥。然后行HE染色,光镜下观察。
1.3.3HE染色
1.3.3.1脱蜡 二甲苯Ⅰ5 min,二甲苯Ⅱ5 min,体积分数为0.95的乙醇Ⅰ 4 min,体积分数为0.95乙醇Ⅱ 2 min,自来水洗片刻,蒸馏水洗片刻。
1.3.3.2染色 苏木精浸染3 min,自来水冲洗片刻,体积分数为0.01的盐酸乙醇分色3~5 s,自来水冲洗数分钟,体积分数为0.5的氨水返蓝1~2 min,自来水冲洗10 min,体积分数为0.5的伊红乙醇浸染2 min。
1.3.3.3脱水 体积分数为0.95的乙醇Ⅰ 2 min,体积分数为0.95的乙醇Ⅱ2 min,无水乙醇Ⅰ2 min,Ⅱ2 min。
1.3.3.4透明 二甲苯 -石炭酸混合液2 min,二甲苯Ⅰ 2 min,二甲苯Ⅱ2 min,二甲苯Ⅲ2 min。
1.3.3.5中性树胶封固。
1.3.3.6显微镜观察组织病理改变。
1.4统计学方法用SPSS 17.0软件分析数据,实验数据用±s表示。两组间比较采用t检验。
2 结果
2.1骨髓细胞悬液颜色的改变放化疗结合抑制骨髓后2 d和7 d,骨髓抑制组动物的体重明显减轻,精神萎靡,毛色失去光泽,骨质脆性增加,骨髓窦出血严重,骨髓细胞悬液呈较为明显的红色,与未进行骨髓抑制的动物相比有明显差异(Fig 1)。
2.2观察动物骨髓涂片放化疗结合抑制骨髓7 d后,骨髓抑制组动物的骨髓涂片,与未行骨髓抑制操作的动物相比有明显差异(Fig 2),未行卡铂和放疗的动物骨髓涂片增生活跃,各系细胞比例正常(A)。行放化疗结合抑制骨髓的动物,骨髓涂片显示骨髓破坏严重,骨髓实质细胞大量减少(B)。
2.3外周血血细胞计数的变化给予卡铂和放疗联合处理后,发现动物有潜在出血倾向,外周血各系细胞下降明显(Fig 3),红细胞计数(A)、血红蛋白含量(B)、血小板计数(D)均在卡铂和放疗联合处理后14 d达到最低点,此后慢慢恢复,处理后28 d可基本恢复至正常水平。相比红细胞计数和血红蛋白含量,血小板计数恢复较为缓慢。外周血白细胞计数(C)在卡铂和放疗联合处理后7 d达到最低点,此后慢慢恢复,至处理后28 d可基本恢复到正常水平。
3 讨论
骨髓抑制的发生在临床具有广泛性和危害性,建立骨髓抑制动物模型、对临床病人骨髓抑制的病理情况进行模拟、既而研究促进动物模型中骨髓抑制恢复的药物作用和影响,这一系列都对临床治疗骨髓抑制起着重大的指导作用,有现实的应用意义。
目前建立骨髓抑制模型多采用放疗[5]和(或)化疗[6-8]诱导,由于化疗和辐射所导致的骨髓抑制机制的不同[9],对各系血细胞的损伤程度亦不相同。用射线复制的骨髓抑制模型,实验动物多表现为体重下降,解剖发现各个脏器苍白,胸腺、脾脏、淋巴结萎缩,脾指数下降,红细胞、白细胞、血小板及骨髓中粒系、红系、巨核系、混合系造血祖细胞的数量均有所下降,CD34阳性细胞在骨髓有核细胞中比例下降,非造血细胞增多[10-12]。但是通过射线辐射复制的骨髓模型,其剂量难以控制,过小达不到损伤的要求,偏大又会导致动物的死亡。单独采用化疗药物造模常常需要花费较长一段时间才能造模成功[13],并且由于不同药物对各系血细胞的损伤程度不同,会造成某系的血细胞抑制而对其他系影响较小。且很多化疗药物使用后,机体会有一定的报复性反弹趋势,可能对观察药物的作用造成影响,故本实验采用复合造模法。
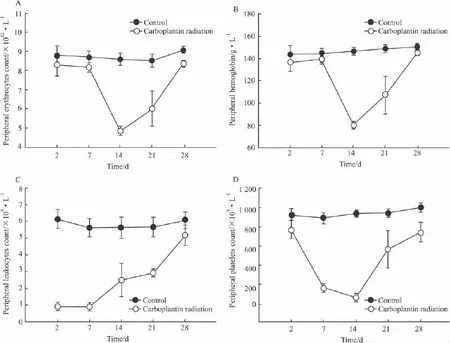
Fig 3 Peripheral blood counts
我们观察到放化疗结合抑制骨髓后2 d和7 d,骨髓抑制组动物的体重明显减轻,精神萎靡,毛色失去光泽,骨质脆性增加,骨髓窦出血严重,骨髓细胞悬液呈较为明显的红色,与未进行骨髓抑制的动物相比有差异。骨髓抑制组动物的骨髓涂片显示骨髓荒芜一片,破坏严重,骨髓实质细胞大量减少。给予卡铂和放疗联合处理后,发现动物有潜在出血倾向,外周血各系细胞下降明显,红细胞计数、血红蛋白含量、血小板计数均在卡铂和放疗联合处理后14d达到最低点,此后慢慢恢复,处理后28 d可基本恢复至正常水平。相比红细胞计数和血红蛋白含量,血小板计数恢复较为缓慢。外周血白细胞计数在卡铂和放疗联合处理后7 d达到最低点,此后慢慢恢复,至处理后28 d可基本恢复到正常水平。实验结果表明我们成功的用放化疗结合的方法建立了骨髓抑制动物模型。且此动物模型具有操作简单、骨髓抑制持续时间较长、死亡率较低的优势。
[1]Jaresko G S.Etiology of neutropenia in HIV-infected patients[J].Am J Health Syst Pharm,1999,15:(56 Suppl 5):S5 -8.
[2]Randolph-Habecker J,Iwata M,Torok-Storb B.Cytomegalovirus mediated myelosuppression[J].J Clin Virol,2002,25(Suppl 2):S51-6.
[3]杨天楹.关于骨髓造血功能衰竭[J].中国危重病急救医学,1996,8:34-5.
[3]Yang T Y .Bone marrow failure[J].Chin Critical Care Med,1996,8:34 -5.
[4]Carey P J.Drug-induced myelosuppression:diagnosis and management[J].Drug Saf,2003,26:691 - 706.
[5]Wagemaker G,Neelis K J,Hartong S C,et al.The efficacy of recombinant thrombopoietin in murine and nonhuman primate models for radiation-induced myelosuppression and stem cell transplantation[J].Stem Cells,1998,16:375 -86.
[6]Meng A,Wang Y,Brown S A,et al.Lonizing radiation and busulfan inhibit murine bone marrow cell hematopoietic function via apoptosis-dependent and-independent mechanisms[J].Exp Hematol,2003,31:1348 -56.
[7]Hassan Z,Nilsson C,Hassan M.Liposomal busulphan:bioavailability and effect on bone marrow in mice[J].Bone Marrow Transplant,1998,22:913 -8.
[8]李富荣,郭跃华,周汉新,齐 晖.卡铂碳包铁纳米笼壳聚糖微球在大鼠体内的分布和药代动力学研究[J].中国药理学通报,2009,25(6):809 -13.
[8]Li F R,Guo Y H,Zhou H X,Qi H.Studies on pharmacokinetics and tissue distribution of C-Fe@C-CN in rat[J].Chin Pharmacol Bull,2009,25(6):809 -13.
[9]Mac Manus M,Lamborn K,Khan W,et al.Radiotherapy-associated neutropenia and thrombocytopenia:analysis of risk factors and development of a predictive model[J].Blood,1997,89:2303 -10.
[10]姚 军,李树浓.淋巴细胞与再生障碍性贫血关系的实验研究[J].中华血液学杂志,1991,12:229 -31.
[10]Yao J,Li S N.Experimental study of relationship between lymphocyte and aplastic anemia[J].Chin J Hematol,1991,12:229 -31.
[11]梁 毅,方碧琴,鲁新华.血虚症小鼠模型骨髓细胞红系祖细胞、粒单系祖细胞变化规律及中药复方对其的影响[J].湖北中医学院学报,2001,3:13 -5.
[11]Liang Y,Fang B Q,Lu X H.The changing regularities of blood-deficiency syndrome on hematopoietic stem cells(CFU-E、BFU-E、CFU-GM)and the effects of Chinese herbal compound formulas on them in mice[J].J Hubei Coll TCM,2001,3:13 - 5.
[12]马增春,高 月,刘永学.四味汤对射线照射致血虚证小鼠造血细胞作用的研究[J].中国实验方剂学杂志,2001,7:41-4.
[12]Ma Z C,Gao Y,Liu Y X.The Effects of Si-Wu-Tang on hemapoietic cells of blood deficient mice induced by radiation[J].Chin J Exp Tradit Med Formul,2001,7:41 -4.
[13]Morley A,Blake J.An animal model of chronic aplastic marrow failure.I.Late marrow failure after busulfan[J].Blood,1974,44:49-56
