补阳还五汤提高血管性痴呆大鼠海马CREB、C/EBP的DNA结合活性
2011-05-31张泓波高维娟唐敬龙
张泓波,高维娟,钱 涛,唐敬龙,李 君
(1.承德医学院病理生理学教研室,河北 承德 067000;2.河北化工医药职业技术学院,河北 石家庄 050026;3.河北省人民医院,河北石家庄 050051)
血管性痴呆(vascular dementia,VD)是由于各种脑血管病引起的获得性认知功能障碍,以学习、记忆功能缺损为主要症状。目前,VD的发病呈迅速增长趋势,其发病机制尚未明确。从中医角度来看,VD的病机为气虚血瘀。补阳还五汤是益气活血中药的经典方剂,目前在临床上主要治疗气虚血淤所致的中风[1]。学习和记忆是脑的高级功能之一,其中枢位于海马。核转录因子环磷酸腺苷反应元件结合蛋白(cAMP response element-binding protein,CREB)是学习和记忆形成的关键调节因子[2],磷酸化后的CREB可增强多种靶基因如即早基因(immediate-early genes,IEGs)的表达,从而使获得的信息得以长期储存。CCAAT/增强子结合蛋白(CCAAT/enhancer binding proteins,C/EBP)是一类与DNA增强子区域结合的转录调控因子,是IEGs的产物,在新记忆的永久化过程中具有促进作用[3]。本研究通过观察补阳还五汤对VD大鼠海马组织CREB、C/EBP DNA结合活性的影响,探讨血管性痴呆的发病机制,为临床防治VD提供理论依据。
1 材料与方法
1.1材料
1.1.1动物健康成年SPF级SD♂大鼠96只,鼠龄5~6个月,体质量(200±20)g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2007-0001。购买后,饲养于自然光线下,保持温度20~25℃,自由进食进水,适应性饲养1周。
1.1.2药物补阳还五汤购自承德北京同仁堂药店分店:补阳还五汤原方(黄芪120 g,当归尾6 g,赤芍 4.5 g,川芎3 g,桃仁3 g,红花3 g,地龙3 g)水煎2次,煎液合并浓缩后使药液浓度为含生药6 250 g·L-1。尼莫地平为天津华津制药厂生产(批号:080317),溶于双蒸水制成2.5 g·L-1的混悬液。高压灭菌,置4℃冰箱保存备用,用前混匀。
1.1.3主要试剂和仪器CREB及C/EBP寡聚核苷酸探针由上海英俊生物工程有限公司合成;核蛋白抽提试剂盒由美国Pierce公司提供;EMSA试剂盒购自德国Roche公司;带正电荷的尼龙膜为美国Pall公司产品;戊巴比妥钠购自德国。
Morris水迷宫(LW-Ⅱ型)由中国医学科学院药物所提供;DYY-6B型稳压稳流电泳仪和24A型垂直板电泳装置均由北京六一仪器厂生产;Quantity one凝胶分析系统由美国BIO-RAD公司提供。
1.2方法
1.2.1动物分组与造模用水迷宫将大鼠进行定位航行实验和空间探索实验,筛选出空间学习和记忆水平相当的大鼠,按体质量差异随机数字表法分为假手术组(Sham operation)、模型组(VD model)、补阳还五汤组(BYHWT treatment)和尼莫地平组(Nimodipine treatment),每组24只。
VD模型组、补阳还五汤组、尼莫地平组采用改良的Pulsinelli's四血管阻断(four-vessel occlusion,4-VO)方法[4]制备VD大鼠模型:用戊巴比妥钠(50 mg·kg-1)行腹腔麻醉。将大鼠行背侧颈正中切口,逐层钝性分离暴露双侧第一颈椎横突翼小孔,用直径0.5 mm的电凝针烧灼双侧翼小孔内的椎动脉,造成永久性闭塞。24 h后再将大鼠麻醉,行腹侧颈正中切口,钝性分离双侧颈总动脉,用微动脉夹夹闭双侧颈总动脉5 min,共3次,每次间隔1 h。假手术组:只做皮肤切口和组织分离处理,不进行椎动脉烧灼和颈总动脉夹闭。
1.2.2给药方法各组大鼠术后当天清醒开始灌胃给药。补阳还五汤组:给予补阳还五汤50 g·kg-1·d-1;尼莫地平组:给予尼莫地平 20 mg·kg-1·d-1;模型组和假手术组均给予生理盐水8 ml·kg-1·d-1。各组连续给药 30 d。
1.2.3水迷宫检测学习记忆能力各组给药d 25~30,对大鼠进行水迷宫试验。去除手术死亡及给药不耐受者,每组大鼠各22只为最终统计对象。以给药d 29大鼠逃避潜伏期(将大鼠从入水点面向池壁置入水槽中,记录90 s内大鼠从入水到爬上平台所需的时间)的平均成绩作为学习成绩;给药d 30大鼠空间探索次数(撤去平台,将大鼠从第二象限入水点放入水槽,记录60 s内其经过平台象限的次数)的平均成绩作为记忆成绩。逃避潜伏期越短、跨越台次数越多,学习记忆能力越强。
1.2.4电泳迁移率改变分析法(electrophoretic mobility shift assay,EMSA)测定CREB、C/EBP的DNA结合活性水迷宫试验后将各组大鼠迅速断头处死,在低温修块台上分离出双侧海马组织。称重剪碎,匀浆弃上清。按核蛋白提取试剂盒提供的操作规程提取核蛋白。用BCA法进行蛋白定量后-80℃保存。设计 CREB DNA结合序列 :5'-AGAGATTGCCTGACGTCAGAGAGAGCTAG-3';C/EBP DNA结合序列5'-GATCAAGCTGCAGATTGCGCAAT-3'。探针标记参照DIG Gel Shift Kit操作手册进行。标记反应结束后调整探针浓度为15.5 pmol·L-1。取各样本核蛋白4 μg与标记的寡核苷酸探针2 μl 25℃孵育15min。采用6%非变性聚丙烯酰凝胶4℃ 80V电泳分离DNA-核蛋白结合体。电泳完毕将DNA-核蛋白结合体转移到带正电荷的尼龙膜,化学发光法检测特异性条带。经曝光、显影和定影后将图像扫描至电脑,用Quantity one 4.4凝胶分析软件对特异结合条带净灰度值进行采集。净灰度值代表转录因子与特定DNA的结合强度和活性。
1.3统计学处理实验数据以±s表示,采用SPSS11.5统计软件进行单因素方差分析。组间比较采用多样本均数的One-way ANOVA检验。两组均数比较采用q检验。
2 结果
2.1补阳还五汤对VD大鼠学习记忆能力的影响与假手术组术比较,模型组逃逸潜伏期明显延长(P<0.05),跨越平台次数明显减少(P<0.05);与模型组相比,补阳还五汤组和尼莫地平组逃避潜伏期均明显缩短(P<0.05);跨越平台次数均明显增多(P<0.05)。补阳还五汤组和尼莫地平组之间差异无显著性(P>0.05),见Tab 1。
Tab 1 Comparision of rats'learning and memorizing ability in morris water maze test among four groups(±s,n=22)
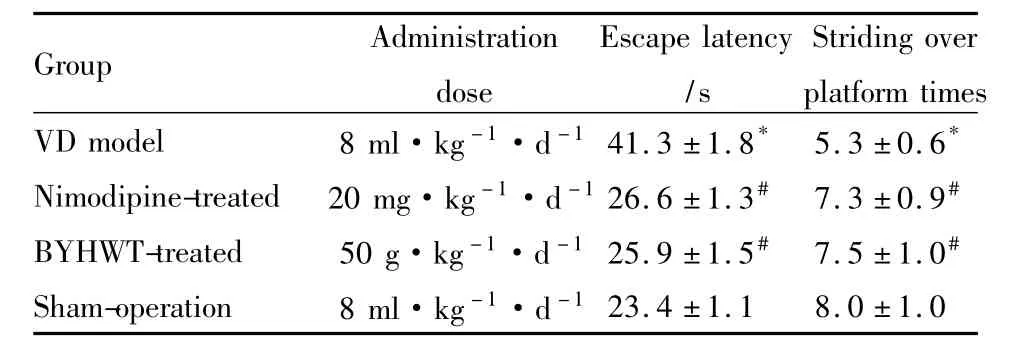
Tab 1 Comparision of rats'learning and memorizing ability in morris water maze test among four groups(±s,n=22)
*P<0.05 vs sham-operation group;#P<0.05 vs VD model group.
*Nimodipine-treated 20 mg·kg-1·d-126.6 ±1.3# 7.3 ±0.9#BYHWT-treated 50 g·kg-1·d-125.9 ±1.5# 7.5 ±1.0#Sham-operation 8 ml·kg-1·d -123.4 ±1.1 8.0 ±1.0
2.2补阳还五汤对VD大鼠海马组织CREB DNA结合活性的影响经EMSA检测和对特异性寡核苷酸与核蛋白的结合条带的密度扫描和分析发现,各组大鼠海马组织核提取物均有与预先设计的CREB DNA序列的结合:与假手术组比较,模型组大鼠海马组织CREB的DNA结合活性明显降低(P<0.01);与模型组比较,尼莫地平组与补阳还五汤组大鼠海马组织CREB结合活性明显升高(P<0.01);尼莫地平组、补阳还五汤组大鼠海马组织CREB的结合活性之间差异无显著性(P>0.05),见Fig 1。
2.3补阳还五汤对VD大鼠海马组织C/EBP DNA结合活性的影响经EMSA检测和对特异性寡核苷酸与核蛋白的结合条带的密度扫描和分析发现,各组大鼠海马组织核提取物均有与预先设计的C/EBP DNA序列的结合:与假手术组比较,模型组大鼠海马组织C/EBP的DNA结合活性明显降低(P<0.01);与模型组比较,尼莫地平组与补阳还五汤组大鼠海马组织C/EBP结合活性明显升高(P<0.01);尼莫地平组、补阳还五汤组大鼠海马组织CREB的结合活性之间差异无显著性(P>0.05),见Fig 2。
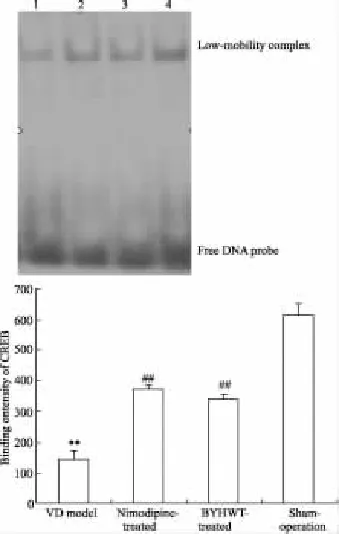
Fig 1 Comparision of CREB DNA-binding activity in rat's hippocampus among four groups(±s,n=8)
3 讨论
VD为一慢性进行性疾病,反复缺血/再灌注和长期慢性低灌流是发病机制之一。本实验制备模型所采用的改良的Pulsinelli's四血管阻断法(4-VO),能较好得模拟人类因动脉粥样硬化等血管疾病所致的VD而无明显的肢体活动障碍,是国际公认的制备血管性痴呆模型的方法之一[5]。补阳还五汤方重用生黄芪,大补脾胃之元气,令气旺血行,瘀去络通;当归尾长于活血,有化瘀而不伤好血之妙;川芎、赤芍、桃仁、红花助当归尾活血祛瘀,地龙可通经活络。有研究发现补阳还五汤具有降低兴奋性氨基酸毒性、抑制细胞凋亡、促进神经细胞损伤的恢复、抑制自由基的产生及抗脂质过氧化、抑制细胞内钙超载等对抗脑缺血/再灌注损伤作用[6]。本研究应用补阳还五汤治疗后VD大鼠学习和记忆能力明显提高,其作用机制有待深入研究。

Fig 2 Comparision of C/EBP DNA-binding activity in rat's hippocampus among four groups(±s,n=8)
长期记忆形成不但需要新蛋白质的合成,而且需要新基因的转录。Han等[7]确定影响记忆存储的关键蛋白为CREB,可调节长时程增强(long term potentiation,LTP)和突触可塑性相关的基因转录。本研究发现,海马CREB的DNA结合活性与VD大鼠认知功能下降的程度呈正相关,表明CREB可能在VD大鼠学习记忆损害中发挥了作用。VD大鼠经补阳还五汤治疗后CREB的DNA结合活性及学习和记忆能力明显增强,其机制可能为补阳还五汤通过提高CREB的活性,在缺血性损伤后提供神经保护信号[8]。CREB对神经元的存活、分化、再生和修复起重要作用,如CREB磷酸化后不仅可调节即早基因如c-fos、c-jun等的表达,而且还调节抗凋亡和保护性蛋白分子(Bcl-2、降钙素基因相关肽等)及神经营养因子(神经生长因子、脑源性神经营养因子等)的表达[9-10],从而实现对缺血性痴呆可塑性和学习记忆的保护。
C/EBP是CREB靶基因的产物,可进一步的激活晚期效应基因的表达,编码长期调节突触功能所必须的蛋白质,是记忆形成后的巩固过程的重要因素[3]。在长时程记忆过程中,Ca2+和环磷酸腺苷(cAMP)依赖的信号转导诱发了海马神经元C/EBP的表达和DNA结合活性[11]。本研究发现VD大鼠海马CREB及C/EBP结合活性的下降呈一致性,提示CREB介导的基因转录的抑制参与了血管性痴呆的形成。补阳还五汤改善VD大鼠学习和记忆功能的障碍可能是通过增强CREB介导的基因转录实现的。
在短暂大脑缺血/再灌注的早期,C/EBPβ促进了大脑的免疫损伤反应和神经元凋亡[12],其机制与诱导早期生长反应基因-1(Egr-1)及其下游基因纤溶酶原激活物抑制剂(PAI-1)血管内皮生长因子(VEGF)、细胞间黏附分子-1(ICAM-1)、白介素-1(IL-1)等有关[12-13]。最近研究发现 C/EBP 同源蛋白(CHOP)还参与了缺血后海马神经元的内质网应激依赖性的细胞凋亡[14]。但是对于慢性脑缺血过程中C/EBP的作用研究比较少。本研究发现在缺血/再灌注损伤30 d后,模型组大鼠的C/EBP活性相对于假手术组下降,补阳还五汤治疗后C/EBP活性较模型组升高,机制可能为CREB活性的增强促进了C/EBP的表达,从而加强了后者的活性。对于脑缺血/再灌注后期C/EBP介导的基因转录其效应分子为何以及它们在血管性痴呆中发挥怎样的作用还需进一步探讨。有人认为,脑卒中后早期的基因调节参与了神经细胞的存活和死亡,后期调节的基因可能与组织修复和功能恢复有关[12]。
[1]陈磐华,吴永杰,秦俊法.加味补阳还五汤治疗血管性痴呆临床研究[J].中国中医药信息杂志,2007,14(7):25 -6.
[1]Chen P H,Wu Y J,Qin J F.Clinical study of modified Buyanghuanwu Decoction in the treatment of vascular dementia[J].Chin J Inform Tradit Chin Med,2007,14(7):25 -6.
[2]Leutgeb J K,Frey J U,Behnisch T.Single cell analysis of activity-dependent cyclic AMP-responsive element-binding protein phosphorylation during long-lasting long-term potentiation in area CA1 of mature rat hippocampal-organotypic cultures[J].Neuroscience,2005,131(3):601 -10.
[3]Osada S,Yamamoto H,Nishihara T,Imagawa M.DNA binding specicity of the CCAAT/enhancer-binding protein transcription factor family[J].Biol Chem,1996,271(12):3891 -6.
[4]Schmidt-Kastner R,Paschen W,Ophoff B G,Hossmann K A.A modified four-vessel occlusion model for inducing in complete forebrain ischemia in rats[J].Stroke,1989,20(7):938 -46.
[5]赵 勇,崔淑芳,汤 球.血管性痴呆动物模型研究进展[J].上海实验动物科学,2005,25(1):54 -8.
[5]Zhao Y,Cui S F,Tang Q.Recent research progress in animal models of vascular dementia[J].Shanghai Lab Animal Sci,2005,25(1):54-8.
[6]徐 晶,辛随成,张青川.补阳还五汤治疗缺血性脑血管病的研究进展[J].山西中医学院学报,2009,10(4):73 -6.
[6]Xu J,Xin S C,Zhang Q C.The research progression of buyanghuanwutang on ischemic cerebrovascular disease[J].J Shanxi Coll Tradit Chin Med,2009,10(4):73 -6.
[7]Han J H,Kushner S A,Yiu A P,et al.Neuronal competition and selection during memory formation[J].Science,2007,316(5823):457-60.
[8]光红梅,杜冠华.cAMP反应元件结合蛋白与神经退行性疾病[J].中国药理学通报,2006,22(3):262-6.
[8]Guang H M,Du G H.Involvement of cAMP response element binding protein in neurodegenerative disorders[J].Chin Pharmacol Bull,2006,22(3):262 -6.
[9]李文联,王 玲,张红爱.Ca2+对新生大鼠脑缺氧缺血后CREB磷酸化及神经元凋亡的影响[J].第四军医大学学报,2004,25(3):217 -9.
[9]Li W L,Wang L,Zhang H A.Influence of Ca2+on the phosphorylation of CREB,and the relationship between pCREB and apoptotic neurons in neonatal rats after hypoxic-ischemia[J].J Fourth Mil Med Univ,2004,25(3):217 -9.
[10]任广立,孙海宏,汪 洋,等.新生鼠缺氧缺血/再灌注后海马p-CREB的表达[J].第四军医大学学报,2003,24(17):1578-80.
[10]Ren G L,Sun H H,Wang Y,et al.Expression of p-CREB in the hippocampal of neonatal rats after hypoxic-ischemia brain damage and reperusion[J].J Fourth Mil Med Univ,2003,24(17):1578-80.
[11]Yukawa K,Tanaka T,Tsuji S,Akira S.Expressions of CCAAT/enhancer-binding proteins beta and delta and their activities are intensified by cAMP signaling as well as Ca2+/calmodulin kinases activation in hippocampal neurons[J].Biol Chem,1998,273(47):31345-51.
[12]Kapadia R,Tureyen K,Bowen K K.Decreased brain damage and curtailed inflammation in transcription factor CCAAT/enhancer binding protein beta knockout mice following transient focal cerebral ischemia[J].Neurochem,2006,98(6):1718 -31.
[13]Lu A,Tang Y,Ran R,et al.Genomics of the periinfarction cortex after focal cerebral ischemia[J].Cereb Blood Flow Metab,2003,23(7):786-810.
[14]Osada N,Kosuge Y,Ishige K,et al.Characterization of neuronal and astroglial responses to ER stress in the hippocampal CA1 area in mice following transient forebrain ischemia[J].Neurochem Int,2010,57(1):1 -7.
