吡那地尔后处理在减轻家兔心肌缺血/再灌注损伤中的作用
2011-05-31王明霞刘进军吴士礼关旭东
田 涛,马 宾,王明霞,蔡 鑫,刘进军,方 羚,吴士礼,高 琴,于 影,关旭东
(蚌埠医学院1.第一附属医院心血管科、2.第一附属医院门诊部,安徽蚌埠 233004;3.蚌埠医学院生理学教研室,安徽 蚌埠233030)
急性心肌梗死严重威胁人类健康,及早的再灌注治疗,是挽救患者生命,改善预后的关键。但缺血心肌在恢复血供后可出现一系列再灌注损伤,使损伤反而加重。因此,探索如何减轻缺血/再灌注(ischemia/reperfusion,I/R)损伤是心血管领域研究的热点。虽然缺血预处理和药物预处理能够有效减轻I/R损伤,但由于在临床工作中心肌缺血难以预测,所以其应用受到一定限制。继Zhao等[1]首次提出缺血后处理概念后,Staat等[2]首次将其应用于临床,效果肯定。然而,缺血后处理虽可减轻I/R损伤,但由于存在伦理及操作的制约,从而限制了其应用[3]。为此,运用药物模拟缺血后处理心肌保护机制,减轻I/R损伤,可作为一种安全有效的方法。吡那地而作为一种ATP敏感性钾通道(ATP-sensitive potassium channels,KATP)开放剂可减轻 PC12细胞(神经细胞的替代模型)缺血缺氧损伤[4]及离体心肌I/R损伤。但其对在体心肌I/R损伤的影响尚未见报道。本文研究旨在利用家兔在体心肌I/R损伤模型,观察吡那地尔后处理是否具有减轻心肌I/R损伤的作用,并探讨其可能的机制。
1 材料与方法
1.1实验动物及分组采用左冠状动脉前降支(left anterior descending coronary artery,LAD)结扎30 min、复灌120 min的方法建立心肌I/R模型。选择健康成年♂家兔40只(蚌埠医学院实验动物中心提供),每只体重2.5~3.0 kg,随机分为5组(每组8只),分别为①假手术组(Sham):开胸后,丝线从LAD下方穿过但不结扎;②缺血/再灌组(I/R):结扎LAD 30 min后,复灌120 min;③缺血后处理组(I-PostC):结扎LAD 30 min后,于复灌即刻,给予3轮复灌15 s/缺血15 s作为后处理;④吡那地尔后处理组(Pina):复灌即刻,通过左心室(left ventricle,LV)导管给予吡那地尔0.1 mg·kg-1,余同I/R组;⑤吡那地尔后处理+5-羟葵酸组(Pina+5-HD):复灌即刻,通过左心室导管给予吡那地尔0.1 mg·kg-1及 5-HD 5 mg·kg-1,余同 I/R 组。
1.2药物及试剂吡那地尔(pinacidil),5-羟葵酸(5-hydroxy decanoate,5-HD)购自 Sigma公司;伊文斯蓝(Evan’s Blue),2,3,5,-氯化三苯基四氮唑(2,3,5 triphenyl-tetrazolium chloride,TTC)购自 BIOSHARP公司;磷酸肌酸激酶(creatine kinase,CK),丙二醛(malonaldchyde,MDA)试剂盒购自南京建成生物工程研究所;逆转录及PCR试剂盒购自天根生化科技公司;Bcl-2、Bax及β-actin引物由上海生工生物工程公司合成。
1.3动物模型的制备参照文献建立模型[5]。经耳缘静脉注射乌拉坦1.2g·kg-1麻醉动物。四肢及胸前皮下置入电极,监测心电图变化。气管切开,连接呼吸机,呼吸频率设定为40~50次/min,潮气量为10 ml·kg-1,呼吸比为1.5∶1。右颈总动脉插入与动脉大小相吻合的导管,进入左心室,导管末端通过压力换能器连接Medlab生物信号采集系统。于胸骨左缘处做一切口。逐层分离肌层见第4肋骨,剪断后进胸。切开心包暴露心脏,在LAD根部穿双股4-0号丝线,结扎其中一股造成心肌梗死(结扎时用一细胶管垫于LAD与结扎线之间),复灌时剪断此线;另一股丝线两端套一自制的细塑料管,在行缺血后处理时拉紧丝线造成缺血,放松则恢复灌注。建模成功标准:结扎丝线后,心电图胸导联ST段出现弓背向上抬高、T波高耸等表现,为缺血成功;剪断丝线后,抬高的ST段下降,为复灌成功。
1.4观察指标
1.4.1血流动力学指标的观察手术完成后,令家兔心脏稳定30 min后,再结扎LAD。用Medlab生物信号采集系统分别记录缺血前、缺血30 min和复灌120 min时左心室收缩压(left ventricular systolic ressure,LVSP)和左心室舒张末压(left ventricular end-diastolic pressure,LVEDP)。
1.4.2血浆CK和MDA活性的测定各组于缺血前、缺血30 min和复灌120 min时,由股静脉取血2 ml,3 000 r·min-1离心 15 min,收集上清,用 721 型分光光度计在660 nm处测定CK活性,在532 nm处测定血浆MDA含量。
1.4.3心肌缺血及梗死面积测定参照文献[6],于复灌结束后,原位结扎LAD,取出心脏,用生理盐水漂洗心腔内积血,由升主动脉注入0.01 mol·L-1的Evan’s Blue1.2 ~1.4 ml,冻存30 min 后,沿垂直于心脏长轴的方向,自心尖到结扎部位,将其切成6~8片1.5 mm厚的薄片,然后置于0.03 mol·L-1的TTC中避光37℃水浴 15 min,再经3.33 mol·L-1甲醛固定10 min后,可见梗死区(infarct size,IS)心肌呈灰白色;危险区(area at risk,AAR)呈红色;未缺血区呈蓝色。数码相机拍照并用Image J图像分析软件分析缺血面积(AAR占LV的比值)及梗死面积(IS占AAR的比值)。
1.4.4心肌Bcl-2、Bax mRNA表达的测定运用逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-RCR)检测心肌细胞Bcl-2和Bax mRNA的表达。应用Primer Premier软件设计引物。Bcl-2引物序列:上游5'-GCGAGAAGAGCG AGAACAACT-3',下游 5'-CCTCCAAACAGCAGGATG AAC-3',产物为454 bp。Bax引物序列:上游5'-G AGAAGGCTGAGAATGGAGATAAG-3',下游 5'-TGA TGGAAGGGAGTGAAGAATAAC-3',产物为 351 bp。β-actin引物序列:上游 5'-TGACGTGGACATCCGCAAAG-3',下 游 5'-CTGCAAGGTGGACAGCGAGG-3',产物为205 bp。复灌结束后,取100 mg LV前壁心肌组织,迅速置于-80℃冰箱冻存备用。用TRIzol提取心肌组织总RNA,逆转录合成cDNA。在Taq DNA聚合酶作用下进行PCR扩增,94℃预变性8 min,94℃变性1 min,退火(Bcl-2:53℃,Bax:52℃,β-actin:59℃)1 min,72℃ 延伸 50 s,共 32 个循环,72℃充分延伸10 min后,4℃终止反应。每个标本取5 μl产物在15 g·L-1琼脂糖凝胶中电泳,溴化乙锭显色。用凝胶图像处理系统拍摄记录,并使用图像分析软件对凝胶中每一泳带进行光密度扫描作半定量分析,以目的基因与内参对照的积分吸光度比值(Bcl-2/β-actin;Bax/β-actin)表示 mRNA 相对表达量。
1.5统计学分析所有数据采用SPSS 17.0统计软件进行分析。计量资料用±s表示,多组间比较用单因素方差分析,组间比较应用q检验。
2 结果
2.1心功能参数复灌120 min时,与I/R组比较,I-PostC组和Pina组动物LVSP升高,LVEDP降低(P<0.05);与Pina+5-HD组比较,I-PostC组和Pina组动物 LVSP升高,LVEDP降低(P<0.05)。比较I-PostC组与Pina组LVSP及LVEDP,未见差异(P>0.05);比较I/R组与Pina+5-HD组LVSP及LVEDP,未见差异(P>0.05),详见 Tab 1。
Tab 1 Hemodynamic parameters of each group(±s,n=8)
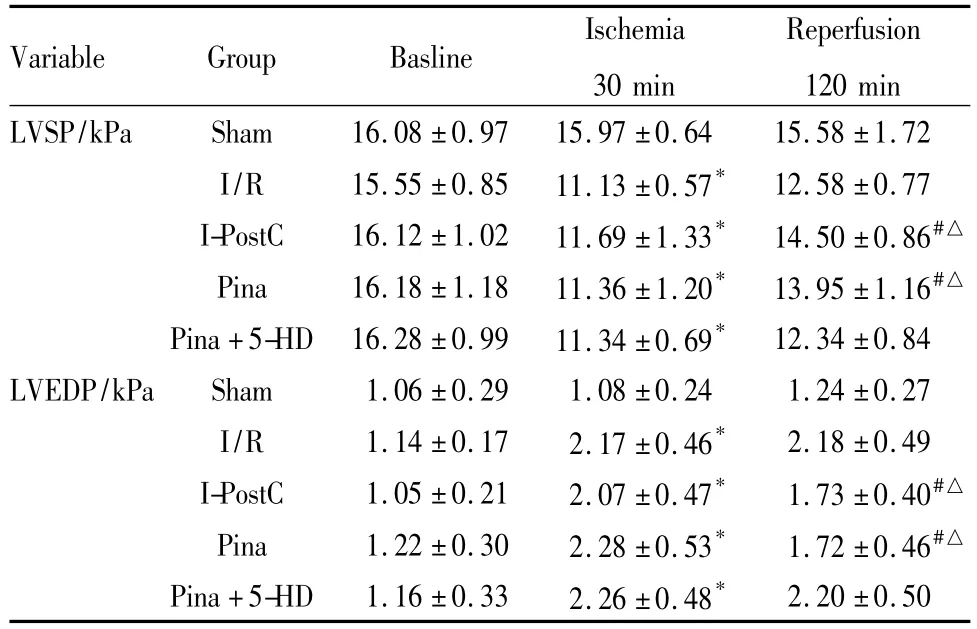
Tab 1 Hemodynamic parameters of each group(±s,n=8)
*P<0.05 vs sham;#P<0.05 vs I/R;△P<0.05 vs Pina+5-HD
Variable Group Basline Ischemia 30 min Reperfusion 120 min LVSP/kPa Sham 16.08 ±0.97 15.97 ±0.64 15.58 ±1.72 I/R 15.55 ±0.85 11.13 ±0.57* 12.58 ±0.77 I-PostC 16.12 ±1.02 11.69 ±1.33* 14.50 ±0.86#△Pina 16.18 ±1.18 11.36 ±1.20* 13.95 ±1.16#△Pina+5-HD 16.28 ±0.99 11.34 ±0.69* 12.34 ±0.84 LVEDP/kPa Sham 1.06 ±0.29 1.08 ±0.24 1.24 ±0.27 I/R 1.14 ±0.17 2.17 ±0.46* 2.18 ±0.49 I-PostC 1.05 ±0.21 2.07 ±0.47* 1.73 ±0.40#△Pina 1.22 ±0.30 2.28 ±0.53* 1.72 ±0.46#△Pina+5-HD 1.16 ±0.33 2.26 ±0.48*2.20 ±0.50
2.2血浆CK活性复灌120 min时,I-PostC组和Pina组血浆CK活性较I/R组明显降低(P<0.05);与Pina+5-HD组相比,I-PostC组和Pina组血浆CK活性也明显降低(P<0.05)。比较I-PostC组与Pina组CK活性,未见差异(P>0.05);比较I/R组与Pina+5-HD组CK活性,也未见差异(P>0.05),详见Tab 2。
2.3血浆MDA含量在复灌120 min时,与I/R组相比,I-PostC组和Pina组血浆MDA含量明显降低(P<0.05);与Pina+5-HD组相比,I-PostC组和Pina组血浆MDA含量也明显降低(P<0.05)。比较I-PostC组与Pina组血浆MDA含量,未见差异(P>0.05);比较I/R组与Pina+5-HD血浆MDA含量,也未见差异(P>0.05),详见Tab 2。
2.4心肌梗死面积比较I/R组、I-PostC组、Pina组和 Pina+5-HD组 AAR/LV,未见差异(P>0.05)。与I/R组相比,I-PostC组和Pina组IS/AAR明显减少(P<0.05);与 Pina+5-HD组比较,IPostC组和Pina组IS/AAR明显减少(P<0.05)。比较I-PostC组与 Pina组IS/AAR,未见差异(P>0.05);比较I/R组与Pina+5-HD组IS/AAR,也未见差异(P>0.05),详见Tab 3。
2.5心肌细胞Bcl-2、Bax基因的表达5组均分别扩增出454 bp的Bcl-2目的片段、351 bp的Bax目的片段和205 bp的β-actin目的片段,见 Fig 1。与I/R组比较,I-PostC组和Pina组Bcl-2 mRNA表达增加,Bax mRNA表达降低(P<0.05);与Pina+5-HD组比较,I-PostC组和Pina组Bcl-2 mRNA表达增加,Bax mRNA表达降低(P<0.05)。比较 IPostC组与Pina组Bcl-2 mRNA表达及Bax mRNA的表达,未见差异(P>0.05);比较I/R组和Pina+5-HD组Bcl-2 mRNA表达及Bax mRNA的表达,也未见差异(P>0.05),详见Fig 2。
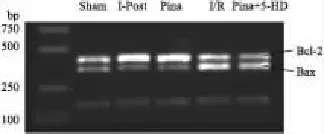
Fig 1 Expressions of Bcl-2 and Bax mRNA of each group(RT-PCR)
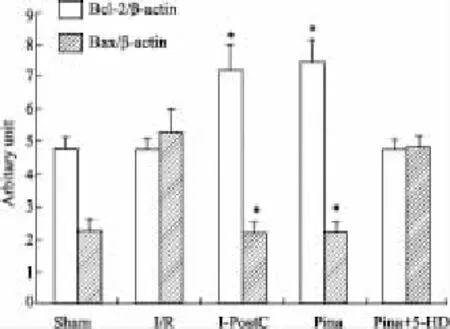
Fig 2 Expressions of Bcl-2 and Bax mRNA of each group
Tab 2 Serum CK and MDA content of each group(±s,n=8)

Tab 2 Serum CK and MDA content of each group(±s,n=8)
*P<0.05 vs sham;#P<0.05 vs I/R;△P<0.05 vs Pina+5-HD
Variable Group Baseline Ischemia 30 min Reper fusion 120min CK/U·L-1 Sham 832.43 ±155.01 838.04 ±158.78 828.46 ±116.40 I/R 878.51 ±129.72 1195.66 ±223.44* 3681.38 ±598.58 I-PostC 856.12 ±116.08 1171.03 ±219.40* 2428.66 ±290.60#△Pina 787.00 ±143.37 1116.80 ±238.93* 2423.71 ±414.31#△Pina+5-HD 824.34 ±132.10 1094.07 ±203.09* 3418.50 ±507.36 MDA/μmol·L -1 Sham 2.23 ±0.18 2.25 ±0.21 2.27 ±0.23 I/R 2.21 ±0.14 2.40 ±0.18 4.96 ±0.70 I-PostC 2.22 ±0.20 2.38 ±0.24 4.03 ±0.41#△Pina 2.14 ±0.19 2.42 ±0.21 3.82 ±0.34#△Pina+5-HD 2.13 ±0.16 2.30 ±0.24 5.05 ±0.78
Tab 3 AAR/LV and IS/AAR of each group(±s,n=4)

Tab 3 AAR/LV and IS/AAR of each group(±s,n=4)
*P<0.05 vs I/R;#P<0.05 vs Pina+5-HD
Group AAR/LV/% IS/AAR/%I/R 46.95 ±6.18 49.95 ±7.31 I-PostC 45.45 ±5.26 26.62 ±5.60*#Pina 48.13 ±7.90 24.98 ±4.39*#Pina+5-HD 49.66 ±7.09 48.18 ±5.38
3 讨论
实验结果显示,缺血后处理及吡那地尔后处理均能够明显改善复灌后心肌的舒缩功能,降低心肌细胞CK的释放,减轻心肌细胞的过氧化,减少心肌梗死的面积,上调心肌Bcl-2 mRNA表达,下调Bax mRNA表达。
目前已经证实,缺血后处理可通过开放线粒体ATP敏感性钾通道(mitochondrial ATP-sensitive potassium channels,mitoKATP)发挥减轻 I/R损伤作用[7]。实验中我们发现,选用KATP激活剂吡那地尔作为后处理,通过模拟缺血后处理机制,减轻心肌I/R损伤。且这一心肌保护作用可被mitoKATP抑制剂5-HD所阻断。但吡那地尔后处理能否通过激活心肌细胞膜KATP,发挥减轻I/R的作用,尚需进一步证实。近期有研究报道[8],缺血后处理心肌保护作用的发挥仅涉及mitoKATP的开放,不涉及心肌细胞膜KATP的开放。此外,吡那地尔后处理还可能通过激活血管平滑肌膜KATP,扩张外周及冠状动脉,从而在复灌时发挥减轻心脏前负荷、改善心肌血供的作用[9]。
Bcl-2家族主要由Bcl-2、Bcl-xl、Bcl-w等抗凋亡成员及 Bax、Bak、Bad等促凋亡成员组成。其中,Bcl-2和Bax是目前研究细胞凋亡的热点基因,两者比值反映了促凋亡和抗凋亡力量的对比[10]。Bax等促凋亡蛋白通过结合线粒体通透转换孔复合体,启动内源性线粒体凋亡途径[11]。有研究表明,I/R损伤可由促凋亡蛋白Puma通过与Bcl-2及Bcl-xL结合,释放出 Bax和 Bak,导致细胞凋亡[12]。本实验发现,与单纯缺血/复灌相比,吡那地尔后处理可上调心肌Bcl-2 mRNA的表达,下调Bax mRNA的表达,发挥抗凋亡,减轻I/R损伤的作用。但mitoKATP的激活是否与Bcl-2及Bax mRNA的表达的变化存在具体关系,尚需进一步研究证实。有研究表明,线粒体乙醛脱氢酶2可影响Bcl-2及Bax mRNA的表达,发挥抗I/R 损伤的作用[13]。
综上所述,吡那地尔后处理具有减轻心肌I/R损伤的作用。其机制可能是通过模拟I-PostC,开放心肌细胞mitoKATP,上调心肌Bcl-2 mRNA表达的及下调Bax mRNA表达来实现。虽然两种后处理方式心肌保护的效果相当,但吡那地尔后处理更安全,适用范围更广。
[1]Zhao Z Q,Corvera J S,Halkos M E,et al.Inhibition of myocardial injury by ischemic postconditioning during reperfusion:comparison with ischemic preconditioning[J].Am J Physiol Heart Circ Physiol,2003,285(2):H579 -88.
[2]Staat P,Rioufol G,Piot C,et al.Postconditioning the human heart[J].Circulation,2005,112(14):2143 -8.
[3]Andreadou I,Iliodromitis E K,Koufaki M,et al.Alternative pharmacological interventions that limit myocardial infarction[J].Curr Med Chem,2008,15(30):3204 -13.
[4]贾春红,张 鸿,李 佳,等.ATP敏感性钾通道开放剂吡那地尔增高Bcl-2表达而抑制PC12细胞缺血性凋亡[J].中国药理学通报,2009,25(7):927 -31.
[4]Jia C H,Zhang H,Li J,et al.Pinacidil,an ATP-senditive potassium channel opener,inhibits ischemic apoptosis via up-regulating Bcl-2 expression in PC12 cells[J].Chin Pharmacol Bull,2009,25(7):927-31.
[5]张 雷,顾尔伟,刘训芹,等.乳化异氟醚后处理对兔在体心脏缺血/再灌注损伤的保护作用[J].中国药理学通报,2009,25(10):1322-6.
[5]Zhang L,Gu E W,Liu X Q,et al.Protective effects of emulsified isoflurane post-conditioning on myocardium against ischemia reperfusion injury in rabbits[J].Chin Pharmacol Bull,2009,25(10):1322-6.
[6]徐 钢,季 永,汪 莉,等.内源性硫化氢参与缺血后处理减轻离体大鼠心脏缺血/再灌注损伤[J].中国药理学通报,2008,24(7):910 -4.
[6]Xu G,Ji Y,Wang L,et al.Endogenoushydrogen sulfide participating in the ischemic postconditioning against cardiac ischemia/reperfusion injury[J].Chin Pharmacol Bull,2008,24(7):910 -4.
[7]Sun H Y,Wang N P,Halkos M,et al.Postconditioning attenuatescardiomyocyte apoptosis via inhibition of JNK and p38 mitogen-activated protein kinase signaling pathways[J].Apoptosis,2006,11(9):1583-93.
[8]Mykytenko J,Reeves J G,Kin H,et al.Persistent beneficial effect of postconditioning against infarct size:role of mitochondrial K(ATP)channels during reperfusion[J].Basic Res Cardiol,2008,103(5):472-84.
[9]Miura T,Miki T.ATP-sensitive K+channel openers:old drugs with new clinical benefits for the heart[J].Curr Vasc Pharmacol,2003,1(3):251 -8.
[10]Reed J C.Proapoptotic multidomain Bcl-2/Bax-family proteins:mechanisms,physiological roles,and therapeutic opportunities[J].Cell Death Differ,2006,13(8):1378 -86.
[11]Kroemer G,Galluzzi L,Brenner C.Mitochondrial membrane permeabilization in cell death[J].Physiol Rev,2007,87(1):99 -163.
[12]Toth A,Jeffers J R,Nickson P,et al.Targeted deletion of Puma attenuates cardiomyocyte death and improves cardiac function during ischemia-reperfusion[J].Am J Physiol Heart Circ Physiol,2006,291(1):H52-60.
[13]高 琴,姜翠荣,于 影,等.线粒体乙醛脱氢酶2在缺血后处理中的作用[J].中国药理学通报,2010,26(8):1088 -92.
[13]Gao Q,Jiang C R,Yu Y,et al.Role of mitochondrial aldehyde dehydrogenase 2 in postconditioning induced cardioprotection[J].Chin Pharmacol Bull,2010,26(8):1088 -31.
