金雀异黄素对CIA大鼠成纤维样滑膜细胞增殖、凋亡及其机制的研究
2011-05-31张学增沈维干许金鑫马莹莹
张 育,张学增,沈维干,许金鑫,马莹莹
(1.江苏扬州大学临床医学院,江苏扬州 225001;2.山东青岛卫生学校,山东 青岛 266071)
类风湿性关节炎是一种常见的可致残的慢性炎症性疾病,其最主要的病理表现为滑膜炎,滑膜细胞呈肿瘤细胞样增殖并产生多种炎症因子,如IL-1和TNF-α等。金雀异黄素(Genistein,Gen)又称为染料木素,是一种来源于豆类植物和齿类植物异黄酮类化合物,其化学名为4,5,7-三羟基异黄酮。体外实验研究表明Gen可能够抑制多种肿瘤细胞的增殖,故Gen已经成为广受各界关注的一种非营养素成分[1-2]。AKT又被称为蛋白激酶 B(protein kinase B,PKB),是一种丝氨酸/苏氨酸蛋白激酶,是PI3K/AKT信号传导通路中的关键分子。磷酸化的AKT诱发的细胞生长,经多种途径促进细胞存活,是重要的抗凋亡调节因子[3]。近来许多研究表明[4-5],炎症因子能够通过活化AKT信号转导通路活化多种炎性细胞,参与RA疾病的发生与发展。我们采用体外细胞培养技术,拟研究Gen对CIA大鼠成纤维样滑膜细胞中AKT及其磷酸化蛋白p-AKT表达的影响,探讨Gen调节CIA大鼠成纤维样滑膜细胞增殖、凋亡蛋白表达与其影响AKT表达和磷酸化蛋白p-AKT表达的关系。
1 材料与方法
1.1实验细胞来源用Ⅱ型胶原建立CIA大鼠动物模型,取滑膜细胞原代培养,通过流式细胞术检测第4代细胞纯度达到顶峰,故用第4代细胞进行实验。
1.2实验试剂和药物Gen购自Sigma公司(相对分子质量为270.2,纯度不低于99%);小牛血清购自杭州四季青公司;DMEM培养基购自美国GIBCO公司;二甲基亚砜(DMSO)购自上海生工生物工程有限公司;5×loading buffer购自南通碧云天生物公司;Rabbit Anti-bax和Rabbit Anti-bcl-2抗体购自美国eBioscience公司;AKT单克隆抗体、p-AKT多克隆抗购自美国Santa Cruz公司;辣根过氧化物酶(HRP)标记的羊抗小鼠二抗、兔抗小鼠二抗及DAB显色液为武汉博士德生物工程有限公司的产品;小鼠抗大鼠GAPDH购自北京博奥森生物科技有限公司。其余试剂均为进口分装或市售分析纯。
1.3实验方法
1.3.1CIA大鼠FLS的培养CIA大鼠FLS养于DMEM培养液(含15%小牛血清,100 kU·L-1青霉素,100 g·L-1链霉素)中。上述细胞均放置于37℃、5%CO2培养箱中常规培养。2~3 d换液1次。取第4代对数生长期的细胞进行实验。
1.3.2大鼠FLS的鉴定用流式细胞术检测CIA大鼠FLS表面标记VCAM-1,观测细胞的纯度。
1.3.3实验分组实验分为正常大鼠FLS组、CIA大鼠FLS组、CIA大鼠FLS+DMSO(浓度为0.1%)组、CIA大鼠FLS+不同浓度的Gen(浓度分别为50、100、200 μmol·L-1)组。
1.3.4MTT法检测Gen抑制FLS增殖情况接种细胞:用0.25%胰蛋白酶消化对数生长期的CIA大鼠FLS以及正常大鼠FLS,用含15%小牛血清的DMEM培养液悬浮细胞,计数后分别接种于96孔培养板,每孔约5 000个细胞,设6个复孔。将培养板移入细胞培养箱中,在37℃、5%CO2培养箱中培养24 h,CIA大鼠FLS组分别加入不同浓度Gen,使其终浓度分别为0、50、100、200 μmol·L-1。分别培养24、48和72 h后,每孔加入20 μl MTT溶液(5 g·L-1),于37℃、5%CO2培养箱中继续培养4 h后,终止培养。弃上清,每孔分别加入50 μl DMSO,轻轻振荡10 min,充分溶解结晶。酶标仪(波长490 nm)测定各孔的OD值,记录结果,实验重复3次。
1.3.5Western blot法检测Gen对CIA大鼠关节FLS bcl-2和bax表达的影响用0.25%胰蛋白酶消化对数生长期CIA大鼠FLS以及正常大鼠FLS,用含15%小牛血清的DMEM培养液配成单个细胞悬液,接种于ø10 cm的细胞培养皿。按以上分组进行加药,置于37℃、5%CO2培养箱中培养,72 h后,终止培养。重悬计数,移入1.5 ml EP管,离心弃去培养基,用预冷的PBS洗涤细胞2次。离心去上清,将EP管口倒置于吸水纸上吸干残留液体。按5×106个细胞加入0.1 ml RIPA强裂解液,并剧烈振荡后置冰上120 min〔裂解液在使用前按每毫升加入10 μl PMSF(100 mmol·L-1)配制,冰浴预冷后使用〕。4℃ 12 000 r·min-1离心10 min,将上清转移至另一1.5 ml EP管中。每个样本中各取少量蛋白,通过BCA法测定蛋白样品浓度,并将蛋白样品浓度调成一致,每组取50 μg的总蛋白按1∶4加入5×SDS上样缓冲液沸水浴中加热5 min,然后进行SDS-PAGE电泳,转膜,0.3%的 BSA封闭1 h加入bax、bcl-2和内参GAPDH抗体4℃孵育过夜。TBST洗涤3次,加入辣根过氧化物酶标记的二抗,37℃与膜孵育1 h,TBST洗涤3次,DAB显色液A、B、C液各一滴加入1 ml三蒸水中混匀取1 ml将膜浸与其中5 min流水冲洗。扫描后用Quantity One灰度分析软件进行光密度计算。以目的蛋白条带灰度值与内参GAPDH灰度值的比值作为相应目的蛋白的表达量指标。每个样本至少重复3次。
1.3.6Western blot法检测Gen对CIA大鼠滑FLS AKT及p-AKT表达的影响细胞分组及处理如“1.3.5”所述。
1.4统计学处理所有统计学处理均在SPSS10.0、Excel 2003 软件中完成。
2 结果
2.1滑膜细胞的形态及鉴定对原代培养的FLS进行贴壁分离纯化,细胞培养成功,倒置显微镜观察细胞形态结果见Fig 1,从图中可以看到两种形态细胞:长梭行及多角形,FLS常呈单个排列。培养3~4 d后平铺贴壁生长。对CIA大鼠FLS进行流式细胞术鉴别结果显示如Fig 2。

Fig 1 Morphology of primary cultured rat fibroblast–like synoviocytes(×400)

Fig 2 Detection of VCAM-1 on CIA rat fibroblast-like synoviocytes by flow cytometry
2.2MTT法检测Gen抑制细胞增殖为了观察Gen对大鼠成纤维样滑膜细胞增殖的影响,本研究MTT的方法分检测24,48和72 h 3个时间点细胞增殖情况,细胞增殖结果由Tab 1可见,造模后CIA大鼠成纤维样滑膜细胞增殖程度明显高于正常组大鼠成纤维样滑膜细胞,50、100 和 200 μmol·L-1的Gen均可以抑制CIA大鼠成纤维样滑膜细胞增殖,差异有显著性(P<0.01),且成剂量时间依赖性关系,DMSO对CIA大鼠成纤维样滑膜细胞增殖无影响。结果见Tab 1。
Tab 1 Gen-suppressed FCS proliferation by MTT assay(±s,n=6)
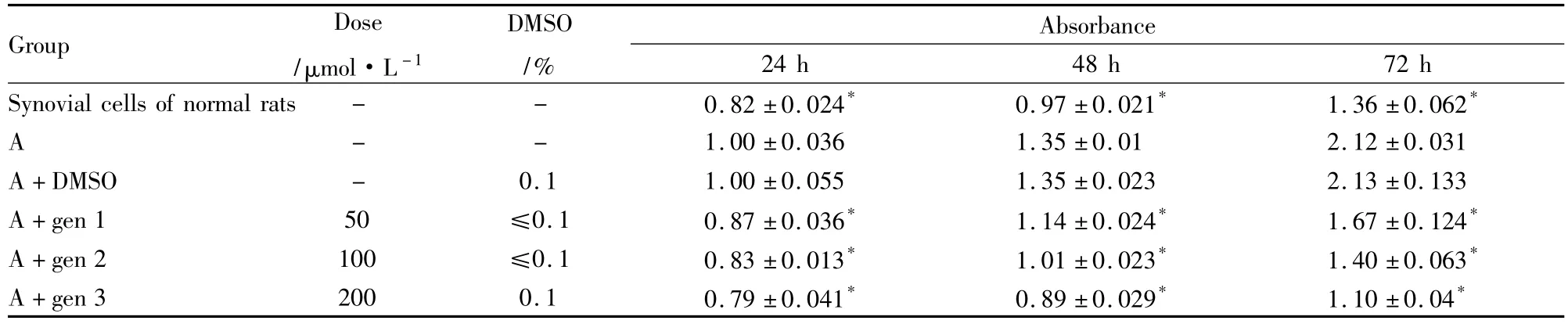
Tab 1 Gen-suppressed FCS proliferation by MTT assay(±s,n=6)
A is the synovial cells of CIA rats and the other results is the multiples of A,*P <0.01
Group Dose/μmol·L-1 Absorbance 24 h 48 h 72 h Synovial cells of normal rats - - 0.82 ±0.024* 0.97 ±0.021* 1.36 ±0.062 DMSO/%*A 1.00 ±0.036 1.35 ±0.01 2.12 ±0.031 A+DMSO - 0.1 1.00 ±0.055 1.35 ±0.023 2.13 ±0.133 A+gen 1 50 ≤0.1 0.87 ±0.036* 1.14 ±0.024* 1.67 ±0.124*A+gen 2 100 ≤0.1 0.83 ±0.013* 1.01 ±0.023* 1.40 ±0.063*A+gen 3 200 0.1 0.79 ±0.041* 0.89 ±0.029* 1.10 ±0.04--*
2.3Western blot法检测Gen对CIA大鼠关节FLS bcl-2和bax表达的影响Bcl-2家族多定位于线粒体外膜、核膜以及内质网膜的胞浆面,分为促凋亡蛋白(bax)和抗凋亡蛋白(bcl-2),不同浓度的Gen作用FLS细胞72 h后,提取FLS细胞总蛋白,采用Western blot检测上述分子的变化。结果如Fig 3所示:①与正常组比较,模型组大鼠关节FLS细胞bax蛋白表达水平明显降低,而模型组大鼠关节FLS细胞bcl-2蛋白表达水平较正常组大鼠关节FLS细胞明显增高,差异均有显著性(P<0.05);用药组bax表达量均低于正常组,其中Gen1和Gen2与正常组差异有显著性(P<0.05),Gen3组bax表达量接近于正常组(P>0.05);Gen1和Gen2组bcl-2表达高于正常组,其Gen2与正常组比较差异有显著性(P<0.05),高剂量组bcl-2表达低于正常组,差异有显著性(P<0.05)。②与模型组比较,不同浓度的Gen作用细胞后,随着药物浓度的增加,与模型组比较bax蛋白表达均有不同水平的上调,其中Gen2组和Gen3组与模型组比较差异有显著性(P<0.05),Gen1组与模型组比较差异无显著性(P>0.05);用药组bcl-2蛋白表达均有不同水平的下调,与模型组比较差异均有显著性(P<0.05)。

Fig 3 Expression of bax,bcl-2,β-actin in rat FLS

Fig 4 Expression of AKT,AKT in rat FLS
2.4Western blot法检测Gen对CIA大鼠FLS中AKT及p-AKT表达的影响不同浓度Gen作用CIA大鼠关节FLS 72 h后AKT、p-AKT表达的高低,结果如Fig 4所示:①与正常组比较,造模组及用药组AKT表达量均无差异(P>0.05);造模组p-AKT表达量高于正常组,且差异有显著性(P<0.05);各Gen用药组p-AKT蛋白的表达均高于正常组,Gen1和Gen2组与正常组比较差异有显著性(P<0.05),Gen3组与正常组p-AKT表达相当(P>0.05)。②与模型组比较,各用药组AKT表达无差异(P>0.05);不同浓度Gen用药组p-AKT蛋白的表达均低于模型组,差异均有显著性(P<0.05),且p-AKT表达的降低与Gen呈剂量依赖性。
3 讨论
Gen是大豆异黄酮的主要活性成分,是一种天然植物雌激素,长期以来引起人们广泛的关注。1987年Akiyama等首次发现Gen是一种受体酪氨酸激酶(RTK)抑制剂,可以抑制血管内皮细胞和肿瘤细胞的增殖[6-7],体内外实验及流行病学结果均显示,Gen通过抑制肿瘤细胞周期蛋白表达、诱导细胞分化、诱导细胞凋亡作用[8]。
RA患者的FLS呈肿瘤细胞样生长,即表现为异常增殖、凋亡受阻并产生大量的炎性细胞因子,因此,FLS作为一个治疗 RA的靶点已受到广泛关注[9]。FLS在RA的发病过程、慢性炎症的维持和软骨与骨的破坏等方面发挥着重要的作用,因此我们研究FLS的生物学功能对于探讨RA的发病机制及筛选抗RA药物具有重要意义。VCAM-1是目前常用的鉴别FLS的特异性的标记物之一[10]。我们用流式法检测培养的原代滑膜细胞表面VCAM-1的表达发现,培养的原代滑膜细胞VCAM-1的表达在第1代约20%,第2代约50%左右,培养至3代约为70%,第4代的细胞VCAM-1的表达为85.5%,第4代的滑膜细胞中大部分为FLS,与资料报道结果一致。故我们选取第四代FLS做为研究对象进行实验研究。
作为bcl-2家族中一对凋亡相关基因,bcl-2/bax的平衡在细胞的凋亡过程中起重要调节作用,在细胞线粒体中,bcl-2家族蛋白通过与其他凋亡蛋白的相互协同作用,调控线粒体的结构与功能,发挥着细胞凋亡主开关的作用。bcl-2家族蛋白在凋亡中的主要功能就是直接调节线粒体膜的通透性,从而调节不同凋亡因子的释放过程,发挥其抗凋亡或促凋亡作用。bax是bcl-2家族中的促凋亡基因,其高表达可促进细胞凋亡,而bcl-2是一种原癌基因,其高表达可以抑制细胞的凋亡过程。我们采用Western blot方法检测Gen对CIA大鼠关节FLS凋亡蛋白表达是否有影响,研究结果显示,Gen能够调节CIA大鼠关节FLS凋亡蛋白bcl-2和bax的表达,用药后CIA大鼠关节FLS凋亡调节蛋白bcl-2表达降低,而bax表达升高,且随Gen剂量的增大,其作用增强,提示Gen在抑制细胞增殖同时能够诱导CIA大鼠关节FLS的凋亡,进一步加强了对FLS增殖的抑制作用。
信号途径是重要的细胞调控通路,各种影响因素及细胞因子均是通过不同的信号转导通路调节细胞的生物学功能,如细胞的增殖、凋亡、迁移等一系列过程,目前已知PI3K/AKT在细胞增殖、凋亡、迁移以及血管新生等相关过程中,起重要的作用[11-12]。RA发生后,机体的多种免疫细胞被激活,并产生大量的炎性细胞因子,炎症因子与相应的细胞表面受体结合后,可分别激活不同的信号通路,将刺激信号传到细胞核,从而调控细胞各种生物学功能的发生。
Gen作为受体酪氨酸激酶抑制剂,对多种癌细胞有抑制生长和刺激分化并诱导肿瘤细胞凋亡的作用[13-14]。同时Gen作为受体酪氨酸激酶抑制剂影响肿瘤细胞PI3K/AKT信号通路[15]。为进一步探讨CIA大鼠关节FLS异常增殖及凋亡受阻的生物学机制及Gen对CIA大鼠关节FLS凋亡的影响机制,我们从细胞信号转导通路水平进行了进一步的研究,发现造模后的CIA大鼠关节FLS p-AKT表达量明显增高,结合凋亡蛋白Western blot结果,由此推断,造模后CIA大鼠关节FLS在自分泌或旁分泌细胞因子的作用下,其PI3K/AKT信号转导通路被异常活化,导致细胞凋亡受阻。Gen对CIA大鼠关节FLS PI3K/AKT信号转导通路中AKT的表达无明显影响,但Gen能够降低AKT磷酸化形式p-AKT的表达量,从而调节其下游的生物学功能,如细胞的增殖、细胞的凋亡及细胞因子的产生。我们认为Gen能够通过调节FLS信号转导通路进一步调节凋亡蛋白表达。目前学术界理论认为,RA患者FLS存在PI3K/AKT信号转导的异常活化,参与RA炎症细胞的活化及异常增殖,同时,PI3K/AKT信号通路活化后具有明显的抗细胞凋亡作用,而在RA患者滑膜组织中,FLS呈过度增殖并且表现凋亡受阻等肿瘤细胞增殖的特性,有实验表明,PI3K的抑制剂wortmannin和LY294002能够诱导细胞的凋亡,阻滞细胞周期在G1期,导致细胞生长停滞[16],此结论与本研究结果相一致。
总之,AKT可能成为RA治疗的一个新靶点,研究结果表明,抑制p-AKT的表达可能是Gen调节CIA大鼠FLS凋亡蛋白表达的原因之一,因此Gen可能是未来治疗RA的有效措施之一。
[1]Sarkar F H,Li Y.Mechanisms of cancer chemoprevention by soy isoflavone genistein[J].Cancer Metastasis Rev,2002,21(3-4):265-80.
[2]Cui H B,Na X L,Song D F,Liu Y.Blocking effects of genistein on cell proliferation and possible mechanism in human gastric carcinoma[J].World J Gastroenterol,2005,11(1):69-72.
[3]Franke T F,Yang S I,Chan T O,et al.The protein kinase encoded by the AKT proto-oncogene is a target of the PDGF-activated phosphatidylinositol 3-kinase[J].Cell,1995,81(5):727-36.
[4]Terabe F,Kitano M,Kawai M,et al.Imatinib mesylate inhibited rat adjuvant arthritis and PDGF-dependent growth of synovial fibroblast via interference with the AKT signaling pathway[J].Mod Rheumatol,2009,19(5):522-9.
[5]Cho M L,Ju J H,Kim K W,et al.Cyclosporine A inhibits IL-15-induced IL-17 production in CD4+T cells via down-regulation of PI3K/AKT and NF-kappaB[J].Immunol Lett,2007,108(1):88-96.
[6]Farina H G,Pomies M,Alonso D F,Gonez D E.Antitumor and antiangiogenic activity of soy isoflavone genistein in mouse models of melanoma and breast cancer[J].Oncol Rep,2006,16(4):885-91.
[7]沈丽霞,赵丕文,牛建昭,王继峰.金雀异黄素和槲皮素对人类乳腺癌细胞增殖和细胞周期的影响[J].中国药理学通报,2008,24(1):59-62.
[7]Shen L X,Zhao P W,Niu J Z,Wang J F.Effect of genistein and quercetin on proliferation and cell cycle in human breast carcinoma cells[J].Chin Pharmacol Bull,2008,24(1):59-62.
[8]朱松柏,吕永曼.金雀异黄素抗癌作用分子机制研究进展[J].华中医学杂志,2006,3(3):253-4.
[8]Zhu S B,Lu Y M.Advances in Molecular mechanisms of anticancer action of genistein[J].Central China Med J,2006,3(3):253-4.
[9]Morel J,Audo R,Hahne M,Combe B.Tumor necrosis factor-related apoptosis-inducing ligand(TRAIL)induces rheumatoid arthritis synovial fibroblast proliferation through mitogen-activated protein kinases and phosphatidylinositol 3-kinase/AKT[J].J Biol Chem,2005,280(20):15709-18.
[10]Morales-Ducret J,Wayner E,Elices M J,et al.Alpha 4/beta 1 integrin(VLA-4)ligands in arthritis.Vascular cell adhesion molecule-1 expression in synovium and on fibroblast-like synoviocytes[J].J Immunol,1992,149(4):1424-31.
[11]Haagenson KK,Wu G S.The role of MAP kinases and MAP kinase phosphatase-1 in resistance to breast cancer treatment[J].Cancer Metastasis Rev,2010,29(1):143-9.
[12]Ismail S I,Mahmoud I S,Msallam M M,Sughayer M A.Hotspot mutations of PIK3CA and AKT1 genes are absent in multiple myeloma[J].Leuk Res,2010,34(6):824-6.
[13]Kim S H,Kim S H,Kim Y B,et al.Genistein inhibits cell growth by modulating various mitogen-activated protein kinases and AKT in cervical cancer cells[J].Ann N Y Acad Sci,2009,1171:495-500.
[14]Kim S H,Kim S H,Lee S C,Song Y S.Involvement of both extrinsic and intrinsic apoptotic pathways in apoptosis induced by genistein in human cervical cancer cells[J].Ann N Y Acad Sci,2009,1171:196-201.
[15]Yan G R,Xiao C L,He G W,et al.Global phosphoproteomic effects of natural tyrosine kinase inhibitor,genistein,on signaling pathways[J].Proteomics,2010,10(5):976-86.
[16]Goswami A,Burikhanov R,de Thonel A,et al.Binding and phosphorylation of Par-4 by AKT is essential for cancer cell survival[J].Mol Cell,2005,20(1):33-44.
