2,3-吲哚醌对多巴胺能细胞氧化损伤的保护作用
2011-05-31张芳,董海,岳旺
张 芳,董 海,岳 旺
(青岛大学医学院1.药学系、2.附属医院(东区)重症医学科,山东青岛 266021)
MES 23.5细胞是由大鼠中脑细胞与小鼠神经母细胞瘤-胶质瘤细胞株18TG2经细胞融合技术形成的一种DA能细胞株,具有中脑黑质DA能神经元的许多特性,它含有酪氨酸羟化酶,能够合成DA(多巴胺),但不合成其他儿茶酚胺[1]。氧是需氧生物生存的基本要素,但同时也是生成有害的活性氧(reactive oxygen species,ROS)的前体。当细胞内氧化与抗氧化系统之间的平衡被打破,ROS生成能力超过清除能力或外源ROS大量涌入体内时,氧化应激便产生了。这是包括神经退行性疾病在内的50多种疾病的一个重要的发病机制[2]。H2O2是众多种类ROS中最重要的一种,H2O2凭借其良好的细胞膜渗透性可以轻易的进入细胞内部,并产生细胞毒性[3]。故本实验我们选用H2O2造成MES 23.5细胞的损伤模型进行研究。
2,3-吲哚醌(2,3-indolinedione,isatin,ISA),又名靛红,是近年发现存在于人和动物体内的一种内源性活性因子,具有多种生物学活性。先前我们在多种动物模型证实ISA可提高脑内DA含量[4],减轻大鼠6-OHDA损毁模型的旋转行为,同时具有抗动脉粥样硬化[5]和抑制肿瘤生长[6]的作用,这些作用与提高细胞的抗氧化作用有密切关系。本文采用MTT、FCM和LSCM方法测定了ISA预处理对H2O2损伤的MES 23.5细胞△ψm和[Ca2+]i水平,以进一步深入探讨ISA保护细胞的可能机制。
1 材料与方法
1.1细胞培养MES 23.5细胞由美国休斯敦贝勒医学院神经科友情馈赠。用含5%胎牛血清的DEME/F12培养基(均购自美国 GIBCO-BRL公司),在5%CO2、37℃饱和湿度条件下,于铺被了多聚赖氨酸的培养瓶或培养皿中培养。
1.2主要仪器设备CO2培养箱(Thermo Electron Corporation,美国);倒置显微镜(OLYMPUS,日本);低温高速离心机(Eppendorf,德国);酶标仪(雷杜公司,深圳);流式细胞仪(BD Biosciences,美国),激光扫描共聚焦显微镜(OX-81,Olympus,日本)。
1.3 MTT检测
1.3.1不同浓度H2O2对MES 23.5细胞生长的影响取对数生长期的MES 23.5细胞,用DMEM/F12培养液稀释成6×108cells·L-1的细胞悬液接种于铺有多聚赖氨酸的96孔板,置于37℃、5%CO2培养箱中培养24 h后加入不同稀释度的H2O2(5、10、20、40、80 和 160 μmol·L-1),以新鲜配制的DMEM/F12培养液为阴性对照。
培养结束前4 h,每孔加入5 g·L-1的MTT 20 μl,37℃培养箱中培养4 h,弃上清后每孔加入DMSO 200 μl,自动酶标读数仪比色(主波长494 nm,次波长630 nm),测定其吸光度值。并计算各组MES 23.5细胞的存活率。细胞存活率/%=实验组吸光度均值/阴性对照组吸光度均值×100%。
1.3.2不同浓度ISA对MES 23.5细胞生长的影响
按上述方法测定不同浓度 ISA(25、50、100、200、400 μmol·L-1)对 MES 23.5 细胞生长的影响,计算细胞存活率。
1.3.3不同浓度ISA对H2O2造成MES 23.5细胞损伤的保护作用相同方法测定不同浓度ISA(25、50、100、200、400 μmol·L-1)对 20 μmol·L-1H2O2造成MES 23.5细胞损伤的保护作用。计算各组细胞存活率。
1.4FCM检测△ψm将MES 23.5细胞悬液接种于铺有多聚赖氨酸的6孔板中,每孔2 ml。24 h后各孔分别加入 H2O220 μmol·L-1、H2O220 μmol·L-1+ISA 100 μmol·L-1和 DMEM/F12 培养液作阴性对照。置于37℃、5%CO2培养箱中培养24 h。
测定△ψm:培养结束前30 min,弃上清,每孔加入5 mg·L-1的 R 123,37℃避光负载 30 min,HBS吹打制成单细胞悬液,200目尼龙网过滤后加入流式细胞仪的样品室,以激发波长488 nm,发射波长523 nm测定,FCS/SSC设门,收集门内10 000个细胞,CELLQuest Pro分析系统分析每组细胞R 123的荧光强度。
FCM分析各组细胞R 123的荧光强度,以荧光强度为101设门,低于101为M1区,高于101为M2区,M1区的细胞认为是△ψm降低,受损细胞所占比例,M2区的细胞为正常细胞所占比例。
1.5LSCM测定[Ca2+]iMES 23.5细胞悬液接种于放置了玻片并铺有多聚赖氨酸的24孔板中。24 h 后各孔分别加入 H2O220 μmol·L-1、H2O220 μmol·L-1+ISA 100 μmol·L-1和 DMEM/F12 培养液作阴性对照。继续培养24 h,培养结束前45 min,每孔加入 Fluo-3/AM 50 μl,37℃ 避光负载 45 min后将玻片放置于LSCM测定小室内,由488 nm激发,检测各组细胞发射波长525 nm处的荧光强度。以Fluoview 5.0图像处理系统分析荧光强度。
1.6统计学处理实验结果以±s表示,应用SPSS11.0软件包进行单因素方差分析(one-way ANOVA),Student-Newman-Keuls检验,各组间率的比较进行χ2检验。
2 结果
2.1MTT检测结果5,10 μmol·L-1的 H2O2作用于MES 23.5细胞后,对细胞存活率无影响,20 μmol·L-1及以上浓度的H2O2处理组,细胞的存活率降低(P<0.01),且至 160 μmol·L-1范围内,表现出浓度依赖关系。由此在本实验中使用20 μmol·L-1的H2O2造成MES 23.5细胞损伤模型。
单独使用不同浓度的 ISA(25、50、100、200、400 μmol·L-1)对细胞存活率无影响。25 及50 μmol·L-1ISA处理的MES 23.5细胞存活率与单独H2O220 μmol·L-1处理组相比,差异无显著性,ISA 100、200和400 μmol·L-1处理的细胞存活率均较单独H2O220 μmol·L-1组有明显升高(P<0.01,P<0.05,Fig 1)。

Fig 1 Protective effect of different concentration of ISA on the viability of H2O2-treated MES 23.5 cells
2.2FCM检测△ψm结果20 μmol·L-1H2O2与MES 23.5细胞共同培养24 h后,M1区细胞所占比例平均为28.8% ±5.4%,表明28.8%的细胞△ψm降低,而对照组为21.3% ±3.3%,两者之间差异明显(P<0.05);20 μmol·L-1H2O2+ISA 100 μmol·L-1组,M1区细胞所占比例平均为20.1% ±3.2%,比H2O2处理组明显降低(P<0.01),完全恢复到正常水平(Fig 2B)。
MES 23.5 细胞经20 μmol·L-1H2O2孵育 24 h后,平均荧光强度为30.0±3.5,较对照组明显降低(46.7 ± 5.3,P< 0.01)。20 μmol·L-1H2O2+ISA 100 μmol·L-1组平均荧光强度为 43.0 ±4.7,较单独使用H2O2组明显增强(P<0.01,Fig 2C)。
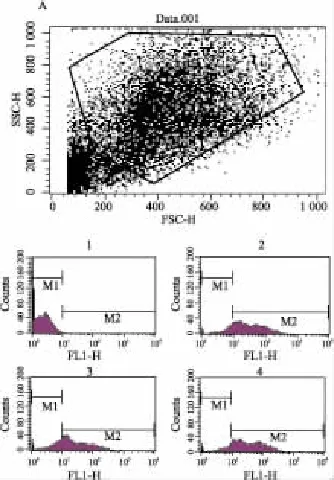
Fig 2A Protective effect of ISA 100 μmol·L -1on the △ψm of 20 μmol·L -1H2O2-treated MES 23.5 cell(original figure)

Fig 2B Effect of ISA 100 μmol·L -1on the △ψm of 20 μmol·L -1H2O2-treated MES 23.5 cells
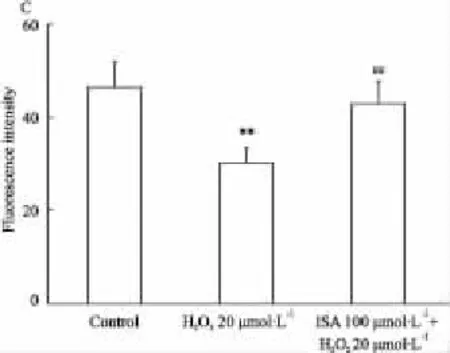
Fig 2C Effect of ISA 100 μmol·L -1on the R 123 fluorescence intensity of H2O2-treated MES 23.5 cells
2.3LSCM检测[Ca2+]i结果20 μmol·L-1H2O2组细胞内荧光强度(160.3±48.9)与对照组(57.3±13.5)相比明显增强(P<0.01),表明经H2O2孵育后MES 23.5细胞的[Ca2+]i明显升高;20 μmol·L-1H2O2+ISA 100 μmol·L-1组,荧光强度为83.0±8.2,比H2O2组明显降低(P<0.01,Fig 3B)。
3 讨论
ISA为吲哚类衍生物,是在人体内发现的内源性生物活性物质[7],且广泛存在于海洋生物如龙虾和十字花科植物如板蓝根、甘蓝等[8]。
本实验发现单独使用 25 μmol·L-1至 400 μmol·L-1的ISA对细胞存活率无明显影响,而将一定浓度的ISA加入H2O2损伤的MES 23.5细胞后,使存活率增高,表明ISA能拮抗H2O2对MES 23.5细胞造成的损伤。
△ψm是由于线粒体内膜两侧质子的不对称分布而形成的电位差,为维持线粒体正常功能所必需。在细胞受损伤早期,由于线粒体内膜通透性转换管孔 (permeability transition pore,PTP)开放,使膜通透性增加,△ψm下降。△ψm的变化可利用能选择性被线粒体所吸收的荧光染料——R 123来测定,FCM检测细胞荧光强度的变化反映△ψm变化,检测出早期受损伤的细胞[9]。生理情况下PTP周期性开放,以维持线粒体内电化学平衡,保持氧化还原通路的畅通。细胞凋亡过程中,PTP不可逆性开放,导致线粒体内膜两侧离子梯度消失,△ψm降低,呼吸链与氧化磷酸化失偶联,最终引起细胞凋亡[10]。本实验20 μmol·L-1H2O2组 MES 23.5 细胞的 R 123吸收值明显低于对照组,且△ψm降低的细胞所占比例明显增高,即△ψm已发生异常改变。多种原因均能诱导PTP的开放,其中高浓度Ca2+和ROS尤为重要[11]。

Fig 3A Effect of ISA 100 μmol·L -1on the Fluo-3 fluorescence intensity of H2O2-treated MES 23.5 cell(original figure,40 × )

Fig 3B Effect of ISA 100 μmol·L -1on the Fluo-3 fluorescence intensity in H2O2-treated MES 23.5 cells
维持细胞内低浓度的Ca2+是细胞正常与否的一个重要标志,细胞内Ca2+的超负荷是导致细胞变性坏死的重要因素[12]。大量ROS可破坏细胞膜,造成膜通透性增加从而使Ca2+内流增加。ROS还可损伤线粒体膜,导致ATP生成减少,抑制钙泵活性;ROS损伤肌浆网和内质网,影响Ca2+的转运,加剧细胞内 Ca2+超载[13]。
本实验 20 μmol·L-1H2O2孵育 MES 23.5 细胞24 h后,细胞内Fluo-3荧光强度明显升高,表示MES 23.5 细胞[Ca2+]i升高;100 μmol·L-1的 ISA处理后,细胞内Fluo-3荧光强度较H2O2处理组明显降低,表示 ISA处理降低了 MES 23.5细胞[Ca2+]i水平。
线粒体对Ca2+的摄取和释放在胞质钙离子浓度的调节中起重要作用。当[Ca2+]i升高时,线粒体代偿性摄入Ca2+。Ca2+的摄入常伴随线粒体膜的去极化和H+的排出,还有线粒体内Ca2+浓度的增加,当Ca2+摄入过量时,这些因素均促使线粒体内膜PTP开放,其结果线粒体膜对离子通透性升高,Ca2+流入胞质,△ψm降低和氧化磷酸化的脱偶联[14]。
在使用了ISA后,减轻了H2O2对MES 23.5细胞造成的损伤。该保护作用主要通过ISA的抗氧化作用,降低了[Ca2+]i水平,减少PTP的开放,△ψm降低减轻。
本实验中研究的ISA对DA能神经元的保护作用以及对其可能机制的初步探讨,为DA系统功能失调相关疾病的预防与治疗提供新的可能方案,为这一海洋活性物质的新用途和进一步开发提供实验依据。
[1]Grawford G D Jr,Le W D,Smith R G,et al.A novel N18TG2 ×Mesencephalon cell hybrid expresses properties that suggest a dopaminergic cell line of substantia nigra origin[J].J Neuro Sci,1992,12(9):3392-8.
[2]Shirlee T,Malcolm W.Oxidative stress induces a form of programmed cell death with characteristics of bothapoptosis and necrosis in neuronal cells[J].J Neurochem,1998,71(1):95 -105.
[3]陈刚领,郑建普,李亚娟,卞 卡.H2O2氧化损伤血管内皮模型的构建及超氧化物歧化酶对损伤的逆转作用[J].中国药理学通报,2009,25(7):884-7.
[3]Chen G L,Zheng J P,Li Y J,Bian K.The construction of H2O2induced vascularendothelial damage model and reversal effect of SOD to the endothelial function[J].Chin Pharmacol Bull,2009,25(7):884-7.
[4]张 芳,岳 旺.2,3-吲哚醌对MPTP损伤的C57小鼠的抗氧化酶活性的作用[J].中国药房,2008,19(22):1696-7.
[4]Zhang F,Yue W.The antioxidation effect of isatin on MPTP-damaged C57 mice[J].Chin Pharmacy,2008,19(22):1696 -7.
[5]刘占涛,杨志宏,赵永娟,等.2,3-吲哚醌对实验性动脉粥样硬化调血脂作用的研究[J].中国药理学通报,2006,22(10):1279-80.
[5]Liu Z T,Yang Z H,Zhao Y J,et al.The effect of 2,3-dioxoindoline on regulating hyperlipidemia of experimental atherosclerosis in quails[J].Chin Pharmacol Bull,2006,22(10):1279 -80.
[6]王 蕾,曹 静,鞠传霞,等.2,3-吲哚醌抗肿瘤作用研究[J].中国药理学通报,2007,23(8):1052-6.
[6]Wang L,Cao J,Ju C X,et al.A study on the anti-tumor effect of 2,3-indolinedione[J].Chin Pharmacol Bull,2007,23(8):1052-6.
[7]孙 伟,李冬梅,李 静,等.癌症患者尿液2,3-吲哚醌含量的测定及其临床意义[J].中国药学杂志,2008,43(2):149-51.
[7]Sun W,Li D M,Li J,et al.Determination of urinary isatin in patients with cancer and its clinical significance[J].Chin Pharma-ceutical J,2008,43(2):149 -51.
[8]刘占涛,仲伟珍,杨志宏,等.海洋活性物质2,3-吲哚醌对实验性高脂血症的预防作用[J].中国海洋药物,2006,25(3):.37-9.
[8]Liu Z T,Zhong W Z,Yang Z H,et al.Preventive effects of 2,3-dioxoindoline on experimental hyperlipidemia[J].Chin J Marine Drugs,2006,25(3):37 -9.
[9]Lenaz G,Baracca A,Fato R,et al.Mitochondrial ComplexⅠ:structure,function,and implications in neurodegeneration[J].Ital J Biochem,2006,55(3):232-53.
[10]Zamzami N,Marchetti P,Castedo M,et al.Sequential reduction of mitochondrial transmembrane potential and generation of reactive oxygen species in early programmed cell death[J].J Exp Med,1995,182(2):367-77.
[11]Jordan J,Cena V,Prehn J H.Mitochondrial control of neuron death and its role in neurodegenerative disorders[J].J Physiol Biochem,2003,59(2):129-41.
[12]Brookes P S,Yoon Y,Robotham J L,et al.Calcium,ATP,and ROS:a mitochondrial love-hate triangle[J].Am J Physiol Cell Physiol,2004,287(4):817 -33.
[13]Camello-Almaraz C,Gomez-Pinilla P J,Pozo M J,et al.Mitochondrial reactive oxygen species and Ca2+signaling[J].Am J Physiol Cell Physiol,2006,291(5):1082 -8.
[14]Kann O,Kovacs R.Mitochondria and neuronal activity[J].Am J Physiol Cell Physiol,2007,292(2):641 -57.
