帕金森病小鼠和大鼠模型黑质纹状体中胆绿素还原酶B的表达
2011-05-31周冰莹蒲小平
周冰莹,赵 欣,孙 泓,姜 尧,蒲小平
(北京大学1.天然药物与仿生药物国家重点实验室、2.药学院分子与细胞药理学系,北京 100191)
帕金森病(Parkinson’s disease,PD)是一种由于黑质部位多巴胺能神经元选择性、进行性的变性、缺失,导致黑质-纹状体多巴胺神经系统失调,而引起的神经退行性疾病[1]。PD典型临床症状包括肌肉僵直、静止性震颤、运动迟缓以及姿势反射障碍等。PD的致病因素仍不十分清楚,目前研究认为与年龄老化、遗传易感性和环境毒素等导致的神经元死亡等因素有关。然而,已有的研究表明[2],氧化应激在多巴胺细胞死亡中起关键作用,是PD的发病机制之一。
酪氨酸羟化酶(tyrosine hydroxylase,TH)是多巴胺生物合成中的限速酶。在PD脑组织中,TH表达含量明显下降,表明多巴胺能神经元的数目减少,因而TH已成为PD实验模型建立成功的指标之一。
胆绿素还原酶 B(biliverdin-Ⅸβ reductase,BVRB),也称黄素还原酶,存在于细胞质,在胎儿肝脏及成人红细胞中高表达,且在心脏、肾脏、大脑、肺脏及肾上腺均有分布[3-4],是体内氧化还原循环的重要成员之一。胆绿素还原酶是催化胆绿素还原成胆红素的关键酶,而胆红素具有明显的抗氧化的生理功能。本实验室前期在MPTP诱导的PD小鼠模型蛋白质组学研究发现,与对照组小鼠相比,模型组小鼠黑质纹状体中BVRB的含量明显增高,约为2.30倍[5]。本实验旨在用 MPTP和6-OHDA分别制备PD小鼠和大鼠模型,探讨BVRB在黑质纹状体内的表达变化。
1 材料与方法
1.1动物C57BL/6小鼠,♂,体质量20~25 g;SD大鼠,♂,体质量200~300 g,均由北京大学医学部实验动物中心提供,实验动物生产许可证号SYXK(京)2006-0008。动物分笼饲养,室温和湿度分别维持在(22±2)℃和(55±5)%,明暗周期12 h,自由进食,饮水不限。实验前适应环境1周。
1.2试剂MPTP和 6-OHDA(美国 Sigma-Aldrich公司);TH抗体(美国Millipore公司);β-actin抗体和BVRB抗体(美国Santa Cruz公司);HRP标记的二抗(中杉金桥生物技术有限公司)。
1.3动物PD模型的建立
1.3.1MPTP小鼠模型小鼠适应环境1周后,随机分为2组,即对照组(n=12)和模型组(n=12)。模型组腹腔注射MPTP(30 mg·kg-1,溶解于生理盐水),对照组给予等体积生理盐水,连续5 d,每天给药1次,最后一次给药后d 4处死小鼠,冰上取脑分离黑质和纹状体,于-80℃保存,用于分别测定多巴胺及其代谢产物的含量和进行Western blot分析[6]。
1.3.26-OHDA大鼠模型大鼠适应环境1周后,观察确认无旋转行为后,随机分为2组,即对照组(n=12)和模型组(n=12)。麻醉大鼠。以头颅平位固定于大鼠脑立体定位仪上,消毒后于剪毛处沿大鼠脑头盖骨正中线切口,参照大鼠脑立体定位图谱确定右侧纹状体注射点,坐标如下:前囟前0.5 mm,正中线右1.5 mm,硬脑膜下4.5 mm;前囟后0.5 mm,正中线右 2.5 mm,硬脑膜下 4.5 mm[7]。用电动颅骨钻小心钻开颅骨,用5 μl微量注射器每孔注射6-OHDA 溶液2.5 g·L-1(溶于2 g·L-1抗坏血酸注射用生理盐水溶液),注射速度为1 μl·min-1,停针 5 min后退针,退针速度为 1 mm·min-1,以防药液溢出。外科手术方法缝合皮肤,并将术后大鼠置于安静保温处单笼饲养直至清醒,连续注射青霉素1周,剂量为每日100万U·kg-1,自由进食,饮水不限。对照组大鼠每孔用等量溶剂(2 g·L-1抗坏血酸注射用生理盐水溶液)代替6-OHDA溶液注射,其他操作方法与模型组相同。造模4周后处死大鼠,取脑,冰上分离黑质和纹状体,于-80℃保存备用,用于分别测定多巴胺及其代谢产物的含量和Western blot分析。
1.4指标测定及方法
1.4.1小鼠滚筒实验于给药结束后d 2进行滚筒实验(SD-2小鼠滚筒仪),本实验用来评价小鼠的运动协调能力[6]。测试前训练2 d,每天2次,转速为12 r·min-1,训练时间120 s。正式实验时转速调为25 r·min-1,记录每只小鼠从滚筒开始旋转到离开滚筒的时间作为小鼠运动潜伏期,测试时间为120 s。每只小鼠重复测定3次取平均值。
1.4.2大鼠阿朴吗啡诱导的旋转行为手术4周后,皮下注射阿朴吗啡(0.5 mg·kg-1)诱发其旋转行为。注射阿朴吗啡15 min后,观察大鼠的旋转情况。记录各大鼠在开始旋转后30 min内的旋转圈数。PD模型造模成功标准为恒定左旋,平均速度≥7 r·min-1。
1.4.3高效液相 -电化学(HPLC-EC)分析取冻存纹状体,1 ∶10 加入 100 μl溶液 A(0.4 mol·L-1HClO4)冰浴超声匀浆,4℃静置1 h,离心15 min(15 000×g,4℃),取上清加入 40 μl溶液 B(20 mmol·L-1柠檬酸钠,300 mmol·L-1K2HPO4和 2 mmol·L-1Na2EDTA),充分混匀后 4℃静置 1 h,再离心15 min(15 000×g,4℃),得到样品上清,经0.2 μm滤器过滤后,分析多巴胺及其代谢产物3,4-二羟基苯乙酸 (3,4-dihydroxyphenylacetic acid,DOPAC)和高香草酸(homovanillic acid,HVA)的含量。C18柱流速 1.0 ml·min-1,温度(24 ± 1)℃,进样量 10 μl,多巴胺含量用 μg·g-1湿组织重表示[6]。
1.4.4Western blot实验取冻存黑质纹状体,1∶7 加入匀浆缓冲液〔80 mmol·L-1Tris-HCl(1 mol·L-1,pH 7.4〕,150 mmol·L-1NaCl,2 mmol·L-1Na2EDTA,1 g·L-1SDS,0.4 mmol·L-1DTT 以及蛋白酶抑制剂),制备匀浆,冰浴30 min后,离心30 min(15 000×g,4℃),取上清液,用BCA试剂盒蛋白定量,100℃变性5 min,经SDS-PAGE分离后,恒流230 mA转移到PVDF膜上,50 g·L-1脱脂奶粉室温封闭2 h,加入TH抗体(稀释比例1∶3 000)4℃孵育过夜,次日加入HRP标记的二抗,37℃孵育2 h,ECL发光液发光,X 线片显影、定影[8]。为确保蛋白上样量一致,我们还对内参蛋白β-actin进行了Western blot分析(稀释比例1∶1 000)。黑质纹状体BVRB表达的检测与上述操作方法相同,仅所使用抗体不同(稀释比例1∶200)。
1.4.5统计学分析所有数据均以±s表示,对于MPTP小鼠数据,采用t检验进行组间比较;对于6-OHDA大鼠数据,采用One-way ANOVA进行两两比较。
2 结果
2.1小鼠滚筒实验滚筒实验的结果见Fig 1。与正常对照组(57.83±23.83)s相比,MPTP模型组小鼠在滚筒上的停留时间(17.40±4.265)s下降(P<0.05),表明其运动协调能力降低。

Fig 1 MPTP treatment reduced the latent period(time on the rotarod)of mice in the rotarod test(±s)
2.2阿朴吗啡诱导的大鼠旋转行为皮下注射阿扑吗啡后,大鼠应出现恒定左转,即旋转时以左侧后肢为支撑点,头尾相接呈环状。发生旋转的模型组大鼠平均旋转圈数为(7.25±0.77)r·min-1。取发生旋转速度≥7 r·min-1的大鼠作为6-OHDA帕金森大鼠模型,进行后续的TH和BVRB免疫印迹分析。
2.3PD模型纹状体内多巴胺及其代谢产物含量的变化HPLC定量分析结果表明,与对照组相比,MPTP模型组小鼠纹状体内多巴胺水平下降了93.99%。另外,DOPAC和 HVA含量分别下降88.40%和51.19%(均为P<0.01,Tab 1)。与对照组相比,6-OHDA大鼠损毁侧纹状体中DA水平降低了99.53%;与非损毁侧相比,降低了99.32%。此外,与对照组和非损毁侧相比,损毁侧的DOPAC和HVA含量分别下降了97.89%和89.52%,以及98.09%和90.91%。与对照组相比,非损毁侧的多巴胺含量减少了30.02%(均为P<0.01,Tab 2)。
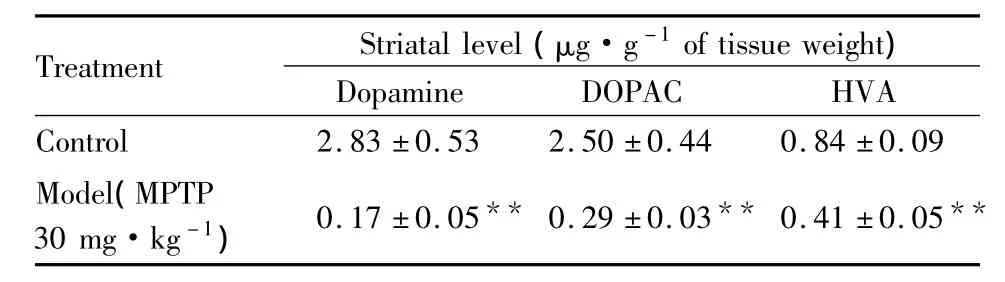
Tab 1 MPTP effects on dopamine and its metabolites,DOPAC and HVA,in mouse striatum

Tab 2 6-OHDA effects on dopamine and its metabolites,DOPAC and HVA,in rat striatum
2.4PD模型中TH的表达变化与对照组相比,MPTP模型组小鼠黑质纹状体内TH水平降低了59.69%(P<0.05,Fig 1)。类似地,与对照组相比,6-OHDA模型组大鼠损毁侧黑质纹状体内TH表达水平减少了73.92%(P<0.05,Fig 2)。此外,与非损毁侧相比,损毁侧TH表达水平下降了77.75%(P<0.05,Fig 2)。
2.5BVRB含量在PD模型黑质-纹状体系统中的表达与对照组相比,MPTP模型组小鼠黑质纹状体内 BVRB水平升高了71.70%(P<0.05,Fig 3)。6-OHDA模型组大鼠损毁侧黑质纹状体BVRB含量为对照组的约2.30倍(P<0.05,Fig 4),而损毁侧的BVRB水平为非损毁侧的约2倍(P<0.05,Fig 4)。

Fig 2 Western blot analysis of TH in nigrostriatal tissue from control and MPTP treated mice(±s,n=3)

Fig 3 Western blot analysis of TH in nigrostriatal tissue from control and unilateral 6-OHDA lesioned rats(±s,n=3)

Fig 4 Western blot analysis of nigrostriatal BVRB in control and MPTP-treated mice(±s,n=3)
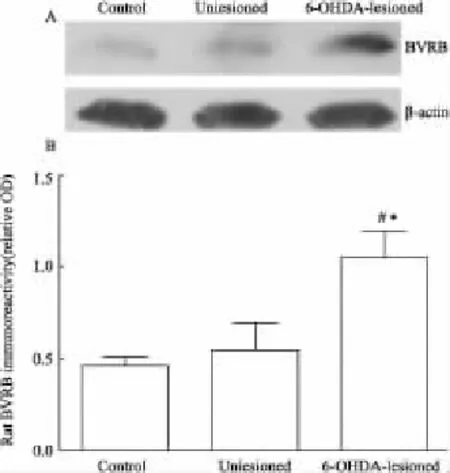
Fig 5 Western blot analysis of nigrostriatal BVRB in control and unilateral 6-OHDA-lesioned rats(±s,n=3)
3 讨论
PD是第二大神经退行性疾病,其主要病理改变为黑质致密部多巴胺能神经元的变性和坏死,导致神经递质多巴胺的不足,最终造成PD特有的运动功能障碍。PD的发病机制至今没有完全阐明,被认可的观点有线粒体功能障碍以及氧化应激[9]。
MPTP及其代谢产物MPP+都是线粒体复合物I抑制剂,MPTP在脑内经单胺氧化酶 B转变为MPP+,由多巴胺转运体选择性地摄入黑质多巴胺能神经元内,抑制线粒体呼吸链复合物Ⅰ活性,使得ATP生成减少,促进自由基生成和氧化应激反应,导致多巴胺能能神经元变性死亡[10]。6-OHDA通过和多巴胺竞争,可与高亲和力的多巴胺转运体结合进入黑质纹状体多巴胺能神经元,并迅速被氧化形成H2O2、超氧化物等活性氧自由基(reactive oxygen species,ROS),生成的大量ROS超出了多巴胺能神经元自身抗氧化清除的能力,从而发挥细胞毒性作用[11]。因此,用 MPTP和6-OHDA制备的 PD模型中均存在氧化应激机制。
BVRB是一个分子量为21 ku的蛋白单体,其作用底物有胆绿素-Ⅸβ,-Ⅸγ和-Ⅸδ,但不包括胆绿素-Ⅸα。BVR是氧化还原循环的重要组成部分。在生理状态下,血红素在血红素加氧酶(heme oxygenase,HO)的催化下,形成胆绿素、一氧化碳和游离铁。胆绿素进一步由胆绿素还原酶还原成胆红素,后者的抗氧化能力比前者强。据研究报道,胆红素能保护细胞免受耐受值1万倍以上的H2O2的损伤[12]。此外,BVR还介导 HO-1的细胞保护作用[13]。BVRB的主要作用则是在胎儿发育早期催化血红素的分解代谢,即它催化胆绿素-Ⅸβ还原成胆红素-Ⅸβ。BVRB生物功能的研究仍处于起步阶段。目前,还未见BVRB在PD模型中的表达变化的相关报道。
本研究主要发现并验证了两种PD模型黑质纹状体系统BVRB的表达变化。MPTP帕金森小鼠模型结果与以往报道的结果一致[5],与正常组相比,模型组BVRB表达明显升高。进一步,我们在6-OHDA帕金森大鼠模型中通过Western blot的方法研究了BVRB的表达。结果显示,6-OHDA帕金森大鼠损毁侧黑质纹状体BVRB的表达较非损毁侧和对照组均明显增高。BVRB表达水平的升高可能是机体对抗脑内氧化应激的一种补偿机制。BVRB可能成为探索PD和氧化应激的新的突破口,有可能成为潜在治疗靶点和生物标志物。本研究发现BVRB和PD有关联性,然而,为了确证BVRB在PD及氧化应激中的作用,需要进一步开展详尽的机制研究。
[1]Fahn S,Sulzer D.Neurodegeneration and neuroprotection in Parkinson disease[J].Neuro Rx,2004,1(1):139 - 54.
[2]袁惠莉,汪 璇,张丽娟,等.中药在防治帕金森病中的作用及研究进展[J].中国药理学通报,2010,26(7):850-4.
[2]Yuan H L,Wang X,Zhang L J,et al.Mechanism and research progress of Chinese traditional medicine in the prevention and treatment of Parkinson's disease[J].Chin Pharmacol Bull,2010,26(7):850-4.
[3]Komuro A,Tobe T,Hashimoto K,et al.Molecular cloning and expression of human liver biliverdin-Ⅸ beta reductase[J].Biol Pharm Bull,1996,19(6):796 -804.
[4]Pereira P J,Macedo-Ribeiro S,Parraga A,et al.Structure of human biliverdinⅨbeta reductase,an early fetal bilirubinⅨbeta producing enzyme[J].Nat Struct Biol,2001,8(3):215 -20.
[5]Zhao X,Li Q,Zhao L,Pu X P.Proteome analysis of substantia nigra and striatal tissue in the mouse MPTP model of Parkinson's disease[J].Proteomics Clin Appl,2007,1(12):1559 -69.
[6]赵 磊,蒲小平.类叶升麻苷对MPTP所致帕金森病小鼠模型的神经保护作用[J].中国药理学通报,2007,23(1):42-6.
[6]Zhao L,Pu X P.Neuroprotective effect of acteoside against MPTP-induced mouse model of Parkinson's disease[J].Chin Pharmacol Bull,2007,23(1):42 -6.
[7]Paxinos G,Watson C,Pennisi M,Topple A.Bregma,lambda and the interaural midpoint in stereotaxic surgery with rats of different sex,strain and weight[J].J Neurosci Methods,1985,13(2):139-43.
[8]孙建栋,苑玉和,刘 岩,等.帕金森病模型大鼠中脑α-突触核蛋白增加[J].中国药理学通报,2010,26(1):73-7.
[8]Sun J D,Yuan Y H,Liu Y,et al.Increased protein level of α-synuclein in the midbrain of Parkinson's disease rat model[J].Chin Pharmacol Bull,2010,26(1):73 -7.
[9]Lin T K,Liou C W,Chen S D,et al.Mitochondrial dysfunction and biogenesis in the pathogenesis of Parkinson 's disease[J].Chang Gung Med J,2009,32(6):589 -99.
[10]Bougria M,Vitorica J,Cano J,Machado A.Implication of dopamine transporter system on 1-methyl-4-phenylpyridinium and rotenone effect in striatal synaptosomes[J].Eur J Pharmacol,1995,291(3):407-15.
[11]Aluf Y,Vaya J,Khatib S,et al.Specific oxidative stress profile associated with partial striatal dopaminergic depletion by 6-hydroxydopamine as assessed by a novel multifunctional marker molecule[J].Free Radic Res,2010,44(6):635 -44.
[12]Baranano D E,Rao M,Ferris C D,Snyder S H.Biliverdin reductase:a major physiologic cytoprotectant[J].Proc Natl Acad Sci USA,2002,99(25):16093-8.
[13]Pachori A S,Smith A,McDonald P,et al.Heme-oxygenase-1-induced protection against hypoxia/reoxygenation is dependent on biliverdin reductase and its interaction with PI3K/Akt pathway[J].J Mol Cell Cardiol,2007,43(5):580 -92.
[14]Chinta S J,Andersen J K.Redox imbalance in Parkinson's disease[J].Biochim Biophys Acta,2008,1780(11):1362 -7
