霉酚酸酯对实验性自身免疫性脑脊髓炎大鼠血CD4+CD25+T细胞的影响
2011-05-31朱正禹谢兆宏毕建忠
朱正禹,谢兆宏,由 玮,毕建忠,王 萍
(山东大学第二医院神经内科,山东济南 250033)
多发性硬化(multiple sclerosis,MS)是中枢神经系统常见的炎性脱髓鞘性疾病,其病因和发病机制复杂,一般认为是遗传易感个体与环境因素相互作用而发生的自身免疫性疾病,以髓鞘脱失、神经胶质增生、不同程度的轴索病变和进行性神经功能紊乱为主要特点[1]。实验性自身免疫性脑脊髓炎 (experimental autoimmune encephalomyelitis,EAE)的病理学、免疫学和临床表现与MS极为相似,是公认的研究MS免疫病理学机制及其实验性治疗的最佳动物模型[2]。CD4+CD25+T细胞是调节性T细胞的亚群之一,能抑制自身反应性T、B细胞的活化增殖以及免疫球蛋白的产生[3]。大量的实验表明CD4+CD25+T细胞的减少或功能降低会导致自身免疫性疾病的发生。霉酚酸酯(mycophenolate mofetil,MMF)是一种选择性抑制T、B淋巴细胞增生的新型免疫抑制剂,副作用小,现临床主要用于预防器官移植的急慢性排斥反应[4],及系统性红斑狼疮等自身免疫性疾病的治疗[5]。本研究采用EAE大鼠作为动物模型,给予不同剂量MMF及甲基强的松龙治疗,观察药物缓解大鼠临床症状的效果及对大鼠血CD4+CD25+T细胞的影响,探讨MMF治疗EAE的可能机制。
1 材料与方法
1.1材料
1.1.1实验动物健康♀ Wistar大鼠50只,体质量180~220 g,6~8周龄,由山东大学实验动物中心提供;健康♀ 豚鼠15只,体质量350~400 g,由济南中兴旺养殖中心提供。均于山东大学第二医院实验动物中心动物房在恒温22℃、相对湿度0.65~0.70、光照周期12 h环境中,用标准混合饲料(由山东大学实验动物中心提供)适应性饲养1周后进入实验。
1.1.2主要试剂与仪器霉酚酸酯购自上海罗氏制药有限公司;甲基强的松龙购自大连辉瑞制药有限公司;百日咳杆菌抗原购自中国药品生物制品检定所;CD4-FITC单标抗体、CD4-FITC/CD25-PE双标抗体以及相应的对照抗体由美国BD公司提供;流式细胞仪由美国BD公司提供。
1.2方法
1.2.1EAE大鼠模型制备
1.2.1.1完全抗原的制备 取液体石蜡40 ml、羊毛脂20 g混合,加热并融化制得不完全弗氏佐剂(Incomplete Freund Adjuvant,IFA),分装入 10 ml小瓶高压灭菌后4℃冰箱保存。豚鼠用体积分数为0.1的水合氯醛 350 mg·kg-1腹腔注射至四肢瘫软,无菌状态下剪开胸腔、剥离心包,质量浓度为0.009生理盐水左心室灌注直至肝脏变白,迅速取其脊髓,小心剥离脊膜后称重,加入等量生理盐水,制成体积分数为0.5(W/V)的全脊髓匀浆(guinea pig spinal cord homogenate,GPSCH)。同时融化 IFA,1 ml IFA加入约10 mg的卡介苗,即制得完全弗氏佐剂(Complete Freund Adjuvant,CFA)。将 CFA 与 GPSCH等体积混合,在冰上用注射器反复抽推,制成油包水乳液,制成完全抗原,放置冰上备用。
1.2.1.2模型制备 健康♀ Wistar大鼠50只,随机取6只作为正常对照组,其余44只造模。44只大鼠四肢足垫皮下及颈部皮下分别注射完全抗原(GPSCH/CFA)0.1 ml,即0.5 ml/只,足背皮内注射百日咳杆菌抗原0.01 ml/只(含3.0×109个菌体);6只对照大鼠四肢足垫皮下及颈部皮下分别注射等量的生理盐水/CFA乳液。免疫当日记为0 d。
1.2.2动物模型鉴定
1.2.2.1神经功能评分 免疫当日和免疫后所有动物每日进行神经功能评分(Duckers评分)[6]0分:不发病;1分:尾部张力降低或轻度步态笨拙;2分:尾部无张力和(或)后肢中度无力;3分:双侧后肢麻痹;4分:后肢麻痹伴前肢力弱或麻痹;5分:因EAE而濒临死亡或死亡。评分≥1分为造模成功。
1.2.2.2脑、脊髓组织病理检查 模型大鼠采用体积分数为0.1的水合氯醛腹腔麻醉后灌注处死。分别取脊髓颈膨大、胸段、腰膨大及全脑,体积分数为0.04的多聚甲醛固定,梯度酒精脱水,石蜡包埋、切片,HE染色后光镜观察。
1.2.3动物分组及药物治疗方法造模成功且存活的大鼠共25只,与6只对照大鼠共分为5组,在实验d 15给药。MMF大剂量组(n=6)给予30 mg·kg-1·d-1灌胃;MMF 小剂量组(n=6)给予 20 mg·kg-1·d-1)灌胃;甲基强的松龙组(n=6)给予30 mg·kg-1·d-1尾静脉注射;模型组(n=7)及正常对照组(n=6)每天给予等量生理盐水灌胃。给药时间均为14 d。
1.2.4监测指标
1.2.4.1神经功能评分 给药后每天观察记录神经功能评分。
1.2.4.2血 CD4+CD25+T细胞比例观察 在实验d 29,将大鼠以水合氯醛腹腔麻醉后,心脏穿刺取血,EDTA抗凝并在6 h内进行分析;用FITC标记的抗CD4单抗、CD4-FITC/CD25-PE双标抗体进行荧光抗体标记后,利用流式细胞仪检测CD4+T细胞、CD4+CD25+T细胞的百分数。
1.2.4.3脑、脊髓组织病理检查 心脏取血后立即心脏灌注处死动物,取脊髓及全脑,HE染色后光镜观察。
1.3统计学处理采用SPSS13.0软件行方差分析,数据以±s表示。
2 结果
2.1EAE模型成功率及神经功能评分经生理盐水/CFA免疫的6只对照大鼠未出现症状,体重持续增长,活动度正常。经完全抗原免疫的44只大鼠有32只发病,其中1分:8只;2分:7只;3分:7只;4分:3只;5分:7只,发病率为72.1%。麻醉意外及免疫后急性期死亡4只,评分5分的大鼠在发病达高峰时死亡。造模成功且存活的大鼠为25只,免疫后d 12首例出现临床症状,以后发病数逐渐增多,多数在d 12~15出现症状,症状出现后d 3~4发病达高峰。症状先表现为尾部张力减低,随后出现活动减少,食欲不振,体重明显下降,毛色晦暗,双后肢麻痹,严重者发展为四肢瘫痪,喂食时咀嚼无力,不能进水,尿便障碍至濒临死亡。
2.2治疗后EAE模型大鼠的神经功能评分实验d 17即有治疗组EAE大鼠临床症状出现缓解,后缓解大鼠逐渐增多,大鼠麻痹、瘫痪的四肢逐渐恢复,摄食摄水量增多,活动增加甚至活动灵敏度接近正常。模型组大鼠症状多在实验d2 0后开始缓解,缓解时间拖后,缓解速度及程度均较治疗组小。随着临床症状的缓解,EAE模型大鼠体重也逐渐增加。见Tab 1。
Tab 1 Duckers scores of the rats after treatment(±s)

Tab 1 Duckers scores of the rats after treatment(±s)
▲▲P <0.01 vs model group;★P <0.05 vs Methylprednisolone group.
Group n Duckers score 15 d 18 d 21 d 24 d 27 d Control 6 0 0 0 0 0 Model 7 2.1 ±1.0 2.6 ±1.1 2.9 ±1.2 2.0 ±1.1 2.0 ±1.2 Methylprednisolone 6 2.0 ±1.2▲▲ 1.8 ±1.1▲▲ 1.6 ±0.9▲▲ 1.4 ±0.8▲▲ 1.2 ±1.1▲▲Low dose of MMF 6 2.1 ±1.1▲▲ 1.8 ±0.9▲▲ 1.5 ±1.0▲▲ 1.3 ±1.1▲▲ 1.1 ±1.3▲▲High dose of MMF 6 2.0 ±1.4▲▲★ 1.7 ±1.0▲▲★ 1.4 ±1.2▲▲★ 1.0 ±0.9▲▲★ 0.8 ±1.2▲▲★
2.3病理学改变造模成功的EAE大鼠组织病理学主要表现为神经髓鞘肿胀、崩解、脱失。脑部的病灶主要分布于白质内,脑室周围多见,呈不规则形,以小静脉为中心,周围为多层炎细胞浸润,形成“血管套”样改变。脊髓的损害较脑为重,以腰骶段最为明显,白质较灰质明显。对照组的神经组织病理检查未见异常,这与此组未出现临床症状吻合。治疗后各组大鼠脑和脊髓组织病理学改变与模型组相比,均有不同程度减轻,病灶区域的炎性浸润细胞数及“血管套”样改变明显少于模型组,以MMF大剂量组改变最明显(Fig 1)。
2.4各组血CD4+T细胞、CD4+CD25+T细胞的百分率比较与对照组相比EAE大鼠血CD4+T细胞百分数明显增加(P<0.01);与模型组相比,经MMF及甲基强的松龙治疗的各组血CD4+T细胞百分数均下降,其中 MMF大剂量组疗效明显优于MMF小剂量组和甲基强的松龙组(P<0.01);与模型组相比,治疗后各组EAE大鼠血CD4+CD25+T细胞比例均提高,且MMF大剂量组比MMF小剂量组和甲基强的松龙组增高明显,差异有显著性(P<0.01),MMF小剂量组和甲基强的松龙组差异无显著性。见Tab 2,Fig 2。
Tab 2 Percentage of blood CD4+T cells,CD4+CD25+T cells of the rats after treatment(%,±s)

Tab 2 Percentage of blood CD4+T cells,CD4+CD25+T cells of the rats after treatment(%,±s)
▲▲P<0.01 vs control group;★★P<0.01 vs model group;◆◆P<0.01 vs Methylprednisolone group
▲▲★★◆◆
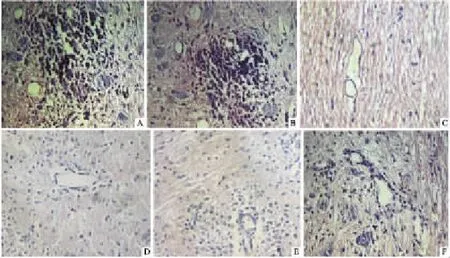
Fig 1 HE staining of spinal cord myelin(×200)
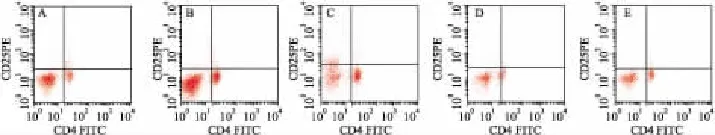
Fig 2 Percentage of blood CD4+CD25+T cells of the rats after treatment
3 讨论
EAE具有与人类MS极为相似的病理学、免疫学和临床特征,是研究MS的理想动物模型[7]。本实验采用我国常见的Wistar♂大鼠来制作EAE动物模型,造模成功率为72.1%,与李勇等[8]的报道(40% ~50%)相比发病率较高,可能与造模季节、动物品系、卡介苗用量、百日咳杆菌的浓度、免疫部位及完全抗原的注射量均有关。造模成功后脑脊髓组织切片HE染色可见急性血管炎伴周围髓鞘脱失,小静脉周围有大量炎细胞浸润,形成“血管套”,白质多于灰质,与国内外报道基本一致。
在MS发病机制及病情演化中,细胞免疫与体液免疫均参与了病理免疫过程,免疫异常及免疫细胞的网络调节紊乱是其发病的机制,因此应用免疫抑制类药物是MS治疗的主要手段,目前尚无理想药物。MMF是霉酚酸(MPA)的2-乙基酯类衍生物,主要药理作用抑制淋巴细胞与单核细胞增殖,减少抗体的产生,抑制细胞表面黏附分子的合成发挥抗炎作用[9]。MMF比其他常规应用的免疫抑制剂(如环磷酰胺、硫唑嘌呤等)具有更小细胞毒性的优势。MMF起初用于移植后免疫排斥反应,现在越来越多地用于治疗结缔组织病及神经免疫性疾病如重症肌无力、多发性神经病等,亦有联合干扰素-β 1a(interferon beta 1a)治疗MS的临床试验显示MMF具有良好的治疗作用及耐受性[10]。
CD4+CD25+T细胞是一类调节性细胞,是在胸腺细胞正常分化时由CD4+CD8+双阳性细胞向CD4+CD8-单阳性细胞转变过程中形成的,在抑制自身反应性细胞增殖、维持免疫环境的稳定方面起着重要作用。CD4+CD25+T细胞数量的减少、抑制功能的受损和(或)表面分子表达的缺陷,都可能导致自身免疫病的发生。McGeachy等[11]报道CD4+CD25+T细胞的减少会阻碍EAE模型大鼠的自然恢复过程,同时还发现如果模型大鼠恢复后再人为减少CD4+CD25+T细胞数则会导致EAE复发,接受中枢神经源性CD4+CD25+T细胞移植的大鼠则不会被诱导成为EAE模型。
本研究发现与模型组相比,治疗组大鼠神经功能评分均有所下降,脑和脊髓组织病理学改变均有不同程度减轻,MMF大剂量组疗效优于MMF小剂量组和甲基强的松龙组。与对照组相比,各组EAE大鼠CD4+T细胞比例均增加(P<0.01),治疗后EAE大鼠CD4+T细胞比例下降,MMF大剂量组比MMF小剂量组和甲基强的松龙组降低更明显,差异有显著性(P<0.01);与模型组相比,治疗后各组大鼠血CD4+CD25+T细胞均有所提高,且MMF大剂量组比MMF小剂量组和甲基强的松龙组增高明显,差异有显著性(P<0.01),MMF小剂量组和甲基强的松龙组差异无显著性。推测EAE发病可能与CD4+T细胞增生、CD4+CD25+T细胞比例减少有关。实验结果表明,MMF作为一种免疫调节剂可以抑制CD4+T细胞增殖,降低CD4+T细胞百分数,同时可诱导 CD4+CD25+T细胞百分数增加,修补EAE大鼠的免疫缺陷,使其免疫系统更好的处理自身反应的淋巴细胞。其机制可能与细胞间直接接触及抑制性细胞因子IL-10、TGF-β等的参与有关,也可能是通过激活转录因子Foxp3,增强CD4+CD25+T细胞活性来实现的,具体机制有待进一步阐明。本实验为探索EAE发病的特点及免疫抑制剂治疗MS提供了新的实验依据。
[1]Hafler D A,Slavik J M,Anderson D E,et al.Multiple sclerosis[J].Immunol Rev,2005,204:208 -31.
[2]Diab A,Deng C,Smith J D,et al.Peroxisome proliferator-activated receptor-gamma agonist 15-deoxy-Delta(12,14)-prostaglandin J(2)ameliorates experimental autoimmune encephalomyelitis[J].Immunol,2002,168(5):2508 -15.
[3]Nakamura K,Kitani A,Strober W.Cell contact-dependent immunosuppression by CD4(+)CD25(+)regulatory T cells is mediated by cell surface-bound transforming growth factor beta[J].ExpMed,2001,194(5):629 -44.
[4]Pageaux G P,Rostaing L,Calmus Y,et al.Mycophenolate mofetil in combination with reduction of calcineurin inhibitors for chronic renal dysfunction after liver transplantation[J].Liver Transpl,2006,12(12):1755 -60.
[5]Adu D,Gross J,Jayne D R.Treatment of systemic lupus erythematosus with mycophenolate mofetil[J].Lupus,2001,10(3):203 -8.
[6]Goldblum R.Therapy of rheumatoid arthritis with mycophenolate mofetil[J].Clin Exp Rheumatol,1993,11(suppl 8):s117 - 9.
[7]Swanborg R H.Experimental autoimmune encephalomyelitis in rodents as a model for human demyelinating disease[J].Clin Immunol Immunopathol,1995,77(1):4 - 13.
[8]李 勇,郑荣远,李剑敏,等.实验性变态反应性脑脊髓炎大鼠模型的复制[J].中国病理生理杂志,2005,21(2):414 -6.
[8]Li Y,Zheng R Y,Li J M,et al.Establishment of the model of experimental allergic encephalomyelitis in Wistar rats[J].Chin JPathophysiol,2005,21(2):414 -6.
[9]张 燕,崔 莉,陈 兵,关广聚.霉酚酸酯对糖尿病大鼠肾小管-间质损伤的保护作用[J].中国药理学通报,2007,23(6):777-81.
[9]Zhang Y,Cui L,Chen B,Guan G J.Protective effect of mycophenolate mofetil on renal tubulo-interstitium in diabetic rats[J].Chin Phamacol Bull,2007,23(6):777 -81.
[10]Frohman E M,Cutter G,Remington G,et al.A randomized,blinded,parallel-group,pilot trial of mycophenolate mofetil(Cell-Cept)compared with interferon beta-1a(Avonex)in patients with relapsing-remitting multiple sclerosis[J].Ther Adv Neurol Disord,2010,3(1):15 -28.
[11]McGeachy M J,Stephens L A,Anderton S M.Natural recovery and protection from autoimmune encephalomyelitis:contribution of CD4+CD25+regulatory cells within the central nervous system[J].Immunol,2005,175(5):3025 -32
