山茱萸最佳配伍组分对高糖致ECV304细胞氧化损伤的保护作用
2011-05-31许惠琴农伟虎刘成鼎吴佳蕾
许惠琴,农伟虎,刘成鼎,李 莉,刘 洪,刘 斌,吴佳蕾
(1.南京中医药大学药学院,2.江苏省中药药效与安全性评价重点实验室,江苏南京 210046)
目前认为,糖代谢紊乱、活性氧失衡、血管活性物质、遗传因素及生长因子在糖尿病血管病变的发生发展中都起着重要作用,其中活性氧的作用日益受到重视[1]。已往的实验观察到血管内皮细胞在高糖环境中损伤明显,细胞形态及细胞周期均发生明显的改变[2-3]。为此,本实验通过观察 ECV304细胞在高浓度葡萄糖作用下超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)及活性氧(ROS)的变化,研究山茱萸最佳配伍组分保护血管内皮细胞的作用机制。
1 材料
1.1药物及试剂山茱萸药材购于河南西峡,经我校中药鉴定教研室吴德康教授鉴定为山茱萸科植物山茱萸Cornus officinalis Sieb.etZucc.的干燥成熟果肉。
山茱萸有效部位的制备:环烯醚萜苷:药材500 g加12倍量的水提取2次,每次2 h,滤液70%乙醇醇沉,静置24 h以上,过滤。将上清液加水定容至0.5 g生药/ml,上大孔树脂用12倍量10%乙醇3.5 BV/h洗脱,洗脱液浓缩,减压干燥至恒重,得到山茱萸环烯醚萜总苷24.9588 g(纯度马钱苷25.01%;莫诺苷15.16%;二苷总和40.17%);三萜酸:将水提后药渣沥干,按1∶6(溶剂:未水提之前的药材质量)95%乙醇在85℃,提取2次,旋转蒸发除去溶剂,真空干燥得干浸膏。将干浸膏用10%NaOH洗涤,再用等倍量的酸性水溶液沉淀得三萜酸浸膏1.1692g(纯度58%);多糖:将水提醇沉的药渣在0.15 Mpa,35℃超滤,于60℃真空干燥至恒重,得到山茱萸总多糖提取物36.8694 g(纯度55.93%),然后用分子筛筛选得到1 000~60 000 ku的多糖(经实验证明为最具活性的多糖部分)。
经前期正交设计实验发现山茱萸防治糖尿病血管病变的最佳有效部位配比是环烯醚萜苷(A)∶三萜酸(B)∶多糖(C)为2∶1∶2(该比例折合山茱萸中所含份量表示,以下用A2B1C2表示)。
注射用盐酸川芎嗪(川青),哈尔滨三联药业有限公司,批号:090812。RPMI 1640培养基,Gibco,USA,lot NO:461418。碳酸氢钠,上海试剂四厂,批号:20000910。小牛血清(FBS),杭州四季青生物工程材料有限公司,批号:080405。胰蛋白酶(Trypsin),MERCK,USA,批号:0428S05。乙二胺四乙酸二钠(EDTA),国药集团化学试剂有限公司,批号:F20070919。磷酸盐缓冲溶液,中杉金桥。葡萄糖,中国医药(集团)上海化学试剂有限公司,批号:F20070919。超氧化物歧化酶(SOD)试剂盒,批号:20100119;丙二醛(MDA)试剂盒,批号:20100119;谷胱甘肽过氧化物酶(GSH-Px)试剂盒,批号20100119,南京建成生物工程研究所提供。
2',7'-二氯氢化荧光素二脂(2',7'-dichlorofluorescin-diacetate,DCFH-DA),碧云天生物技术研究所,批号:S0033。
1.2动物及细胞株清洁级SD大鼠,220~240 g,由浙江省实验动物中心提供,实验动物生产许可证:SCXK(苏)2002-0027。ECV304,引自南京中医药大学基础医学院,由本实验室复苏、传代保存。
1.3仪器DKB-8A型电热恒温水槽,上海精宏实验设备有限公司。NAPCO5410型 CO2培养箱,PERCISION SCIENTIFIC。XSZ-D2型倒置显微镜,重庆光学仪器厂。LDZ5-2医用离心机,北京医用离心机厂。TCS SP5型激光共聚焦显微镜,德国Leica公司。TU-1800S型紫外可见分光光度计,北京普析通用仪器有限责任公司。
2 方法
2.1含药血清的制备取SD大鼠,给药剂量为116 mg·kg-1,每天灌胃给药1次,每次给药容积为10 ml·kg-1;另设空白对照组每天灌服等体积蒸馏水。连续给药5 d后禁食8 h,于d 6末次给药1 h后颈动脉取血,4℃静置 4 h,3 000 r·min-1离心 20 min,分离血清,于56℃水浴中灭活补体30 min,经0.22 μm微孔滤器除菌,-20℃保存备用。以此作为山茱萸有效部位最佳配伍组分高剂量组,稀释一半作为其最佳配伍组分低剂量组。
2.2细胞培养及给药将ECV304细胞接种至24孔(每孔1 ml)培养板内,加入10%FBS RPMI 1640培养液,在37℃、5%CO2饱和湿度培养箱内培养。待细胞融合80% ~90%,换液加入RPMI 1640培养液,24 h后吸去上清,加含30 mmol·L-1高糖的RPMI 1640培养液。然后各组分别加入A2B1C2含药血清低、高剂量和川芎嗪,培养48 h。
2.3细胞培养上清液中SOD、MDA和GSH-Px的测定培养48 h后取细胞上清液,按试剂盒说明书测定SOD、MDA和GSH-Px。
2.4细胞内ROS的测定吸弃培养上清后,将10 μmol·L-1DCFH-DA 400 μl加到细胞板中,37℃继续培养20 min。吸弃上清,加无血清RPMI 1640培养液400 μl,用激光共聚焦显微技术(激发波长488 nm,发射波长525 nm)分别检测各组的荧光强度。
2.5统计学方法计量资料以±s表示,数据用SPSS11.5软件包进行处理,组间比较方差齐性的采用LSD,方差不齐者采用秩和检验。
3 结果
3.1对SOD、MDA和GSH-Px的影响采用黄嘌呤氧化酶法于550 nm处测定SOD的活力。实验结果显示,30 mmol·L-1高糖环境下SOD酶活性降低(P<0.01),而A2B1C2含药血清两个剂量组均能提高此活力,与高糖组比较差异具有显著性(P<0.01)。
根据过氧化脂质降解产物中的MDA可与硫代巴比妥酸(TBA)缩合,形成红色产物,在532 nm处有最大吸收峰的原理,采用TBA法于532nm处测定MDA的含量。实验结果显示,高糖环境下,细胞上清液中MDA含量增加(P<0.01),而A2B1C2高、低剂量组含药血清能降低其含量,与高糖组相比差异有显著性(P<0.01,P<0.05)。
根据GSH-Px可促进过氧化氢与GSH反应生成GSSG的原理,通过测定酶促反应中GSH的消耗速度来反映GSH-Px的活力。实验结果显示,30 mmol·L-1高糖环境下,GSH-Px活性降低(P<0.01),而A2B1C2高、低剂量组含药血清能提高此活力,与高糖组比较差异具有显著性(P<0.01,P<0.05),见Tab 1。
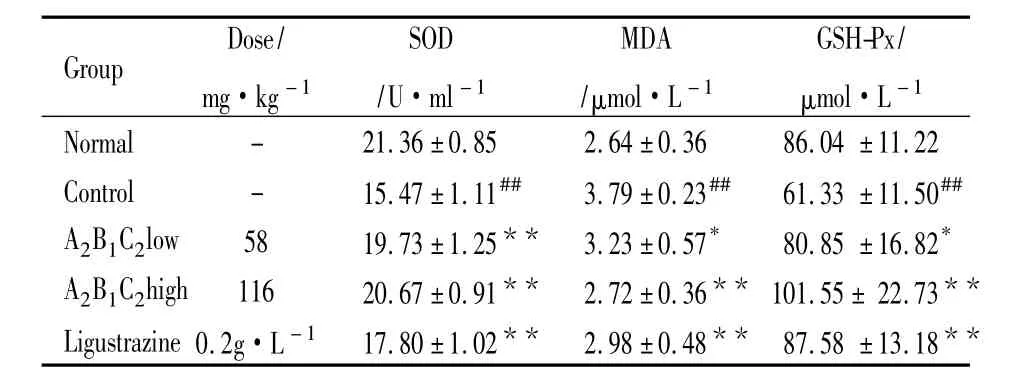
Tab 1 Effect of the best compatibility of components in Fruetus Corni on the activity of SOD,MDA and GSH-Px in ECV304 cultured in high glucose medium(n=8)
3.2对ROS的影响根据DCFH-DA进入细胞后的水解产物DCFH可以被细胞内活性氧氧化为有荧光的DCF,通过检测DCF的荧光强度来反映细胞内ROS的水平。实验结果显示,30 mmol·L-1高糖增加ROS含量,而A2B1C2高、低剂量组含药血清能减少ROS水平,与高糖组比较差异具有显著性(P<0.01,P<0.05),结果见 Tab 2,Fig 1。
4 讨论
山茱萸中相关活性成分主要是五环三萜酸、总苷及多糖。既往研究发现[4-5],山茱萸乙酸乙酯提取部位、乙醇提取液具有降低血糖和升高胰岛素水平。山茱萸环烯醚萜苷对糖尿病血管病变大鼠,能保护胸主动脉内皮、减少尿微量白蛋白的排出、下调肾皮质RAGE及TGF-β mRNA的表达,保护血管内皮及抗肾小球内基质增生、基底膜增厚等作用[6-9]。山茱萸多糖具有抗氧化作用[10-11]。据此,实验室将山茱萸有效部位环烯醚萜苷、多糖和三萜酸加以配伍组合,试图观察在抗糖尿病血管病变上是否具有增强作用及何种比例获得最佳效果。结果在前期实验中,通过高糖对血管内皮细胞的增殖反应和对四氧嘧啶糖尿病小鼠的肾脏保护作用,筛选得到山茱萸最佳配伍组合为环烯醚萜苷∶三萜酸∶多糖比例是2∶1∶2。因此本实验试图从抗氧化水平的角度,分析山茱萸最佳配伍组合保护糖尿病血管病变的作用机制。

Fig 1 Effect of the best compatibility of components in Fruetus Corni on the ROS levels in ECV304 cultured in high glucose medium

Tab 2 Effect of the best compatibility of components in Fruetus Corni on the ROS levels in ECV304 cultured in high glucose medium(n=6)
有研究表明在长期高糖环境下,能诱导细胞发生多重代谢障碍,导致大量ROS堆积,细胞内的氧化应激增加,造成肾脏损伤,同时ROS又可激活炎症过程刺激信号的传递介质如NF-κB途径而损伤肾脏[12-13]。MDA是脂质过氧化反应的产物之一,常常可反映脂质过氧化的程度[14],间接反映出机体细胞受自由基攻击的严重程度。而此时机体内抗氧化物质如SOD、GSH-Px等活性降低,明显削弱了机体清除自由基的能力。本实验研究证实,30 mmol·L-1浓度葡萄糖刺激血管内皮细胞后,ROS与MDA水平较正常组有明显提高(P<0.05,P<0.01),SOD、GSH-Px活性明显降低(P<0.01),显示高糖可通过氧化应激反应损伤血管内皮细胞。在应用山茱萸最佳配伍组合后,对上述指标具有明显的逆转作用,且高剂量组优于低剂量组。其保护血管内皮细胞主要通过以下2种途径:①抑制ROS的生成,减少各种氧自由基对细胞的氧化损伤;②增强SOD、GSH-Px等抗氧化酶系统的活性,对抗氧自由基和脂质过氧化物对细胞的毒害作用,保护细胞膜结构和功能的完整性。总之,本实验研究表明山茱萸最佳配伍组合是通过抑制高糖所致的氧化应激,达到防治糖尿病血管病变的目的。
[1]Ceriello A,Motz E.Is oxidative stress the pathogenic mechanism underlying insulin resistance,diabetes,and cardiovascular disease?The common soil hypothesis revisited[J].Arterioscler Thromb Vasc Biol,2004,24(5):816 -23.
[2]McGinn S,Saad S,Poronnik P,et al.High glucose-mediated effects on endothelial cell proliferation occur via p38 MAP kinase[J].Am J Physiol Endocrinol Metab,2003,285(4):E708 -17.
[3]张春晶,于海涛,孙 艳,等.谷氧还蛋白1对高糖诱导的血管内皮细胞凋亡保护作用的研究[J].医学研究杂志,2009,38(6):38-41.
[3]Zhang C J,Yu H T,Sun Y,et al.Protective effect of glutaredoxin 1 on the high glucose-induced apoptosis in cultured vascular endothelial cells[J].J Med Res,2009,38(6):38 - 41.
[4]陈 霞,沈爱宝,钱东升.山茱萸不同提取部位对小鼠血糖的影响[J].南通医学院学报,2004,24(2):365 -6.
[4]Chen X,Shen A B,Qian D S.Experimental study of extraction at different location from Fruetus Corni in hypoglycemic effects[J].Acta Acad Med Nantong,2004,24(2):365-6.
[5]钱东生,罗 琳,何 敏,等.山茱萸乙醇提取液对Ⅱ型糖尿病大鼠的治疗效应[J].南通医学院学报,2000,20(4):337.
[5]Qian D S,Luo L,He M,et al.Therapeutic effect of alcohol extract of Cornus officinalis Sieb.Et Zucc on type-2 diabetic mellitus rats[J].Acta Acad Med Nantong,2000,20(4):337.
[6]Xu H Q,Hao H P,Zhang X,et al.Morroniside protects cultured human umbilical vein endothelial cells from damage by high ambient glucose[J].Acta Pharmacol Sin,2004,25(4):412 - 5.
[7]Xu H Q,Hao H P.Effects of iridoid total glycoside from Cornus officinalis on prevention of glomerular overexpression of transforming growth factor beta 1 and matrixes in an experimental diabetes model[J].Biol&Pharma Bull,2004,27(7):1014 -8.
[8]Xu H Q,Shen J,Liu H,et al.Morroniside and loganin extracted from Cornus officinalis have protective effects on rat mesangial cell proliferation exposed to advancedglycation end products by preventing oxidative stress[J].Can J Physiol Pharmacol,2006,84(12):1627-273.
[9]许惠琴,刘 洪,沈 健,时 艳.山茱萸环烯醚萜总苷对AGEs培养肾小球系膜细胞的影响[J].中国药理学通报,2006,22(4):432 -6.
[9]Xu H Q,Liu H,Shen J,Shi Y.Influence of iridosides of cornus officinalis on glomerular mesangial cells cultured with AGEs[J].Chin Pharmacol Bull,2006,22(4):432 -6.
[10]苗明三,杨 云.山茱萸多糖抗氧化作用研究[J].河南中医,2002,22(1):66 -7.
[10]Miao M S,Yang Y.The antioxidant effect of Cornus officinalis polysaccharide[J].Henan Trad Chin Med,2002,22(1):66 -7.
[11]李 平,王艳辉,马润宇.水提山茱萸多糖的理化性质及抗氧化活性研究[J].食品科学,2003,24(7):133-7.
[11]Li P,Wang Y H,Ma R Y.Study of water extract of Fruetus Corni polysaccharide on physical and chemical properties and antioxidant activity[J].Food Sci,2003,24(7):133 -7.
[12]Lee E A,Seo J Y,Jiang Z,et al.Reactive oxygen species mediate high glucose-induced plasminogen activator inhibitor-1 up-regulation in mesangial cells and in diabetic kidney[J].Kidney Int,2005,67(5):1762 -71.
[13]Kanwar Y S,Wada J,Sun L,et al.Diabetic nephropathy:mechanisms of renal disease progression[J].Exp Biol Med,2008,233:4-11.
[14]Ilhan N,Halifeoglu I,Ozercan H I.Tissue malondialdehyde and adenosine triphosphatase level after experimental liver ischaemiareperfusion damage[J].Cell Biochem Funct,2001,19:207 -12.
