丹酚酸A对缺血/再灌注心肌的保护作用研究
2011-05-31杨秀颖强桂芬杜冠华
杨秀颖,强桂芬,张 莉,杜冠华
(1.中国协和医科大学中国医学科学院药物研究所,北京 100050;2.航天中心医院,北京 100049)
心肌缺血/再灌注引起的损伤是导致心肌缺血患者猝死的重要原因[1]。1960 年,Jennings[2]第一次提出心肌再灌注损伤的概念,即缺血心肌恢复血流后损伤反而加重。引起再灌注损伤的主要机制是自由基过多,细胞内钙超载,pH反常,补体系统激活等。心肌细胞损伤可导致心肌梗死,心律失常,线粒体氧化磷酸化功能障碍,心肌细胞收缩能力丧失。减少自由基的生成,抑制氧化和过氧化反应进行,降低细胞内钙,改善缺血组织的代谢,抑制细胞凋亡是防治心肌缺血/再灌注性损伤的重要途径[3-4]。
丹酚酸A(Salvianolic acid A,SalA)是丹参中水溶性有效成分之一,具有很强的抗氧化作用,能捕捉氧自由基,降低钙超载[5],因此丹酚酸A对心肌缺血/再灌注损伤可能具有一定的保护作用。以往的一些研究也提示丹酚酸A对缺血/再灌注具有保护作用[6-7]。但丹酚酸A对在体状态下心肌缺血/再灌注性心律失常的影响及机制研究还未见报道。为进一步了解丹酚酸A对心肌缺血/再灌注所引起损伤的影响,本研究采用大鼠心肌缺血/再灌注心律失常模型和乳鼠心肌细胞缺氧-复氧模型观察了丹酚酸A对缺血/再灌注性损伤的作用,并对其机制进行了探讨。
1 材料与方法
1.1材料
1.1.1动物Sprague Dawley(SD)大鼠,♂,200~250 g,SPF级,北京维通利华实验动物技术有限公司。许可证编号:SCXK(京)2002-0003。SD大鼠乳鼠,出生2~3 d,中国医学科学院动物研究所提供。
1.1.2药品和试剂丹酚酸A,中国医学科学院药物研究所克莱博公司制备,纯度>90%。利多卡因注射液购自山东华鲁制药有限公司;心肌酶谱测试盒购自北京中生北控生物科技股份有限公司;ATP检测试剂盒:Cell Titer-GloTM Luminescent Cell Viability Assay,美国Promega公司。
1.1.3实验仪器小动物人工呼吸机:ALC-V8B,上海奥尔科特生物科技有限公司;心电监护仪:BL-420S生物机能实验系统,成都泰盟科技有限公司;多孔板多功能检测仪(Spectra Max M5,Molecular Devices)。
1.2方法
1.2.1实验分组大鼠随机分为6组:空白组、假手术组、模型组、阳性药组(利多卡因注射液5 mg·kg-1)、丹酚酸 A 组(1.5 mg·kg-1)、丹酚酸 A 组(0.5 mg·kg-1),每组6 只动物。
1.2.2大鼠心肌缺血/再灌注手术方法SD大鼠25%乌拉坦(0.5 ml/100 g)麻醉。开胸,剪开心包膜,暴露心脏。在冠状动脉左前降支下穿线,位置在肺动脉圆锥和左心耳之间。给药组结扎前10 min给药,拉紧结扎线,使心电图ST段和G点抬高。10 min后,松开结扎线,记录心电变化。
1.2.3心肌缺血/再灌注大鼠心电记录及结果分析
以标准Ⅱ导联记录心电活动情况。心律失常评分标准:按照Lambeth会议标准评分。0分:无心律失常;1分:偶发室性早搏(3次/min以下);2分:频发室性早搏(3次/min或以上);3分:偶发室性心动过速(3次/min以下);4分:频发室性心动过速(3次/min或以上)或偶发性心室纤颤(3次/min以下);5分:频发心室纤颤(3次/min或以上)或死亡[8]。
1.2.4缺血/再灌注大鼠心肌酶活性测定再灌注2 h后股动脉取血分离血清。肌酸激酶(CK)测试采用连续监测法(N-乙酰半胱氨酸法),肌酸激酶同工酶MB(CK-MB)测试采用免疫抑制法,乳酸脱氢酶(LDH)测试采用连续监测法。心肌酶谱的测定原理及方法参见北京中生北控生物科技股份有限公司心肌酶谱测试盒说明书。
1.2.5大鼠心肌细胞的体外培养SD大鼠乳鼠出生2~3 d,断头处死,体积分数为0.75乙醇消毒,无菌条件下取出心脏,剪去心房,保留心室。胰蛋白酶消化离心后,弃上清。含体积分数为0.2的胎牛血清DMEM/F12重悬,接种到50 ml玻璃培养瓶中,平放,37℃ CO2孵箱中孵育1~2 h,勿震荡,小心吸出细胞悬液,计数,接种到96孔板中培养。
1.2.6大鼠心肌细胞缺氧-复氧损伤SD大鼠乳鼠心肌细胞,种于96孔细胞培养板中,待细胞融合后实验。加入氮气饱和后的缺氧液(mmol·L-1,NaH2PO40.9、NaHCO36.0、CaCl21.0、MgSO41.2、乳酸钠40、HEPES 20、NaCl 98.5、KCl 10,pH 6.8,预先用高浓度氮饱和30 min)100 μl,缺氧液加入不同浓度的丹酚酸A,将培养板置入密封袋中,37℃持续充入氮气1 h。取体积分数分别为0.95的O2和0.05的CO2饱和的无血清DMEM培养基,加入与缺氧液相同浓度的丹酚酸A,细胞培养板弃上清,加入上述饱和好的无血清DMEM培养基,重新将培养板置入密封袋中,其间持续充入氧气2 h。采用ATP含量法检测细胞活力。
1.2.7心肌细胞内钙测定制备细胞悬液2×106个/ml。于96孔板加细胞悬液,100 μl/孔37℃预热5 min。加入 Fura-2/AM 终浓度 5 μmol·L-1,37℃恒温震荡45 min。细胞负载结束后,加入SalA温孵5 min,加入刺激剂 KCl(50 mmol·L-1终)立即测定荧光变化。用双波长荧光法(激发光340 nm/380 nm,发射光500 nm)测定游离或与钙结合的Fura-2荧光值。
1.2.8心肌细胞线粒体膜电位(Δψ)的测定乳鼠原代心肌细胞种于96孔细胞培养板,与相应浓度的SalA作用1 h后。用Hanks液漂洗细胞1次,然后用3 mg·L-1的 JC-1 37℃负载15 min,Hanks液洗2遍,于荧光显微镜下观察拍照。并在Spectra Max M5酶标仪上490 nm激发荧光值,以红色荧光值590 nm与绿色荧光值527 nm比值的大小来表示膜电位的高低。
1.2.9心肌细胞ATP含量测定SD大鼠乳鼠心肌细胞原代,接种到96孔细胞培养板中,密度为5×103/孔。细胞种植24 h后,去血清,无血清低糖DMEM培养基洗1遍,再加入不同浓度的丹酚酸A(10-11~10-5mol·L-1)与细胞孵育 2 h,CellTiter-GloTM Luminescent Cell Viability Assay试剂盒检测ATP含量。
1.2.10培养大鼠心肌细胞搏动测定原代乳鼠心肌细胞种于96孔细胞培养板中,每孔5×105个细胞。培养3 d后,去血清,加入无血清DMEM/F12配制丹酚酸A,37℃ CO2孵箱中孵育12 h,取出培养板置于室温平衡1 h,观察心肌细胞搏动节律的变化,每孔循环计数4次。对心肌细胞跳动次数的影响 =(样品孔博动次数-正常对照孔博动次数)/正常孔搏动次数×100%
1.3统计学方法采用SPSS10.0进行统计,心律失常发生率采用秩和检验,其余采用one-way ANOVA检验。
2 结果
2.1丹酚酸A对缺血/再灌注性心律失常的影响
大鼠冠脉结扎后,心电图S-T段抬高,与R波融合。心肌缺血10 min,再灌注后可出现心律失常,各给药组均可增加心肌缺血时的心率水平。丹酚酸A(1.5 mg·kg-1)给药组有延迟再灌注性心律失常出现的时间,减轻再灌注性心律失常级别的趋势。另外可明显减低缺血后心律失常的级别及再灌注性心律失常持续的时间(均P<0.05)。利多卡因也可见相似的改善作用。而丹酚酸A(0.5 mg·kg-1)给药组则未见明显的改善作用(Tab 1)。
2.2丹酚酸A对心肌缺血/再灌注大鼠心肌酶活性的影响大鼠心肌缺血10 min,再灌注2 h,可见明显的血清中心肌酶的水平增高。丹酚酸A(1.5 mg·kg-1)组可降低缺血/再灌注后血清中 LDH、CK、CK-MB的含量,其中,CK与CK-MB的降低具有统计学意义(P<0.05)。而丹酚酸 A(0.5 mg·kg-1)组及利多卡因给药组未见明显的改善作用(Tab 2)。
Tab 1 Effect of SalA on rats’myocardial ischemia-reperfusion arrhythmia(±s,n=6)
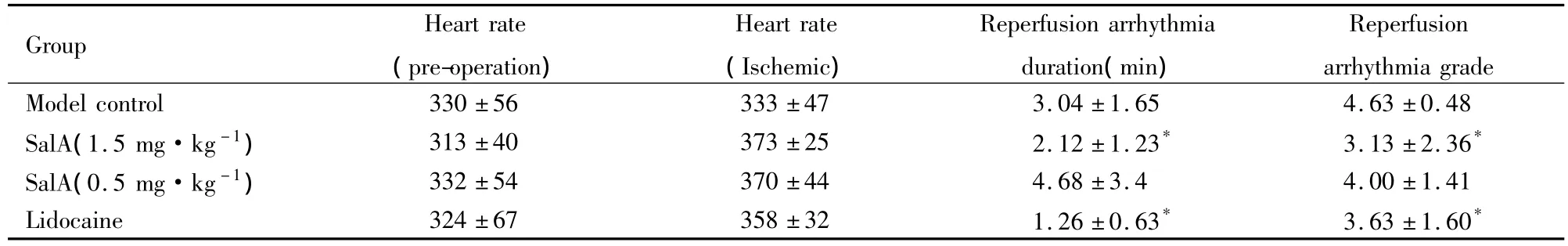
Tab 1 Effect of SalA on rats’myocardial ischemia-reperfusion arrhythmia(±s,n=6)
*P<0.05 vs control
Group Heart rate(pre-operation)Reperfusion arrhythmia grade Model control 330 ±56 333 ±47 3.04 ±1.65 4.63 ±0 Heart rate(Ischemic)Reperfusion arrhythmia duration(min).48 SalA(1.5 mg·kg-1)313 ±40 373 ±25 2.12 ±1.23* 3.13 ±2.36*SalA(0.5 mg·kg-1)332 ±54 370 ±44 4.68 ±3.4 4.00 ±1.41 Lidocaine 324 ±67 358 ±32 1.26 ±0.63* 3.63 ±1.60*
Tab 2 Effect of SalA on serum enzyme of myocardial in ischemia-reperfusion rats(U·L-1,±s,n=6)
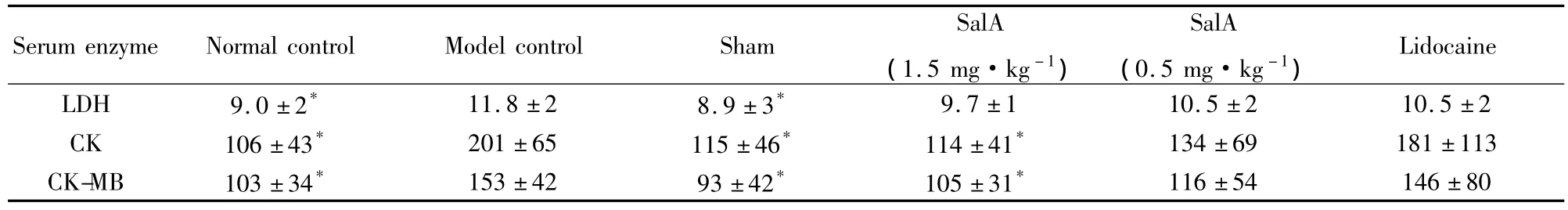
Tab 2 Effect of SalA on serum enzyme of myocardial in ischemia-reperfusion rats(U·L-1,±s,n=6)
*P<0.05 vs model
Serum enzyme Normal control Model control Sham SalA(1.5 mg·kg-1)9.7 ±1 10.5 ±2 10.5 ±2 CK 106±43* 201±65 115±46* 114±41* 134±69 181±113 CK-MB 103±34* 153±42 93±42* 105±31*Lidocaine LDH 9.0 ±2* 11.8 ±2 8.9 ±3*SalA(0.5 mg·kg-1)116±54 146±80
2.3丹酚酸A对大鼠心肌细胞缺氧-复氧损伤的影响乳鼠心肌细胞在培养d 2~3后出现节律性收缩,细胞呈波峰波谷样,波峰处细胞呈集簇样。心肌细胞缺氧1 h,复氧2 h后,细胞内ATP含量降低,上清液中LDH活性增高。而SalA 1×10-5~10-7mol·L-1,可增加心肌细胞内ATP的量(Fig 1)。提示SalA对大鼠心肌细胞缺氧-复氧损伤具有保护作用。
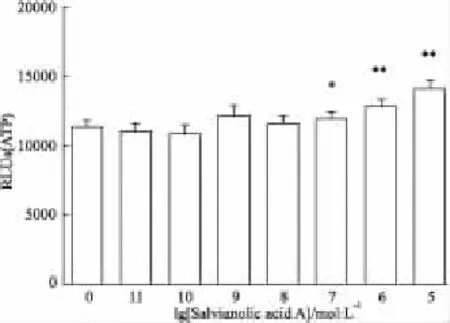
Fig 1 Effect of SalA on hypoxia-reoxygenation induced neonatal rats cardiac myocytes injury(±s,n=6,12 wells)
2.4丹酚酸A对心肌细胞内钙的影响与乳鼠心肌细胞孵育后,可见丹酚酸A对Fura-2/AM 340 nm/380 nm激发波长的比值有降低作用,提示丹酚酸A对KCl诱导的心肌细胞内钙具有降低作用(Fig 2)。

Fig 2 Effect of SalA on KCl stimulated neonatal rats cardiac myocytes inner Ca2+concentration(±s,n=4,12 wells)
2.5丹酚酸A对大鼠心肌细胞内线粒体膜电位(Δψ)的影响如Fig 3所示,与正常对照组相比,SalA 1×10-6~1 ×10-5mol·L-1可降低细胞红色荧光和绿色荧光的比值(P<0.05)。提示丹酚酸A呈剂量依赖性降低心肌细胞线粒体膜电位。
2.6丹酚酸A对乳鼠心肌细胞增殖及搏动的影响丹酚酸A对乳鼠心肌细胞增殖及搏动在大于1×10-5mol·L-1时均为抑制作用,与细胞活力检测结果相符,而低于1×10-6mol·L-1则表现为轻度促进作用(Fig 4)。
3 讨论
心肌缺血首要的治疗措施是恢复血流供应,但随之会产生缺血/再灌注性损伤的可能。由此,对缺血/再灌注损伤的机制探讨和药物开发是重要的课题。目前已经证明,多种药物对心肌缺血/再灌注有保护作用,但需要进一步临床验证[9-11]。本研究表明,丹酚酸A可改善大鼠缺血/再灌注引起的心率失常及细胞损伤,并对培养的心肌细胞缺氧-复氧损伤具有保护作用。该作用可能是通过降低缺血/再灌注损伤的细胞内钙水平,减少自由基,促进细胞内ATP生成,改善线粒体氧化磷酸化功能障碍实现的。
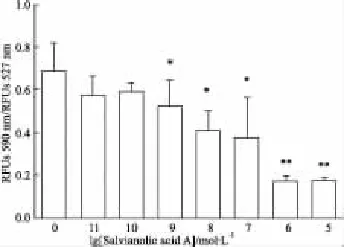
Fig 3 Effect of SalA on the mitochondrial membrane potential in neonatal rat cardiac myocytes(±s,n=4,12 wells)
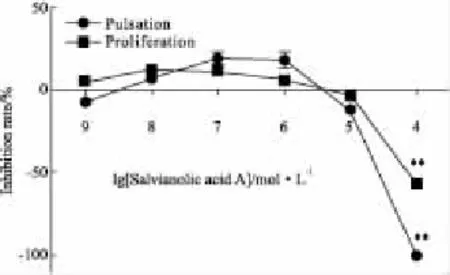
Fig 4 Effect of SalA on the pulsation and proliferation in neonatal rats cardiac myocytes(±s,n=4,12 wells)
缺血时间的长短与再灌注损伤的发生相关,缺血时间过短或过长都不易发生再灌注损伤[12-13]。我们研究表明,大鼠心肌缺血5~15 min,再灌注性心律失常的发生率较高;而心肌缺血30 min,再灌注性心律失常发生率则较低,但再灌注性心肌细胞坏死及凋亡发生率增加。本实验采用冠脉结扎10 min,诱导再灌注性室性心律失常的发生,其室性心律失常的发生率可达100%。丹酚酸A可明显延长大鼠室性心律失常出现的起始时间及降低室性心律失常的程度。本研究结果提示可能与抗氧化,抑制细胞钙超载,促进ATP生成等作用有关,进而阻止离子的异常通透及细胞损伤。另外,丹酚酸A促进钾通道开放,导致细胞膜超极化也可能是其抗缺血/再灌注性心律失常的机制之一[7]。
丹酚酸A对缺血/再灌注的保护作用还可从酶学的变化中反映,因本模型心肌缺血时间较短,细胞凋亡及坏死性损伤相对较轻,但仍可见血清中肌酸激酶及其同工酶水平上升,丹酚酸A对上述改变具有改善作用。乳酸脱氢酶反映损伤变化不敏感,丹酚酸A有降低血清中乳酸脱氢酶的趋势,但无统计学意义。
线粒体在心肌细胞保护方面发挥着重要的作用[14]。在心肌缺血时期,线粒体功能受损,ATP生成下降,细胞内钙水平升高,而钙超载则更加重了ATP生成的减少。在再灌注恢复氧供应时,虽然可增加ATP的生成,但是已经遭到损伤的电子传递链却可同时引起活性氧的大量产生。活性氧是导致缺血/再灌注性损伤的重要病理生理机制,在心肌缺血/再灌注后产生的活性氧还可损害内皮细胞的功能[15]。低水平的ATP、Ca超载及活性氧可导致细胞的损伤甚至死亡,因此,以线粒体为靶点的心肌保护作用至关重要[16-17]。
本研究显示,丹酚酸A可保护线粒体功能,同时对KCl诱导的细胞内钙增加具有抑制作用,提示丹酚酸A可能还具有抑制钙超载导致的凋亡作用。丹酚酸A可增加心肌细胞ATP生成,降低乳鼠心肌细胞内线粒体膜电位(Δψ),从而减少活性氧的产生。
综上所述,体内及体外实验均显示丹酚酸A对大鼠心肌缺血/再灌注性心律失常具有改善作用。其深入机制及临床应用效果需要进一步评价。
[1]Eisenberg M S,Mengert T J.Cardiac resuscitation[J].N Engl J Med,2001,344(17):1304 -13.
[2]Jennings R B,Sommers H M,Smyth G A,et al.Myocardial necrosis induced by temporary occlusion of a coronary artery in the dog[J].Arch Pathol,1960,70:68 -78.
[3]Ferdinandy P,Schulz R,Baxter G F.Interaction of cardiovascular risk factors with myocardial ischemia/reperfusion injury,preconditioning,and postconditioning[J].Pharmacol Rev,2007,59(4):418-58.
[4]Loor G,Schumacker P T.Role of hypoxia-inducible factor in cell survival during myocardial ischemia-reperfusion[J].Cell DeathDiffer,2008,15(4):686 -90.
[5]Huang Y S,Zhang J T.Antioxidative effect of three water- soluble components isolated from Salvia miltiorrhizain vitro[J].Acta Pharm Sin,1992,27(2):96 -100.
[6]王国振,严玉平,朱长福.丹酚酸A/丹酚酸B不同配比对大鼠心肌缺血/再灌注性损伤的保护作用[J].河北中医药学报,2006,21(2):4 -5,12.
[6]Wang G Z,Yan Y P,Zhu C F.Protective effect of different ratio of Salvianolic acid A and Salvianolic acid B on ischemia-reperfusion injury induced injury in rats[J].J Hebei TCM Pharmacol,2006,21(2):4 -5,12.
[7]杜冠华,裘 月,张均田.丹酚酸A对大鼠心肌缺血/再灌注性损伤的保护作用[J].药学学报,1995,30(10):731 -5.
[7]Du G H,Qiu Y,Zhang J T.Protective effect of Salvianolic acid A on ischemia-reperfusion induced injury in isolated rat heart[J].Acta Pharm Sin,1995,30(10):731 -5.
[8]Curtis M J,Walker M J.Quantification of arrhythmias using scoring systems:an examination of seven scores in anin vivomodel of regional myocardial ischaemia[J].Cardiovasc Res,1988,22(9):656-65.
[9]Arslan F,Smeets M B,O'Neill L A,et al.Myocardial ischemia/reperfusion injury is mediated by leukocytic toll-like receptor-2 and reduced by systemic administration of a novel anti-toll-like receptor-2 antibody[J].Circulation,2010,121(1):80 -90.
[10]Tokudome S,Sano M,Shinmura K,et al.Glucocorticoid protects rodent hearts from ischemia/reperfusion injury by activating lipocalin-type prostaglandin D synthase-derived PGD2 biosynthesis[J].J Clin Invest,2009,119(6):1477 -88.
[11]张羽冠,宋宏宇,李 蓥,等.蒺藜皂苷预适应对大鼠心肌缺血/再灌注损伤的保护作用[J].中国药理学通报,2010,26(6):714-8.
[11]Zhang Y G,Song H Y,Li Y,et al.Protective effect of GSTT preconditioning on myocardial ischemia-reperfusion injury in rats[J].Chin Pharmacol Bull,2010,26(6):714 -8.
[12]Miura H,Kiuchi K,Nejima J,Takano T.Limitation of infarct size and ventricular remodeling in patients with completely reperfused anterior acute myocardial infarction-the potential role of ischemia time[J].Clin Cardiol,2002,25(12):566 -71.
[13]Takahashi K,Takahashi T,Suzuki T,et al.Protective effects of SEA0400,a novel and selective inhibitor of the Na+/Ca2+exchanger,on myocardial ischemia-reperfusion injuries[J].Eur J Pharmacol,2003,458(1 -2):155 -62.
[14]Ong S B,Subrayan S,Lim S Y,et al.Inhibiting mitochondrial fission protects the heart against ischemia/reperfusion injury[J].Circulation,2010,121(18):2012 -22.
[15]Loukogeorgakis S P,van den Berg M J,Sofat R,et al.Role of NADPH oxidase in endothelial ischemia/reperfusion injury in humans[J].Circulation,2010,121(21):2310 -6.
[16]Nakagawa T,Shimizu S,Watanabe T,et al.Cyclophilin D-dependent mitochondrial permeability transition regulates some necrotic but not apoptotic cell death[J].Nature,2005,434(7033):652-8.
[17]Murphy E,Steenbergen C.Mechanisms underlying acute protection from cardiac ischemia-reperfusion injury[J].Physiol Rev,2008,88(2):581-609.
