溶血磷脂酸(LPA)对肿瘤转移的作用研究
2011-05-31刘玉萍王颖钰钱文慧岳志强郑仕中
刘玉萍,王颖钰,钱文慧,岳志强,陆 茵,2,郑仕中,2
(1.南京中医药大学药学院,江苏南京 210029;2.江苏省药效与安全性评价重点实验室,江苏南京 210046)
溶血磷脂酸(lysophosphatidicacid,LPA)是一种小分子的甘油磷脂,其化学结构为1-酰基-2-羟基-3-磷酸甘油(1-acyl-2-hydroxy-sn-glycerol-3-phosphate)。活化的血小板是生成LPA的主要来源[1],成熟的神经元、脂肪细胞及成纤维细胞等也可以产生LPA。LPA的产生主要经以下4条途径:①细胞内质网中,甘油-3-磷酸经乙酰辅酶A(CoA)酰基化产生LPA。②活化的血小板膜上的磷脂在分泌型磷脂酶A2(Phospholipase A2)和磷脂酰丝氨酸特异性磷脂酶A1(Phospholipase A1)的协同作用下产生溶血磷脂LP,后者经血浆脯氨酸肽酶(serum prolidase,PLD)的作用转化为 LPA[2]。③血小板活化后,磷脂酸(PA)被磷脂酶A2-ⅡA(PLA2-ⅡA)或膜结合型磷脂酶A1水解成LPA。④ 最新研究发现[3],肿瘤细胞、成纤维细胞及血管平滑肌细胞中存在着一种细胞运动刺激因子(autotoxin,ATX),可以水解溶血磷脂胆碱(LPC)产生LPA。
LPA是缺血性心脑血管病中起核心作用的脂类分子[4],常被作为血栓预警分子。长期研究表明LPA能够诱发心肌梗死,参与心肌重塑,诱导动脉粥样硬化恶化[5-6]。而早在1991年,Merchant等[7]发现在恶性肿瘤组织中存在着LPA等溶血磷脂类成分。其后涌现出大量关于LPA在肿瘤发生发展中作用的临床发现和实验研究。2003年,Gordon B.Mills在《Nat Rev Cancer》发表论文,明确提出LPA与肿瘤的发生及侵袭转移等恶性化程度密切相关[8],LPA在肿瘤发生发展中的作用逐渐受到研究人员的关注。结合近十年来国内外有关LPA与肿瘤转移的相关研究,发现LPA在肿瘤转移过程中的主要作用包括以下4点:①抑制肿瘤细胞凋亡,促进原位增殖;②促进肿瘤血管生成;③影响肿瘤细胞的粘附迁移能力;④促进癌栓的形成。
1 LPA抑制肿瘤细胞凋亡,促进原位增殖
机体内部癌基因与抑癌基因平衡被打破是导致肿瘤发生的主要原因,如在细胞癌变过程中,许多促凋亡基因功能受阻,而凋亡抑制基因的功能得到增强,结果导致肿瘤细胞无限增殖。Murph等[9]首次报道LPA能促进肺癌A549细胞中p53蛋白的降解,LPA与Gi偶联受体结合后,也可以抑制caspases的活性,上调Bcl-2的表达,结果致癌基因与抑癌基因比例失调,肿瘤细胞凋亡数目下降。此外LPA刺激Akt磷酸化、激活NF-κB也是其抑制肿瘤细胞凋亡的重要途径[10]。目前肿瘤化疗药物的主要作用为诱导细胞的凋亡,但是有很多药物出现了耐药性,且机制尚未明了,Zhang等[11]发现,LPA可以通过ATX-LPA信号轴对抗紫杉醇注射液诱导的胃肠癌SGC细胞凋亡,提示我们是否能够使用靶向LPA的抑制剂和化疗药物联合应用提高药物的疗效。研究显示LPA通过Gi/o蛋白激活Ras下游的丝裂原活化蛋白激酶[12],促进细胞的增殖。
2 LPA促进肿瘤血管生成
恶性肿瘤的无限制侵袭性生长及转移依赖于肿瘤组织血管生成过程中所提供的各类营养物质,血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)是最重要的促血管生成因子之一。Rivera-Lopez等[13]采用鸡胚尿囊模型研究LPA对血管生成的作用,对克隆的鸡胚LPA受体进行cDNA序列分析,发现了3种与哺乳动物同源的LPA受体(LPA1、LPA2和LPA3),采用LPA受体的激动剂和拮抗剂可以分别诱发和阻断LPA诱导的血管生成,同时检测到的表达也与上述结果趋势一致。肿瘤相关的成纤维细胞可以分泌α-平滑肌动蛋白、VEGF、基质细胞衍生因子-1等促血管生成因子,有研究发现LPA与其受体LPA1结合后促进A549细胞诱导体内人脂肪组织来源的间质干细胞(hASCs)分化为肿瘤相关成纤维细胞,进而促进血管生成[14]肿瘤组织缺氧后,缺氧诱导因子-1(hypoxia inducible factor 1,HIF-1)诱导VEGF等基因的表达,从而诱发血管新生,而LPA能诱导缺氧肿瘤组织中HIF-1α蛋白水平升高,后者促进VEGF蛋白和mRNA的表达水平上调[15]。在人脐静脉细胞中,LPA上调淋巴管标志性蛋白Prox-1、LYVE-1和podoplanin的表达,淋巴蛋白的表达有助于内皮细胞管的形成,促进内皮细胞参与淋巴管的形成。
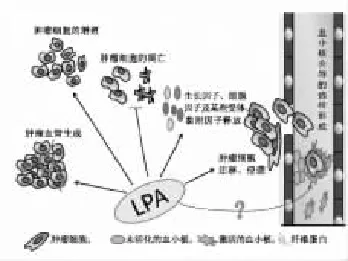
Fig 1 Role of LPA in tumor metastasis
3 LPA提高肿瘤细胞的迁移能力
实体瘤组织不仅包括肿瘤细胞,也包括一系列间质细胞如成纤维细胞、巨噬细胞等。LPA一方面直接影响肿瘤细胞运动能力,另一方面促进肿瘤间质细胞分泌白介素(IL-6、IL-8[16]等)、TNF-α 等细胞趋化因子,最终表现为促进肿瘤细胞的迁移侵袭能力。
LPA可以刺激细胞骨架蛋白肌动蛋白的磷酸化,导致肿瘤细胞运动能力增强,同时通过改变肿瘤细胞骨架结构调控肿瘤细胞的迁移。Hasegawa等[17]用LPA刺激血管扩张促进磷蛋白(Vasodilator-stimulated phosphoprotein,VASP)的磷酸化,发现前列腺癌XXX细胞形成片状伪足,侵袭和转移能力增强。Ca2+是细胞运动、迁移所需要的信号分子,LPA与其内源性的受体结合后可增加神经胶质瘤C6细胞外Ca2+的浓度,运用LPA受体抑制剂,则可导致C6细胞迁移能力明显下降[18]。由肿瘤组织及结缔组织合成并分泌的基质金属蛋白酶(MMPs)有助于肿瘤细胞降解基底膜、调控肿瘤细胞与基质的粘附、自发刺激肿瘤细胞迁移等多种作用[19],而研究发现LPA主要通过诱导表皮因子生长受体(EGFR)的磷酸化导致MMP的表达增高,LPA还可以通过与自身受体LPA1结合,促进 MMP-9、MMP-2的表达[20-21]。此外,LPA 还可以影响E-钙黏素介导的皮性肿瘤细胞间的粘附,E-钙粘素的低表达促使肿瘤细胞游离,侵袭性升高。在上皮卵巢癌细胞OVCA429和IOSE-29中可检测到E钙黏素的表达,用LPA处理细胞后,E-钙粘连蛋白(80 ku)呈可溶性碎片脱落,说明LPA诱导E-钙粘素的表达下调,促进肿瘤的迁移侵袭[22]。
4 LPA促进癌栓的形成
在肿瘤血行转移过程中,从原位脱落的肿瘤细胞通过迁移、侵袭进入血液系统,单个肿瘤细胞由于失巢凋亡或受到循环系统阻力如血流剪切力等的机械损伤,以及宿主血液系统的免疫细胞等的攻击,能够存活下来的肿瘤细胞非常少[23]。而研究发现血小板在肿瘤血行转移中起关键作用,活化的血小板能够与肿瘤细胞、纤维蛋白相互包绕形成微小癌栓(cancer embolus),帮助肿瘤细胞的远端转移[24]。血小板活化后释放大量的LPA,同时LPA通过与血小板膜的LPA-GPCR结合进一步促进血小板的激活,改变血小板的形态,从而表现出强大的级联放大效应[25]。临床发现,肿瘤病人普遍存在着血液高凝、发生血栓的现象,研究发现LPA还可调节活化后的血小板与可溶性纤维蛋白原结合的受体,启动可溶性纤维蛋白原与血小板结合,使纤维蛋白原水解为纤维蛋白,为凝血准备条件。因此,LPA可能通过调节血小板与肿瘤细胞的相互作用,干扰了凝血相关的级联通路从而促进肿瘤的血行转移,目前国内外相关的研究非常少。
5 展望
肿瘤转移是个很复杂的过程,这给临床上抗肿瘤治疗带来了很大的困扰。临床研究发现,LPA的存在大大加剧了卵巢癌、子宫癌、及乳腺癌等妇科癌症的恶性化程度,但对其他类型肿瘤的恶性程度影响有待于进一步观察。在关注于LPA对肿瘤转移促进作用的同时,我们发现LPA受体的作用也不容忽视。目前共发现7种LPA的受体,某些受体对肿瘤的恶性化发展也有推动作用,如LPA2能够介导乳腺癌细胞Rho依赖型的趋化性[26]、促进恶性胸间质瘤细胞的增殖和运动能力[27]等。
针对LPA及其受体在肿瘤中的作用,以它们为靶点的抗肿瘤策略已成为近几年研究的热点,主要着眼于减少LPA合成、阻断LPA代谢途径、抑制LPA受体的活性及其信号传导通路等方面。靶向LPA药物为抗肿瘤治疗提供了新的思路,一些LPA受体抑制剂经研究证明有很好的应用前景,例如LPA3受体拮抗剂Ki16425通过实验研究发现能有效抑制胰腺癌细胞的迁移和侵袭[28]。但同时也存在一些问题:①LPA的表达在不同类型肿瘤之间是否存在差异性,这种差异性对肿瘤发生发展的影响是什么;②LPA的受体多、调控的信号通路多,抑制某一受体或者一条信号通路是否能达到治疗目的,也即如何找到关键的药物作用靶点;③靶向LPA药物的研究基本还停留在实验室阶段,甚至有些药物仅在体外实验中开展,从临床前研究走向临床研究还有很漫长的道路。因此需要进一步深入探讨LPA参与肿瘤转移的具体机制,来解决为开发有关LPA及其受体为靶点的抗肿瘤药物带来困难。
[1]Sandmann G,Siess W,Essler M.Lysophosphatidic acid is the unique platelet-activating substance in human malignant ascites[J].Eur J Med Res,2003,8(9):397-404.
[2]Ye X.Lysophospholipid signaling in the function and pathology of the reproductive system[J].Hum Reprod Update,2008,14(5):519-36.
[3]Cui P,Tomsig J L,McCalmont W F,et al.Synthesis and biological evaluation of phosphonate derivatives as autotaxin(ATX)inhibitors[J].Bioorg Med Chem Lett,2007,17(6):1634-40.
[4]Li Z G,Yu Z C,Yu Y P,et al.Lysophosphatidic Acid level and the incidence of silent brain infarction in patients with nonvalvular atrial fibrillation[J].Int J Mol Sci,2010,11(10):3988-98.
[5]Karliner J S.Lysophospholipids and the cardiovascular system[J].Biochim Biophys Acta,2002,1582(1-3):216-21.
[6]Bot M,Bot I,Lopez-Vales R,et al.Atherosclerotic lesion progression changes lysophosphatidic acid homeostasis to favor its accumulation[J].Am J Pathol,2010,176(6):3073-84.
[7]Merchant T E,Kasimos J N,Graaf P W,et al.Phospholipid profiles of human colon cancer using 31P magnetic resonance spectroscopy[J].Int J Colorectal Dis,1991,6(2):121-6.
[8]Mills G B,Moolenaar W H.The emerging role of lysophosphatidic acid in cancer[J].Nat Rev Cancer,2003,3(8):582-91.
[9]Murph M M,Hurst-Kennedy J,Newton V,et al.Lysophosphatidic acid decreases the nuclear localization and cellular abundance of the p53 tumor suppressor in A549 lung carcinoma cells[J].Mol Cancer Res,2007,5(11):1201-11.
[10]Saunders J A,Rogers L C,Klomsiri C,et al.Reactive oxygen species mediate lysophosphatidic acid induced signaling in ovarian cancer cells[J].Free Radic Biol Med,2010,49(12):2058-67.
[11]Zhang R,Wang J,Ma S,et al.Requirement of Osteopontin in the migration and protection against Taxol-induced apoptosis via the ATX-LPA axis in SGC7901 cells[J].BMC Cell Biol,2011,12:11.
[12]邵 璇,迟晓丽,周文霞,张永祥.自分泌运动因子及其受体与神经系统的关系研究进展[J].中国药理学通报,2009,25(12):1541-5.
[12]Shao X,Chi X L,Zhou W X,Zhang Y X.Research progress in the relations ip of autocrine m otility factor,autocrine motility factor receptor and the nervous system[J].Chin Pharmacol Bull,2009,25(12):1541-5.
[13]Rivera-Lopez C M,Tucker A L,Lynch K R.Lysophosphatidic acid(LPA)and angiogenesis[J].Angiogenesis,2008,11(3):301-10.
[14]Jeon E S,Lee I H,Heo S C,et al.Mesenchymal stem cells stimulate angiogenesis in a murine xenograft model of A549 human adenocarcinoma through an LPA1 receptor-dependent mechanism[J].Biochim Biophys Acta,2010,1801(11):1205-13.
[15]Park S Y,Jeong K J,Lee J,et al.Hypoxia enhances LPA-induced HIF-1alpha and VEGF expression:their inhibition by resveratrol[J].Cancer Lett,2007,258(1):63-9.
[16]Chen S U,Lee H,Chang D Y,et al.Lysophosphatidic acid mediates interleukin-8 expression in human endometrial stromal cells through its receptor and nuclear factor-kappaB-dependent pathway:a possible role in angiogenesis of endometrium and placenta[J].Endocrinology,2008,149(11):5888-96.
[17]Hasegawa Y,Murph M,Yu S,et al.Lysophosphatidic acid(LPA)-induced vasodilator-stimulated phosphoprotein mediates lamellipodia formation to initiate motility in PC-3 prostate cancer cells[J].Mol Oncol,2008,2(1):54-69.
[18]Chang Y J,Kim Y L,Lee Y K,et al.Dioleoyl phosphatidic acid increases intracellular Ca2+through endogenous LPA receptors in C6 glioma and L2071 fibroblasts[J].Prostaglandins Other Lipid Mediat,2007,83(4):268-76.
[19]陈晓峰,顾振纶,梁中琴,等.基质金属蛋白酶与肿瘤侵袭和转移研究进展[J].中国药理学通报,2001,17(3):253-6.
[19]Chen X F,Gu Z L,Liang Z Q,et al.Progress in study of matrix metalloproteinases and tumour invasion and metastasis[J].Chin Pharmacol Bull,2001,17(3):253-6.
[20]Park S Y,Jeong K J,Panupinthu N,et al.Lysophosphatidic acid augments human hepatocellular carcinoma cell invasion through LPA1 receptor and MMP-9 expression[J].Oncogene,2011,30(11):1351-9.
[21]Wang F Q,Ariztia E V,Boyd L R,et al.Lysophosphatidic acid(LPA)effects on endometrial carcinoma in vitro proliferation,invasion,and matrix metalloproteinase activity[J].Gynecol Oncol,2010,117(1):88-95.
[22]Gil O D,Lee C,Ariztia E V,et al.Lysophosphatidic acid(LPA)promotes E-cadherin ectodomain shedding and OVCA429 cell invasion in an uPA-dependent manner[J].Gynecol Oncol,2008,108(2):361-9.
[23]Steeg P S.Tumor metastasis:mechanistic insightsand clinical challenges[J].Nat Med,2006,12(8):895-904.
[24]Nieswandt B,Hafner M,Echtenacher B,Männel D N.Lysis of tumor cells by natural killer cells in mice is impeded by platelets[J].Cancer Res,1999,59(6):1295-300.
[25]Pamuklar Z,Lee J S,Cheng H Y,et al.Individual heterogeneity in platelet response to lysophosphatidic acid:evidence for a novel inhibitory pathway[J].Arterioscler Thromb Vasc Biol,2008,28(3):555-61.
[26]Chen M,Towers L N,O’Connor K L.LPA2(EDG4)mediates Rho-dependent chemotaxis with lower efficacy than LPA1(EDG2)in breast carcinoma cells[J].Am J Physiol Cell Physiol,2007,292(5):1927-33.
[27]Yamada T,Yano S,Ogino H,et al.Lysophosphatidic acid stimulates the proliferation and motility of malignant pleural mesothelioma cells through lysophosphatidic acid receptors,LPA1 and LPA2[J].Cancer Sci,2008,99(8):1603-10.
[28]Yamada T,Sato K,Komachi M,et al.Lysophosphatidic acid(LPA)in malignant ascites stimulates motility of human pancreatic cancer cells through LPA1[J].J Biol Chem,2004,279(8):6595-605.
